страница 1
16 ЭЛЕКТРИЧЕСКИЙ ТОК В ГАЗАХ И ЖИДКОСТЯХ. ЗАКОНЫ ЭЛЕКТРОЛИЗА ФАРАДЕЯ
Электрический ток в газах называется газовым разрядом. Газовый разряд бывает самостоятельным и несамостоятельным. Несамостоятельный газовый разряд не может существовать без внешнего ионизатора, который создаёт в газе свободные носители заряда. Для наблюдения газового разряда используется стеклянная трубка, в которой предварительно создаётся высокий вакуум, то есть другие газы из неё удаляются. Исследуемый газ вводится в трубку при низком давлении. По мере возрастания электрического напряжения, приложенного к газоразрядной трубке, сила электрического тока сначала увеличивается, но потом достигает предельного значения, или тока насыщения. Возникновение тока насыщения означает, что все свободные ионы и электроны, образуемые в газе внешним ионизатором, участвуют в создании тока и достигают электродов газоразрядной трубки. При дальнейшем увеличении электрического напряжения может возникнуть самостоятельный газовый разряд, который может поддерживаться без внешнего ионизатора. В этом случае свободные электроны, существующие в газе, сильно разгоняются электрическим полем за время свободного пробега. При столкновении электрона с атомом газа может происходить ионизация атома, в результате которой образуются новые свободные носители заряда. Следовательно, возникает электронная лавина, и необходимость во внешнем ионизаторе газа отпадает. Условие ионизации атома можно записать в виде
 , (16.1) , (16.1)
где  - заряд электрона; - заряд электрона;
 - напряжённость электрического поля в газоразрядной трубке; - напряжённость электрического поля в газоразрядной трубке;
 - длина свободного пробега электрона; - длина свободного пробега электрона;
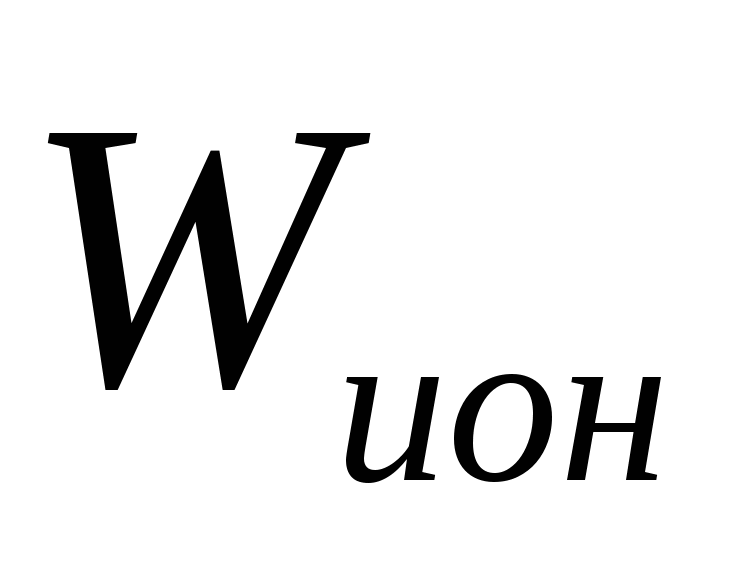 - энергия ионизации атома. - энергия ионизации атома.
В левой части неравенства (16.1) записана работа, совершаемая электрическим полем над электроном во время его свободного пробега.
Кроме процесса ионизации атомов газа быстрыми свободными электронами, или объёмной ионизации, возможна также поверхностная ионизация катода. Она заключается в возникновении вторичной электронной эмиссии с катода под действием бомбардировки положительными ионами, которые приобрели высокую энергию при своём упорядоченном движении к катоду в электрическом поле. Одновременное существование и объёмной, и поверхностной ионизации имеет важное значение для осуществления самостоятельного разряда. Возможны также и другие процессы, например, испускание электронов с катода, вызванное излучением самого разряда (фотоэлектрический эффект). Кроме того, свободные электроны, поддерживающие лавину, могут появляться в газе при соударении атомов с положительными ионами или вследствие фотоионизации.
Выделяют четыре основных типа газового разряда: искровой, тлеющий, дуговой и коронный.
Необходимым условием искрового разряда является высокое электрическое напряжение, такой разряд наблюдается в воздухе в электрических полях, близких к однородному полю.
Для тлеющего разряда характерно низкое давление газа, при котором длина свободного пробега электронов  является значительной, что обеспечивает выполнение условия (16.1). является значительной, что обеспечивает выполнение условия (16.1).
Дуговой разряд происходит при очень малом сопротивлении разрядного промежутка. При этом сила тока является очень большой, достигая десятков и сотен ампер, а напряжение на разрядном промежутке понижается до нескольких десятков вольт. Электрическую дугу при атмосферном давлении обычно получают с помощью специальных угольных электродов. Чтобы осуществить дуговой разряд, необходима высокая температура отрицательного электрода. При этом возникает интенсивная термоэлектронная эмиссия с этого электрода, которая является основной причиной ионизации газа, в результате газ в дуге приобретает высокую электропроводность.
Необходимым условием коронного разряда является наличие сильно неоднородного электрического поля. Такое поле можно получить, используя электроды, поверхности которых сильно различаются по форме и размерам. Один из электродов должен иметь поверхность с очень малым радиусом кривизны. Вблизи этого электрода напряжённость электрического поля сильно возрастает, и образуется область ионизированного газа. Часть энергии, приобретаемой свободными электронами в электрическом поле, выделяется в виде света. Это приводит к возникновению светящейся короны вблизи выпуклого электрода с сильно искривлённой поверхностью.
Во всех случаях в области газового разряда образуется частично или полностью ионизированный газ, или плазма.
Рассмотрим также электропроводность жидкостей. Электрический ток в жидкостях возможен благодаря диссоциации, то есть распаду их молекул на ионы. В электролитах, которые представляют собой растворы солей, кислот или щелочей в воде, такая диссоциация молекул растворенного вещества происходит под действием электрического поля молекул воды. В разделе 9 мы в качестве примера электрического взаимодействия молекул приводили электролитическую диссоциацию. Вследствие этого процесса молекулы растворённого вещества существуют в электролите в виде положительно и отрицательно заряжённых ионов. Под действием электрического поля отрицательный ион попадает на анод, передаёт аноду свой отрицательный заряд, в результате чего один или несколько электронов (в зависимости от заряда иона) проходят по внешней цепи. При этом ион становится нейтральным атомом или молекулой и выделяется на аноде. Аналогично положительный ион достигает катода, где приобретает один или несколько недостающих электронов, становится нейтральным атомом или молекулой и выделяется на катоде.
Таким образом, прохождение электрического тока через электролит сопровождается выделением вещества на электродах. Этот процесс называется электролизом и подчиняется законам Фарадея. В соответствии с первым законом электролиза, масса  выделившегося вещества прямо пропорциональна электрическому заряду выделившегося вещества прямо пропорциональна электрическому заряду 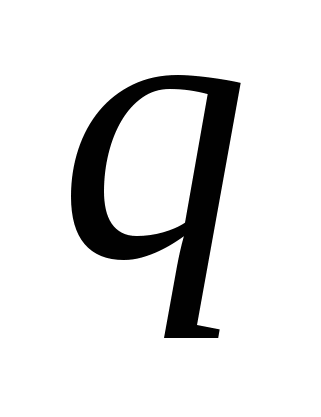 , прошедшему через раствор: , прошедшему через раствор:
 , (16.2) , (16.2)
где  - электрохимический эквивалент. - электрохимический эквивалент.
Второй закон электролиза гласит, что электрохимический эквивалент вещества пропорционален его химическому эквиваленту, то есть отношению атомной массы вещества 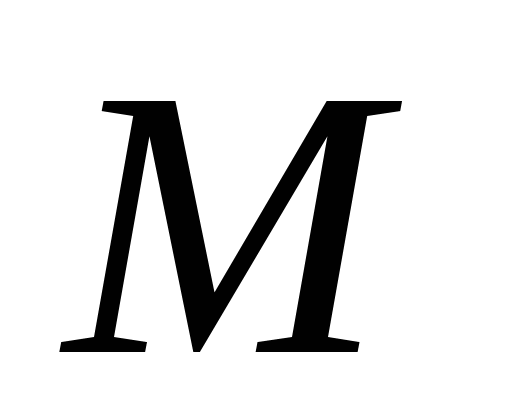 к валентности к валентности  : :
 , (16.3) , (16.3)
где 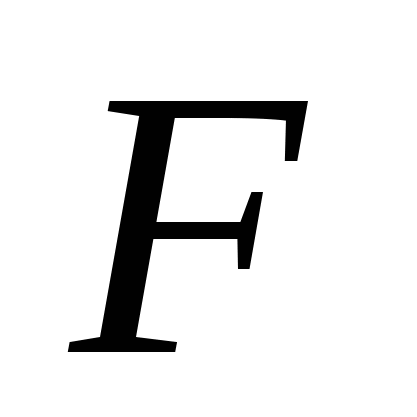 - постоянная Фарадея. - постоянная Фарадея.
Законы электролиза можно объяснить, учитывая атомистическое строение вещества и дискретность электрического заряда. Поскольку каждый ион имеет заряд  , то количество выделившихся ионов равно , то количество выделившихся ионов равно
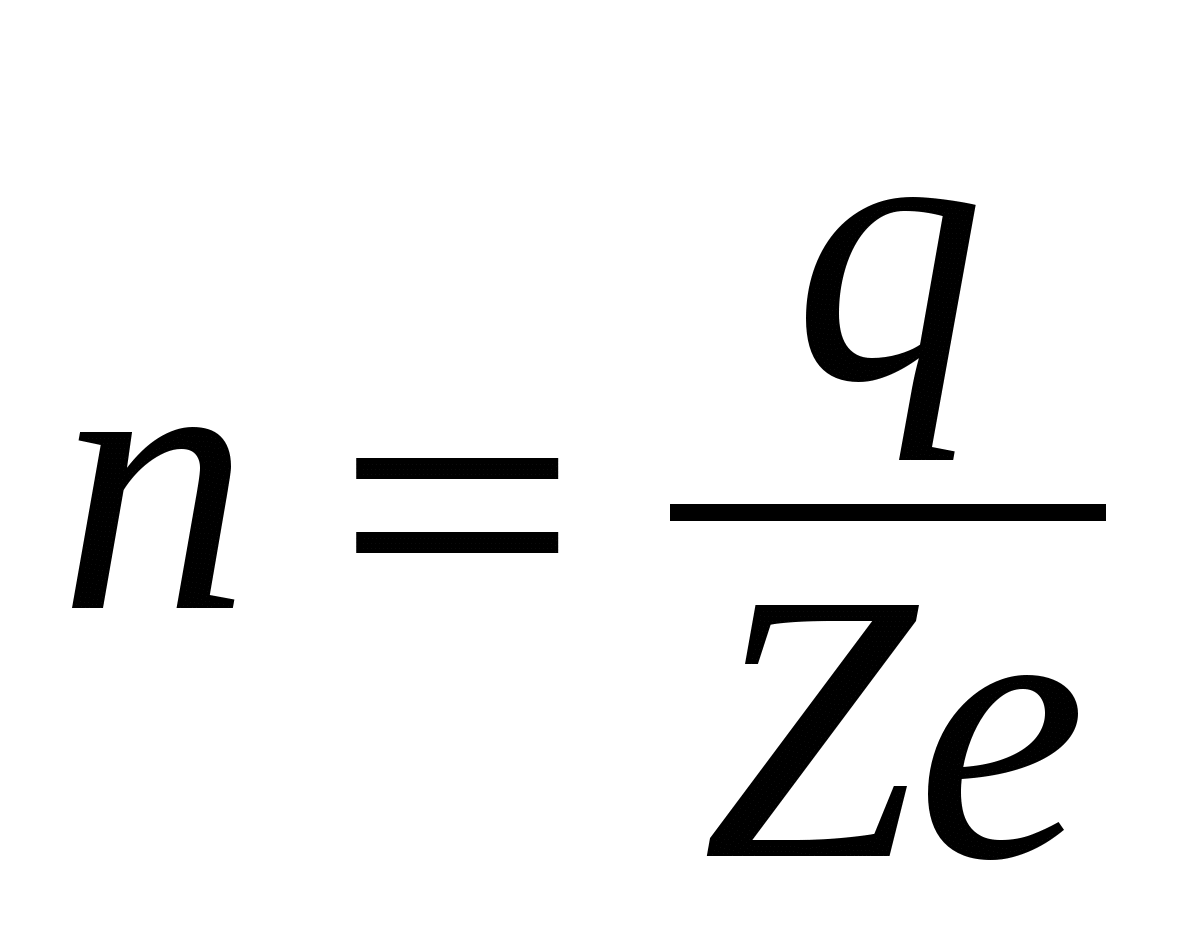 . (16.4) . (16.4)
С другой стороны, количество ионов выделившегося вещества можно представить в виде
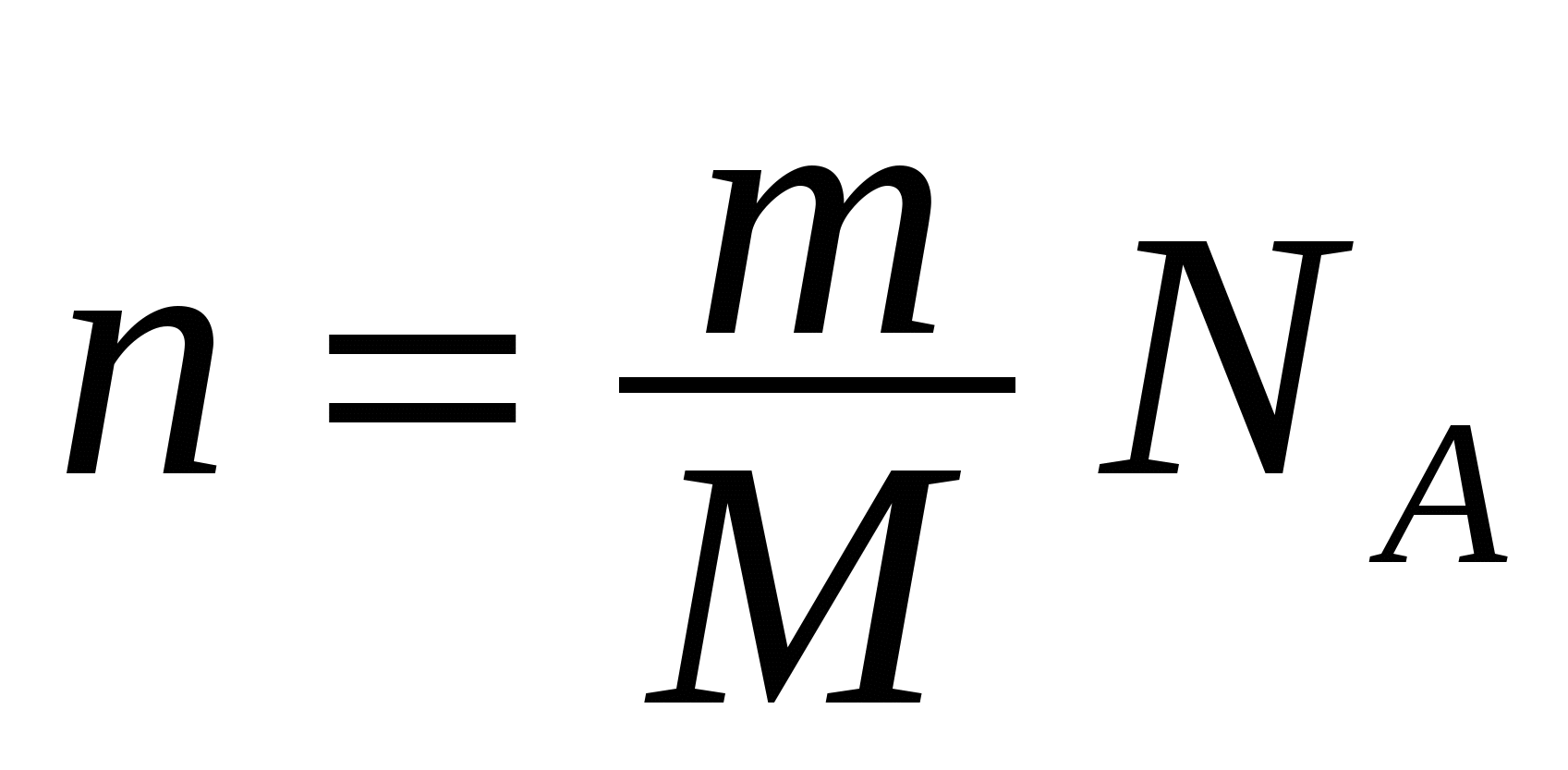 , (16.5) , (16.5)
где  - число Авогадро. - число Авогадро.
Приравнивая выражения для 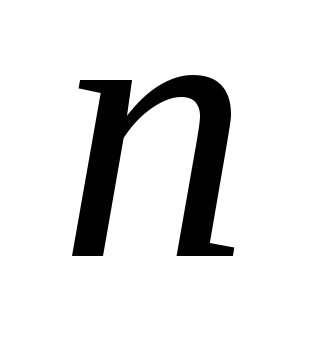 (16.4) и (16.5), получаем обобщенный закон электролиза (16.4) и (16.5), получаем обобщенный закон электролиза
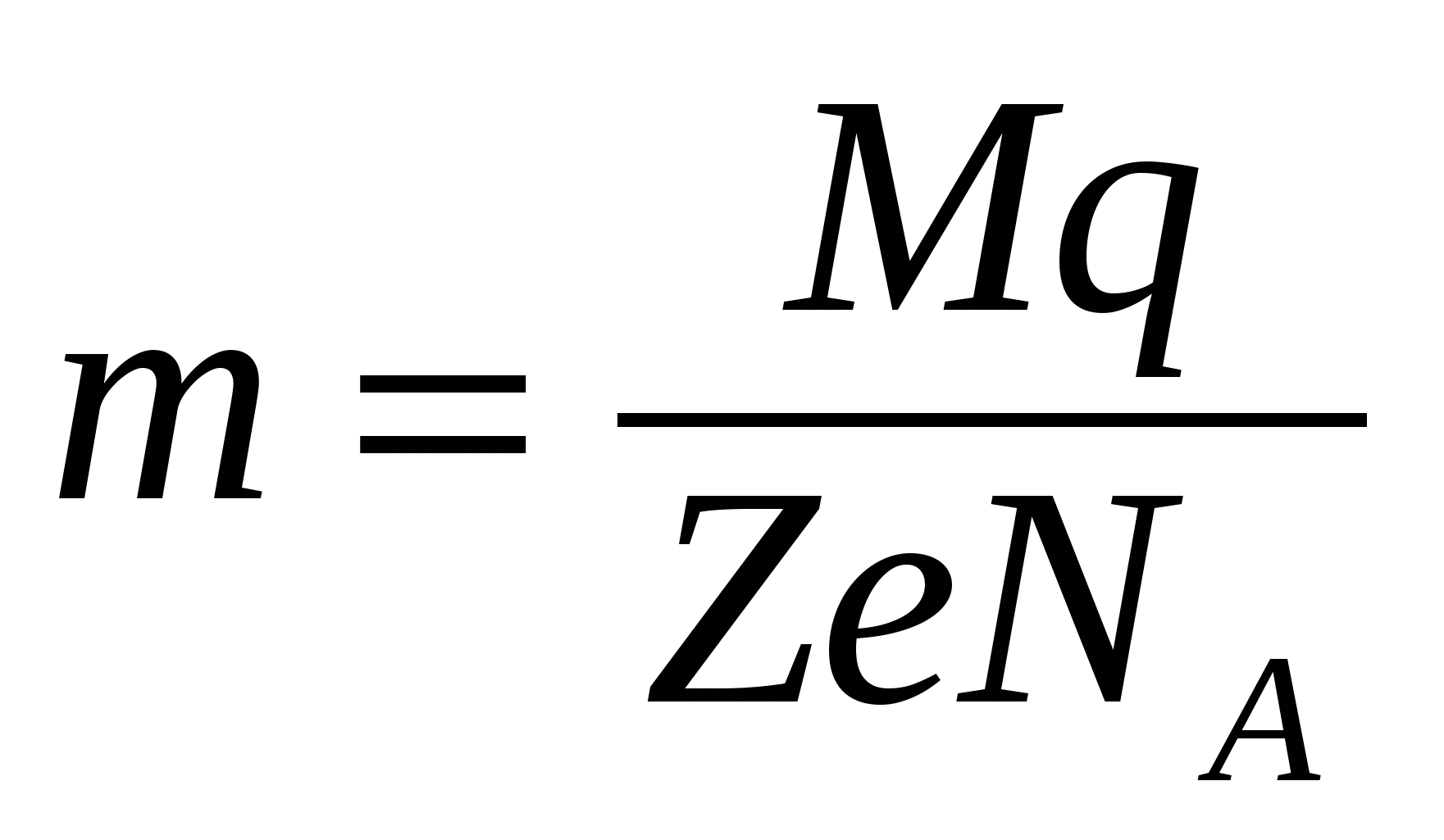 . (16.6) . (16.6)
Из сравнения формул (16.2), (16.3) и (16.6) следует выражение для постоянной Фарадея
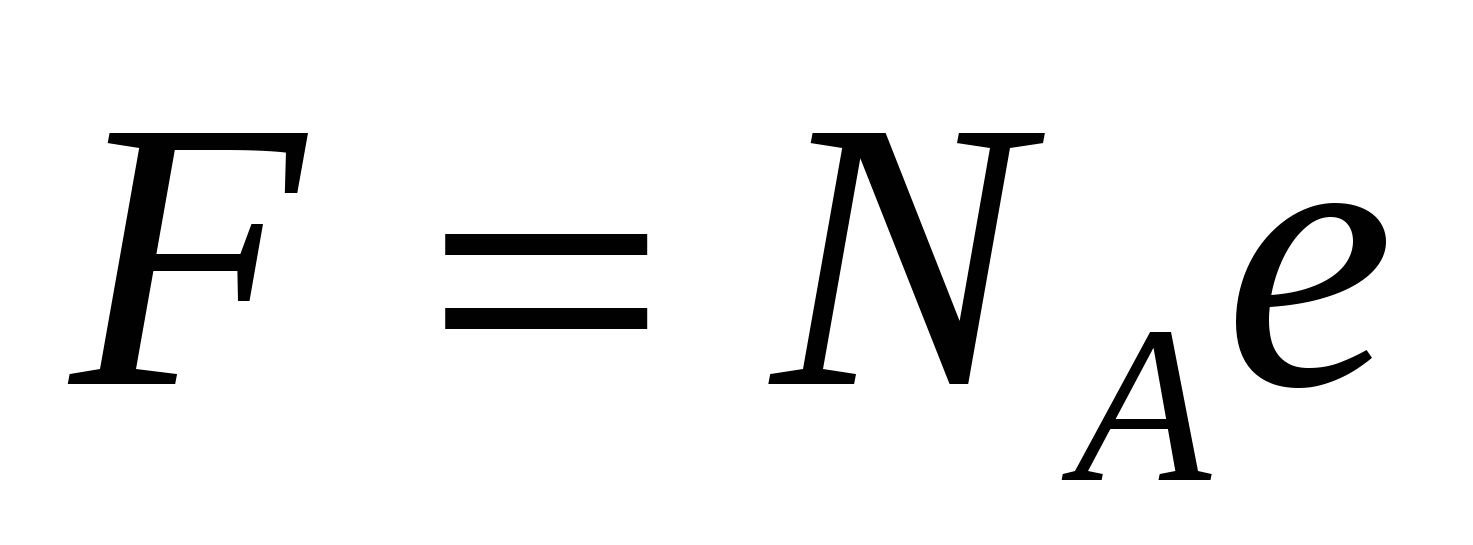 . (16.7) . (16.7)
Используя соотношение (16.7), можно показать, что электрические заряды ионов различных веществ кратны некоторому элементарному заряду. Такой вывод о дискретности электрического заряда в 1881 г. сделали Гельмгольц и Стоней.
Явление электролиза интересно, в частности, тем, что находится на стыке электричества и молекулярной физики. Электролиз находит практическое применение в промышленности при нанесении защитных покрытий, например, хромировании и никелировании деталей автомобилей.
страница 1
|