страница 1 страница 2 страница 3 | страница 4 | страница 5
Основные положения, выносимые на защиту: -
термохимия растворения терпеноидов, алкалоидов, флавоноидов и их производных в диоксане, 96%-ном этаноле и воде;
-
калориметрическое исследование температурных зависимостей теплоемкости терпеноидов, алкалоидов, флавоноидов и их производных;
-
энтальпии сгорания, плавления и образования исследуемых соединений;
-
стандартные энтальпии образования неорганических производных природных соединений.
Личный вклад автора заключается в постановке задач исследований, непосредственном участии в проведении эксперимента, анализе и обобщении полученных результатов исследования.
Апробация работы. Материалы диссертационной работы обсуждались на: Международной научной конференции «Современные технологии и управление качеством в образовании, науке и производстве: опыт адаптации и внедрения» (2001 г., г. Бишкек, КТУ им. Раззакова, Кыргызстан), III, IV, VI – Беремжановских съездах по химии и химической технологии (2001 г., ВКГУ, г. Усть-Каменогорск; 2004 г., КазНУ, им. аль-Фараби, г. Алматы; 2008 г., КарГУ им. Е.А. Букетова, г. Караганда), Международной научно-практической конференции, посвященной 10-летию независимости Республики Казахстан «Современные проблемы образования и науки в начале века» (2001 г., КарГУ им. Е.А. Букетова, г. Караганда), на Международном симпозиуме «4th International Symposium on the Chemistry of National Compounds» (2001 г., Isparta, Turkey), Международной научно-практической конференции, посвященной 100-летию академика А.Б. Бектурова «Химия: наука, образование, промышленность. Возможности и перспективы развития» (2001 г., ПГУ им. С. Торайгырова, г. Павлодар), Международной научно-практической конференции, посвященной 30-летию КарГУ им. Е.А. Букетова «Актуальные проблемы высшего образования и науки в XXI веке» (2002 г., КарГУ им. Е.А. Букетова, г. Караганда), Международной научно-практической конференции, посвященной 70-летию со дня рождения проф. Х.К. Оспанова «Термодинамика и кинетика равновесных и неравновесных химических процессов» (2002 г., КазНУ им. аль-Фараби, г. Алматы), Международной научной конференции «Герасимовские чтения», посвященной 100-летию со дня рождения член-корр. АН СССР Я.И. Герасимова (2003 г., МГУ им. М.В. Ломоносова, г. Москва, Россия), I и II Международной научной конференции «Химия, технология и медицинские аспекты природных соединений» (2003 г., КазНУ им. аль-Фараби, г. Алматы), Международных научно-практических конференциях «Этапы становления, современное становление и фундаментальные проблемы развития образования и науки Казахстана» (2003 г., Современный гуманитарный университет, г. Караганда), «Валихановские чтения-9» (2004 г., КГУ им. Ч. Валиханова, г. Кокшетау), II, IV Международных научно-практических конференциях «Теоретическая и экспериментальная химия» (2004 г., КарГУ им. Е.А. Букетова, г. Караганда), Международной конференции «Химия и применение природных и синтетических биологически активных соединений» (2004, ИХН им. А. Бектурова, г. Алматы), на Всероссийском симпозиуме по термохимии и калориметрии (2004 г., Нижегородский гос. университет им. Лобачевского, г. Нижний Новгород, Россия), на III, IV, V – Международных конференциях «Кинетика и механизм кристаллизации. Нанокристаллизация» (2006, 2008 г. г., Институт химии растворов РАН, г. Иваново, Россия), на Международном научно-техническом симпозиуме, посвященном 50-летию Кыргызского технического университета им. Раззакова (2004 г., КТУ им. Раззакова, г. Бишкек, Кыргызстан), на XV Международной конференции по химической термодинамике (2005 г., МГУ им. М.В. Ломоносова, Россия), на Международном симпозиуме «6th International Symposium on the Chemistry of National Compounds (SCNC)» (2005 г., Ankara, Turkey), на Международной научно-практической конференции, посвященной 80-летию Е.А. Букетова (2005 г., КарГУ им. Е.А. Букетова, Караганда), IV Всероссийской научной конференции «Химия и технология растительных веществ» (2006 г., г. Сыктывкар, Россия), XVIII Менделеевском съезде по общей и прикладной химии (2007 г., Институт физической химии и электрохимии РАН, г. Москва, Россия), Международных научно-практических конференциях «Терпеноиды: достижения и перспективы применения в области химии, технологии производства и медицины» (2008 г., АО «НПЦ «Фитохимия», г. Караганда), «Современное состояние и перспективы развития науки и высшего образования в Центральном Казахстане» (2008 г., Институт органического синтеза и углехимии, г. Караганда), «Актуальные проблемы химии природных соединений» (2009 г., г. Ташкент, Узбекистан), «Естественно-гуманитарные науки и их роль в реализации программы индустриально-инновационного развития Республики Казахстан» (2009 г., Казахский национальный технический университет им. К.И. Сатпаева г. Алматы).
Публикации. По результатам диссертационной работы опубликовано 35 статей, 39 материалов международных и республиканских научных и научно-практических конференций.
Объем и структура работы. Объем диссертационной работы составляет 200 страниц, в т.ч. 36 рисунков, 66 таблиц и состоит из введения, 8 глав, заключения, списка использованных источников, приложения. Список использованных источников состоит из 190 наименований.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
Во введении обоснована актуальность, научная новизна и практическая значимость работы, сформулированы цель и задачи исследования.
1. Современное состояние физико-химии ряда классов биологически активных веществ растительного происхождения
Анализ литературных данных в области термодинамики природных соединений, как терпеноидов, алкалоидов, флавоноидов и их производных показал практическое отсутствие исследований в данном направлении. Имеются сведения по изучению термодинамических характеристик алкалоида никотина и его производных, а из термодинамических данных терпеноидов известны лишь некоторые энтальпийные характеристики монотерпенов.
2. Калориметрия растворения ряда моно-, сескви-, тритерпеноидов и их некоторых модифицированных производных в диоксане, этаноле и воде
2.1 Методика исследований
Термохимическое исследование растворения терпеноидов проводили при 25 С на изотермическом дифференциально автоматическом калориметре ДАК-1-1А. Погрешность измерения энергии тепловыделений 1,5-2 %. Проверку калибровки прибора проводили путем измерения Н0 растворения трижды перекристаллизованного KCl при разбавлениях, равных 1:1600, 1:2400, 1:3200 (моль соли:моль воды). Усредненное значение энтальпии растворения КCl в воде (17860 283 Дж/моль) хорошо согласуется с рекомендованной величиной, равной 17577 34 Дж/моль и справочными данными по Н0 растворения КСl при указанных разбавлениях.
2.2-2.12 Термохимия моно-, сескви-, тритерпеноидов и их производных
Энтальпии растворения монотерпеноидов – пиразольного пулегона C10H16N2O2, оксима циклоартемизиа кетона С9H17NO, сесквитерпеновых лактонов с одинаковой общей формулой С15Н18О3 – арглабина, ахиллина, эстафиатина, леукомизина, -сантонина и сесквитерпеновых лактонов артемизинина С15Н22О5, стизолицина С19Н24О7, оксима гроссмизина С15H19NO4, кристаллогидратов аустрицина С15Н18О42Н2О, гроссмизина С15Н18О42Н2О, матрикарина С17Н20О5, 9-гидроксиэпибальзамина С20Н26О6, 8-(4-гидроксисенециоат) 9-гидроксиэпибальзамина С20Н26О7, производных сесквитерпеновых лактонов гидрохлорида диметиламиноарглабина С17Н25О3NHCl, метилиодида диметиламиноарглабина С18Н28О3NI, метилиодида диэтиламиноарглабина С20Н32О3NI, гидроиодида диметиламиностизолина С17Н28О4NI, метилиодида диметиламиногроссгемина С18Н28О4NI, метилиодида диэтиламиногроссгемина С20Н32О4NI, нового производного сесквитерпенового лактона – нитрата диметиламиноарглабина С17Н25О3NНNO3, тритерпеноидов – глицирретовой кислоты С30Н46О4 и бетулина С30Н50О2 в диоксане, 96 %-ном этаноле и воде при различных разбавлениях исследовали при 25 С на изотермическом калориметре ДАК-I-IА. При каждом разбавлении проведено по 5 параллельных опытов и результаты усреднялись.
На основании известной зависимости Нmраст.=a+b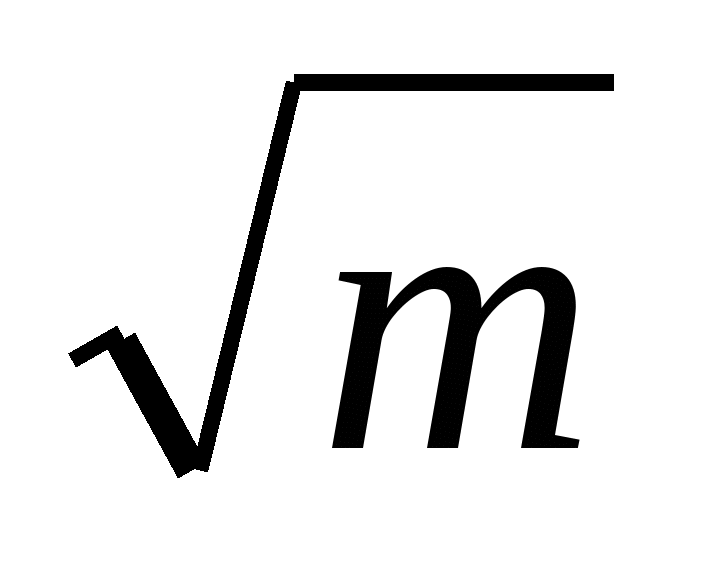 (m – моляльная концентрация) энтальпии растворения монотерпеноидов далее и других терпеноидов экстраполированы в область бесконечного разбавления, которые описываются следующими уравнениями (кДж/моль): (m – моляльная концентрация) энтальпии растворения монотерпеноидов далее и других терпеноидов экстраполированы в область бесконечного разбавления, которые описываются следующими уравнениями (кДж/моль):
Нmраст. C10H16N2O2 = 47,4 – 539,1 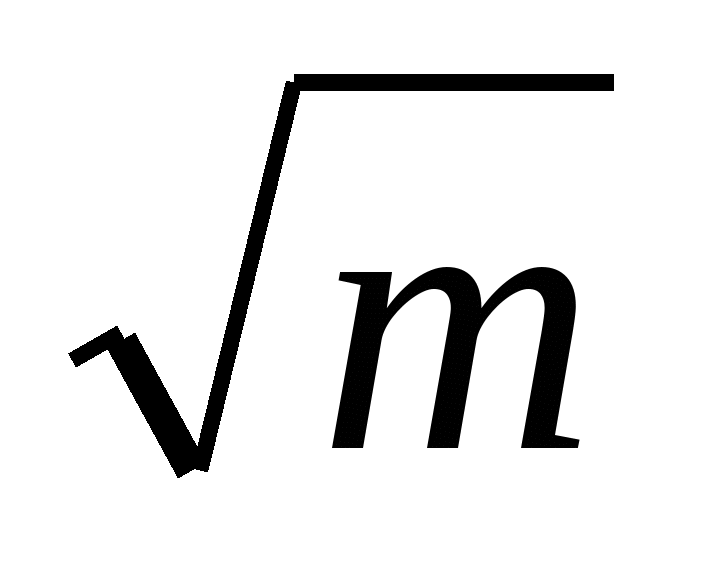 , (1) , (1)
Нmраст. С9H17NO = 55,8 – 631,6 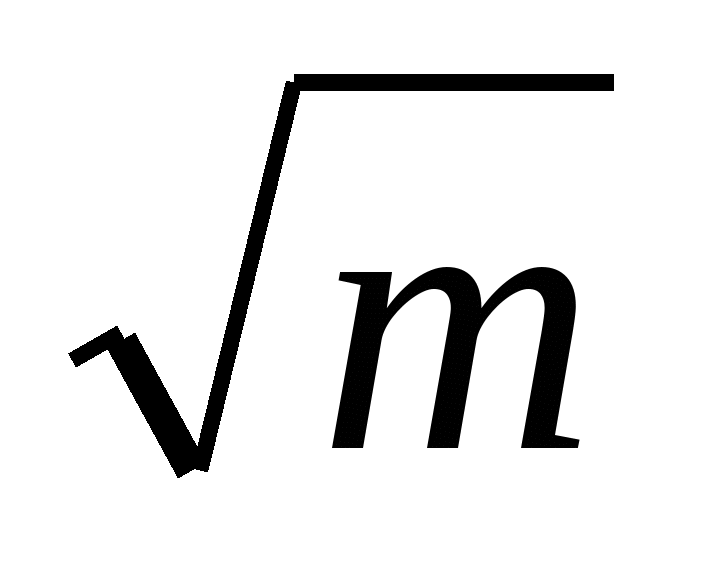 , (2) , (2)
решением которых найдены стандартные энтальпии образования C10H16N2O2 и С9H17NO в стандартном растворе 96 %-ного этанола, равные соответственно 47,40,6 и 55,80,9 кДж/моль.
Далее в таблице 1 приведены зависимости Нmраст.f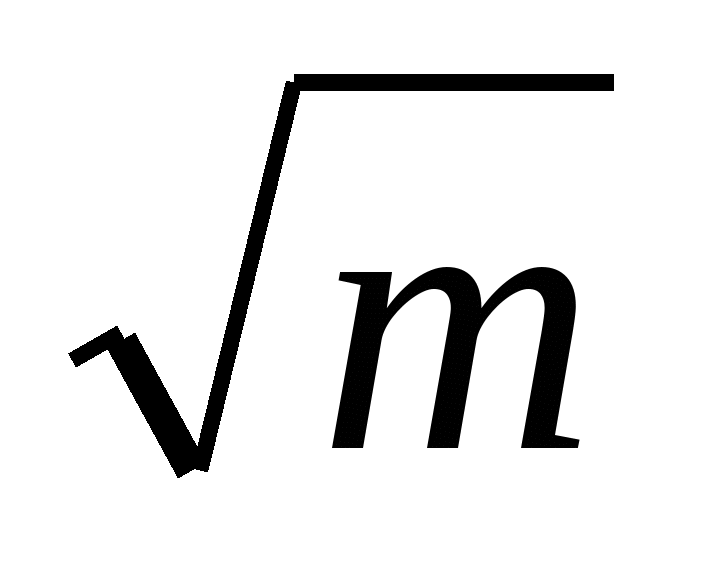 , полученные из калориметрических исследований по определению Н0 растворения в диоксане и 96 %-ном этаноле при различных разбавлениях (моль лактона:моль воды, равных 1:1600, 1:2400 и 1:3200) сесквитерпеновых лактонов с общей формулой С15Н18О3 арглабина (I), ахиллина (II), эстафиатина (III), леукомизина (IV), -сантонина (V) и сесквитерпенового лактона артемизинина С15Н22О5 (VI), которые выделены из соответствующих растений на уровне квалификации «ч.д.а.» в опытном фармацевтическом цехе и лаборатории химии терпеноидов АО «НПЦ «Фитохимия». , полученные из калориметрических исследований по определению Н0 растворения в диоксане и 96 %-ном этаноле при различных разбавлениях (моль лактона:моль воды, равных 1:1600, 1:2400 и 1:3200) сесквитерпеновых лактонов с общей формулой С15Н18О3 арглабина (I), ахиллина (II), эстафиатина (III), леукомизина (IV), -сантонина (V) и сесквитерпенового лактона артемизинина С15Н22О5 (VI), которые выделены из соответствующих растений на уровне квалификации «ч.д.а.» в опытном фармацевтическом цехе и лаборатории химии терпеноидов АО «НПЦ «Фитохимия».
Таблица 1 – Коэффициенты уравнения Нmраст.=a+b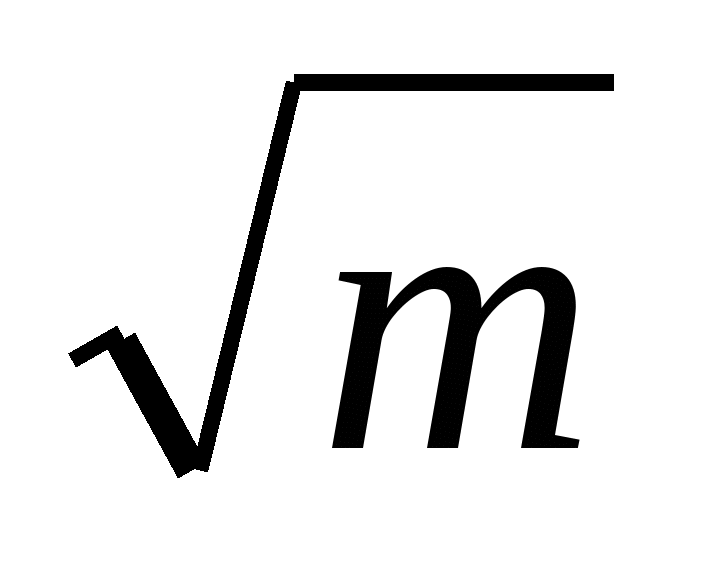 и значения стандартной энтальпии растворения лактонов в диоксане и 96 %-ном этаноле и значения стандартной энтальпии растворения лактонов в диоксане и 96 %-ном этаноле
Лактон
|
в диоксане
|
Н0раст., кДж/моль
|
в 96 %-ном этаноле
|
Н0раст., кДж/моль
|
a
|
b
|
a
|
b
|
I
|
16,6
|
460,2
|
16,60,3
|
22,7
|
382,7
|
22,70,5
|
II
|
24,8
|
-740,4
|
24,80,4
|
27,8
|
46,7
|
27,80,8
|
III
|
22,0
|
-1429,1
|
22,00,3
|
21,8
|
136,0
|
21,80,3
|
IV
|
36,3
|
-3209,0
|
36,30,6
|
21,7
|
289,3
|
21,70,3
|
V
|
35,1
|
-1575,0
|
35,10,2
|
-
|
-
|
-
|
VI
|
38,3
|
-2839,9
|
38,30,5
|
32,2
|
-1134,7
|
32,20,3
|
Анализ результатов термохимических исследований показывает, что величины тепловых эффектов растворения арглабина, ахиллина в диоксане, а также Н0 растворения арглабина, ахиллина, эстафиатина и леукомизина в 96 %-ном этаноле слабо зависит от степени разбавления их растворов. Следует отметить, что наблюдаемые числовые значения тепловых эффектов растворения и их характер растворения от степени разбавления подтверждает их структурные особенности. Например, Н0 растворения арглабина в диоксане от степени разбавления монотонно уменьшается, у ахиллина сначала падает, затем увеличивается у эстафиатина, леукомизина и -сантонина также монотонно увеличивается.
Характер растворения лактонов в 96 %-ном этаноле противоположен вышеуказанному. В данном случае величины Н0 растворения арглабина, ахиллина, эстафиатина, леукомизина с увеличением степени разбавления раствора незначительно, но монотонно падает.
Сесквитерпеновые лактоны с общей формулой С15Н18О3, но с разной структурой по величине энтальпии растворения в диоксане располагаются в следующий ряд: Н0раст.леукомизин > Н0раст.-сантонин > Н0раст.ахиллин > Н0раст.эстафиатин > Н0 раст.арглабин, а в 96 %-ном этаноле – Н0раст.ахиллин>Н0раст. арглабин > Н0 раст. эстафиатин > Н0 раст. леукомизин.
Следует отметить, что величины DHmраств. артемизинина в диоксане и 96 %-ном этаноле заметно зависят от степени разбавления раствора в отличие от предыдущих сесквитерпеновых лактонов и они монотонно увеличиваются с повышением степени разбавления.
Далее методом калориметрии исследованы энтальпии растворения в 96 %-ном этаноле, диоксане и воде при различных разбавлениях ряд лактонов и их производных. Приведенные в таблице 2 лактоны выделены из соответствующих растений, а их производные синтезированы в лаборатории химии терпеноидов, в опытном фармацевтическом цехе АО «НПЦ «Фитохимия» и на кафедре химии СКГУ им. М. Козыбаева на уровне «ч.д.а.» и хроматографической чистоты. В таблице 2 приведены окончательные результаты экстраполяции Н0 растворения соединений на бесконечное разбавление.
Результаты калориметрических исследований показывают, что несмотря на одинаковую брутто-формулу аустрицина и гроссмизина их величины Н0 растворения значительно отличаются друг от друга почти на 11,0 кДж/моль, что, вероятно, связано с их структурными особенностями. Положительные величины Н0раст. С17Н25О3NHCl, С18Н28О4NI, С20Н32О4NI, С17Н28О4NI, С18Н28О3NI, С20Н32О3NI показывают, что величины их энергий кристаллических решеток превышают на величину энтальпию растворения сумм энергии гидратации составляющих их ионов.
Полученный водный раствор гидрохлорида диметиламиноарглабина далее использовали для получения нового производного – нитрата диметиламиноарглабина по следующей реакции:
С17Н25О3NHCl (р-р, n Н2О) + AgNO3 (тв.) = С17Н25О3NH+ (р-р, n Н2О) +
+ NO3- (р-р, n Н2О) + AgCl (тв.) – H0 взаимодействия. (3)
Средние значения DHm взаим. при разбавлениях 1:9000, 1:18000 и 1:36000 равны соответственно -34,980,29, 32,310,28 и 29,750,20 кДж/моль. Полнота протекания реакции (3) подтверждена образованием кристаллического AgCl, рентгенограмма которого соответствовала справочным данным. Из фильтрата в вакууме получены кристаллы нитрата диметиламиноарглабина. Образование его подтверждено методом ИК-спектроскопии.
Таблица 2 – Коэффициенты уравнения Нmраст.=a+b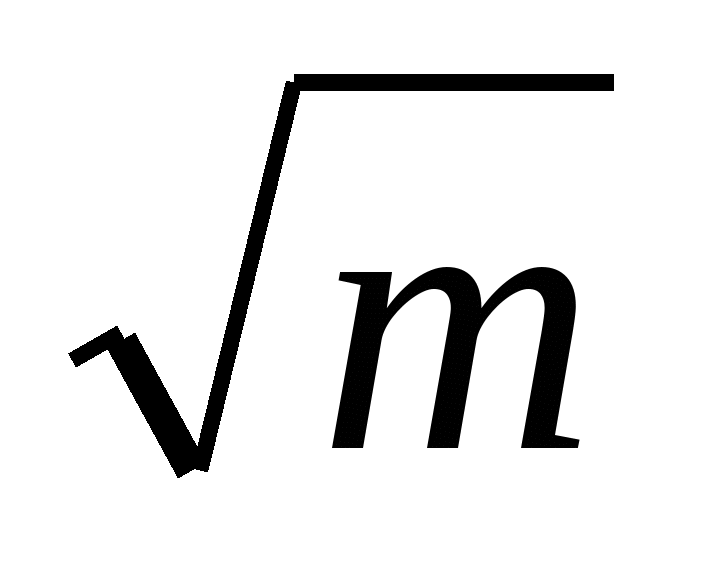 и значения стандартной энтальпии растворения сесквитерпеновых лактонов в различных растворителях и значения стандартной энтальпии растворения сесквитерпеновых лактонов в различных растворителях
|
Соединение
|
Коэффициенты уравнения Нmраст.=a+b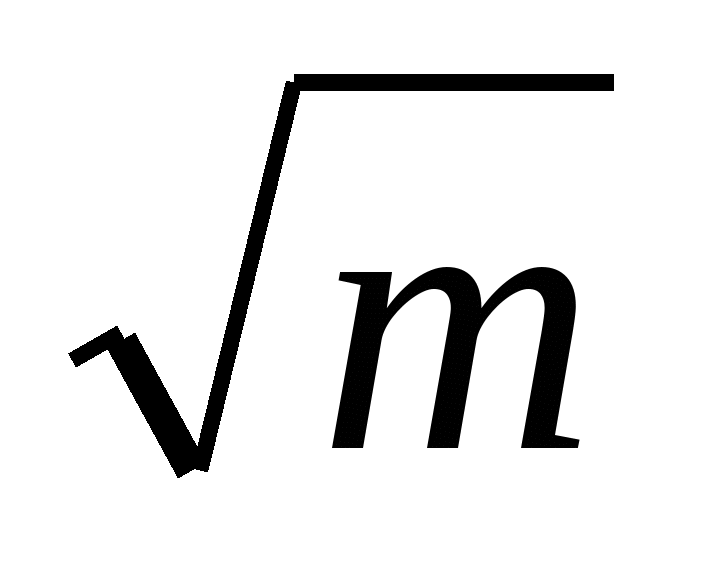
|
DH0раств., кДж/моль
|
a
|
b
|
96 %-ный этанол
|
гидроиодид диметиламиностизолина
|
39,1
|
-445,6
|
39,10,6
|
стизолицин
|
118,5
|
-1745,8
|
118,51,0
|
оксим гроссмизина
|
39,9
|
-417,7
|
39,90,6
|
глицерретовая кислота
|
43,5
|
-10609
|
43,50,5
|
диоксан
|
матрикарин
|
63,1
|
-1034
|
63,10,8
|
9-гидроксиэпибальзамина
|
50,1
|
-772,8
|
50,10,4
|
8-(4-гидроксисенециоат) 9-гидроксиэпибальзамина
|
78,2
|
-1975,2
|
78,21,7
|
аустрицин (дигидрат)
|
55,3
|
-445,4
|
55,30,4
|
гроссмизин (дигидрат)
|
68,4
|
-704,4
|
68,40,9
|
бетулин
|
109,0
|
-1659,7
|
109,01,4
|
вода
|
гидрохлорид диметиламиноарглабина
|
7,16
|
2163,5
|
7,160,34
|
метилиодид диметиламиногроссгемина
|
44,1
|
-218,4
|
44,10,6
|
метилиодид диэтиламиногроссгемина
|
23,8
|
-198,8
|
23,80,3
|
гидроиодид диметиламиностизолина
|
125,5
|
-2325,5
|
125,50,9
|
метилиодид диметиламиноарглабина
|
86,8
|
-2206,0
|
86,81,2
|
метилиодид диэтиламиноарглабина
|
87,4
|
-2042,2
|
87,41,6
|
Величина DHmраств. С17Н25О3NНNO3 в воде при разбавлениях 1:9000, 1:18000 и 1:36000 равны соответственно 34,980,29, 32,310,28 и 29,750,20 кДж/моль. Уравнение зависимости DHmраств.f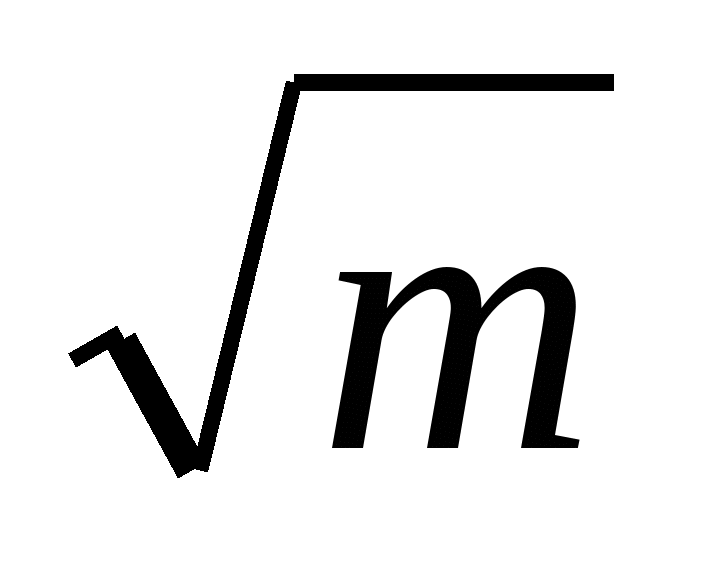 имеет следующий вид (кДж/моль): имеет следующий вид (кДж/моль):
Hmраст. = 34,42 – 838,5 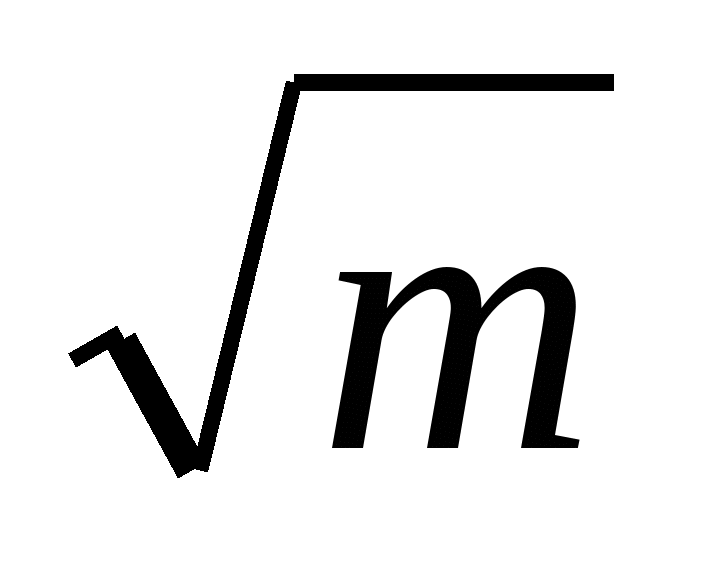 , (4) , (4)
из которого вычислена стандартная энтальпия растворения С17Н25О3NНNO3, равная 34,420,39 кДж/моль.
3 Калориметрия растворения ряда алкалоидов и их производных
3.1-3.3 Термохимия растворения гидрохлорида анабазина и гидробромида лаппаконитина в воде и взаимодействия их водных растворов с нитратом серебра. Термохимия растворения нитрата анабазина в воде и рентгенографическое исследование гидробромида лаппаконитина
Алкалоиды – гидрохлорид анабазина и гидробромид лаппаконитина получены из АО «Химфарм» (г. Шымкент) на уровне квалификации «ч.д.а.».
В связи с отсутствием в литературе рентгенографических данных С32Н44N2O8HBr на установке ДРОН-2,0 провели его рентгенофазовый анализ и выявлено, что С32Н44N2О8HBr кристаллизуется в тетрагональной сингонии со следующими параметрами решетки: а = 12,26 Å; с = 10,72 Å; V° = 1611,3 Å3; Z =2, rрентг.=1,41 г/см 3; rпикн.=1,38 ± 0,04 г/см3.
Аналогично исследованиям, приведенным в разделе 2, определены энтальпии растворения гидрохлорида анабазина С10Н14N2HCl и гидробромида лаппаконитина C32H44N2O8HBr в воде и взаимодействия их водных растворов с кристаллическим нитратом серебра при разбавлениях, равных соответственно 1:6000, 1:9000, 1:18000 и 1:36000, 1:44000, 1:50000.
На основании зависимости DНmраст.=a+b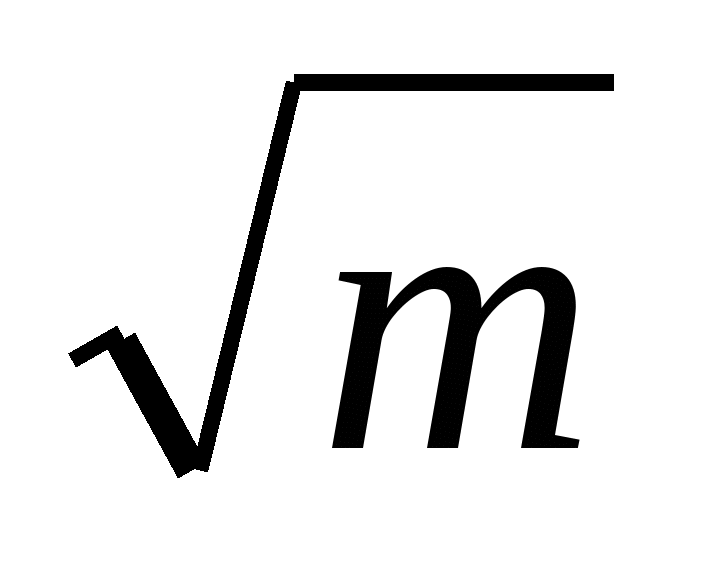 энтальпии растворения С10Н14N2HCl и C32H44N2O8HBr экстраполировали в область бесконечного разбавления. Установлено, что данная корреляция описывается соотноше-ниями: энтальпии растворения С10Н14N2HCl и C32H44N2O8HBr экстраполировали в область бесконечного разбавления. Установлено, что данная корреляция описывается соотноше-ниями:
DHm раст. С10Н14N2HCl = 5,29 – 469,59 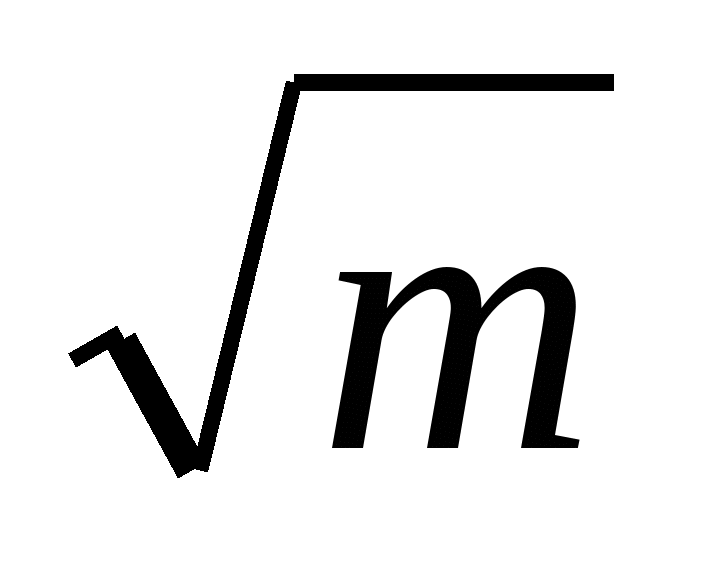 , кДж/моль, (5) , кДж/моль, (5)
DHm раст. С32Н44N2О8HВr = 6,24 – 1403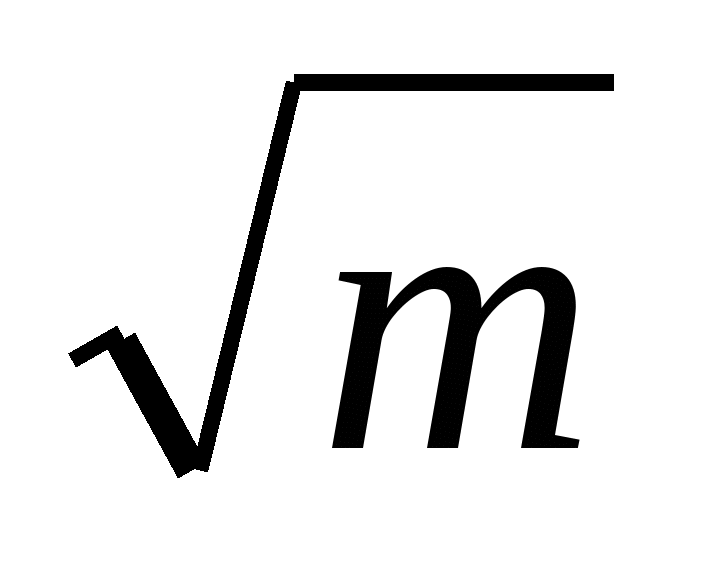 , кДж/моль, (6) , кДж/моль, (6)
из которых вычислены стандартные энтальпии растворения С10Н14N2HCl и C32H44N2O8HBr при бесконечном разбавлении, равные соответственно 5,29±0,10 и 6,24 ± 0,17 кДж/моль.
Полноту прохождения реакций взаимодействия алкалоидов с AgNO3 контролировали методами рентгенофазового анализа (образование кристаллических AgCl и AgBr ) и ИК-, ПМР-спектроскопии (образование новых соединений – нитратов анабазина и лаппаконитина).
Термохимическое определение энтальпии растворения полученного нитрата анабазина в воде проводили при разбавлениях 1:6000; 1:9000; 1:18000. Экстраполированная зависимость DHmраств.f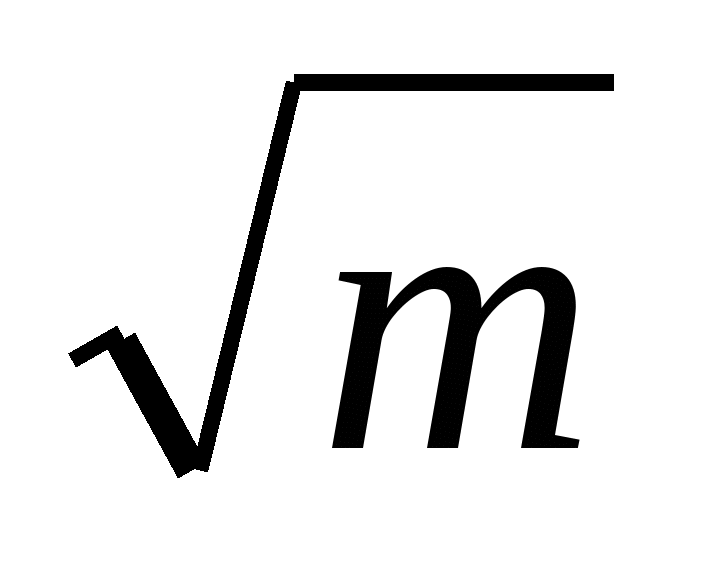 описывается соотношением (кДж/моль): описывается соотношением (кДж/моль):
DHm раст (C10H14N2НNO3) = 20,37 + 390,74 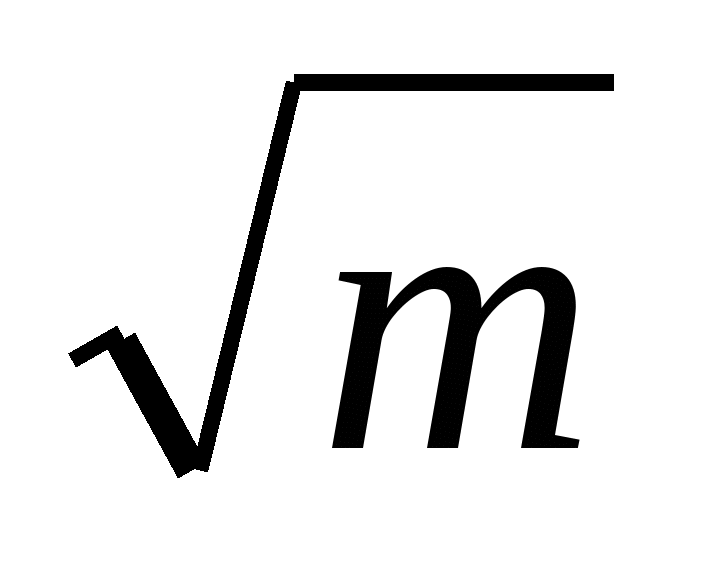 . (7) . (7)
Из выражения (7) определена энтальпия растворения С10Н14N2HNO3 в бесконечно разбавленном (стандартном) водном растворе, равная 20,37±0,07 кДж/моль.
3.4-3.8 Термохимия растворения цитизина и его производных, морфолинодитиокарбамата калия, сальсолинодитиокарбамата сальсолина, гидрохлорида N-оксида и комплекса гармина с хлорангидридом п-толуолсульфокислоты, комплекса стахидрина с хлорангидридом п-толуолсульфокислоты в воде и 96 %-ном этаноле
Методом изотермической калориметрии исследованы энтальпии растворения в воде и 96 %-ном этаноле алкалоида цитизина С11Н14N2О (I), выделенного в лаборатории химии фенольных и стероидных соединений АО «НПЦ «Фитохимия» на уровне квалификации «ч.д.а.» и его производных, синтезированных на уровне марки «х.ч.» в Институте органического синтеза и углехимии (г. Караганда). Этими производными являются О,О-диметил-N-цитизинилфосфат C13H19N2O4P (II), цитизиновинилоксиэтиламинотиомочевины C16H21N3O2S (III), цитизинодитио-карбамат триэтиламмония С18Н29N3ОS2 (IV), цитизинодитиокарбамат натрия С12Н13N2ОS2Na (V) и цитизинодитиокарбамат калия С12Н13N2ОS2K (VI).
В таблице 3 приведены результаты экстраполяции термохимических исследований.
Таблица 3 – Коэффициенты уравнения Нmраст.=a+b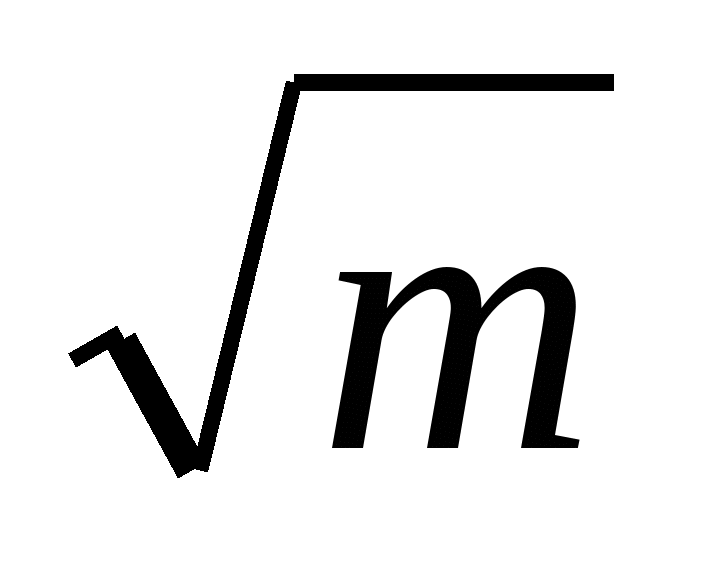 и DH0раств., кДж/моль и DH0раств., кДж/моль
Соединение
|
a
|
b
|
DH0раств., кДж/моль
| |
I
|
96 %-ный этанол
|
36,13
|
-311,83
|
36,130,47
|
II
|
-8,58
|
377,89
|
-8,580,14
|
III
|
11,51
|
461,88
|
11,510,18
| |
I
|
вода
|
-6,65
|
-99,48
|
-0,650,01
|
IV
|
23,90
|
-198,22
|
23,900,27
|
V
|
24,76
|
-116,26
|
24,760,41
|
VI
|
22,87
|
-129,30
|
22,870,30
|
Аналогично вышеуказанным соединениям, на калориметре ДАК-I-IA при 25 ºС исследованы энтальпии растворения в воде и в 96 %-ном этаноле при различных разбавлениях: БАСморфолинодитиокарбамата калия С5Н8NOS2К (I), сальсолинодитиокарбамата сальсолина С23Н30N2O4S2 (II), которые получены на уровне квалификации «х.ч.» в ИОСУ (г. Караганда), производные гармина: гидрохлорид N-оксида С13Н13N2O2Cl (III) и комплекс гармина с хлорангидридом п-толуолсульфокислоты С20Н19N2O3SCl (IV), комплекс стахидрина с хлорангидридом п-толуолсульфокислоты С14Н20O4NSCl (V), выделенные и синтезированные в АО «НПЦ «Фитохимия» на уровне хроматографической чистоты. В таблице 4 приведены результаты экстраполяции калориметрических исследований.
Таблица 4 – Коэффициенты уравнения Нmраст.=a+b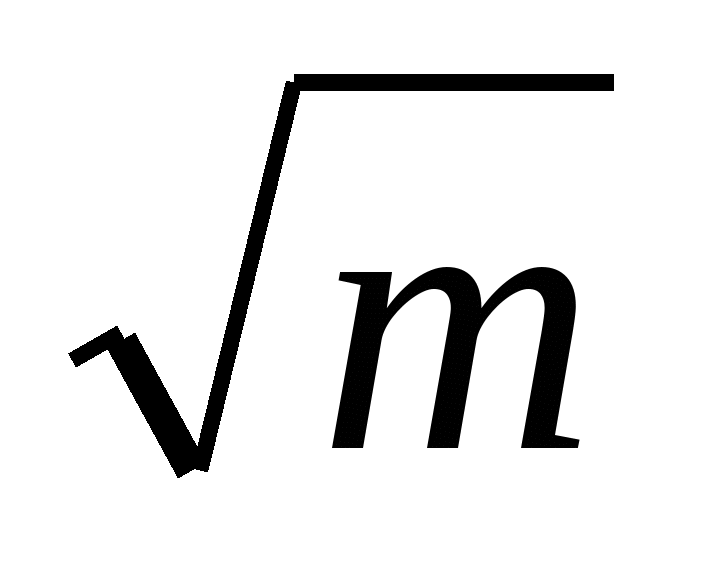 и DH0раств., кДж/моль и DH0раств., кДж/моль
Соединение
|
a
|
b
|
DH0раств., кДж/моль
| |
I
|
вода
|
54,18
|
295,17
|
54,20,4
|
II
|
98,58
|
2918,5
|
98,61,5
| |
III
|
96 %-ный этанол
|
30,67
|
-325,31
|
30,670,53
|
IV
|
4,23
|
191,43
|
4,230,06
|
V
|
5,65
|
226,3
|
5,65±0,09
|
страница 1 страница 2 страница 3 | страница 4 | страница 5
|