страница 1
УДК 542.942.3:547.572:547.362 На правах рукописи
СОБОЛЕВА ЕЛЕНА АНАТОЛЬЕВНА
Физико-химические аспекты восстановления некоторых
ароматических кетонов и третичных ацетиленовых спиртов
в электрокаталитической системе
02.00.04 – Физическая химия
Автореферат
диссертации на соискание ученой степени
кандидата химических наук
Республика Казахстан
Караганда, 2008
Работа выполнена в лаборатории электрокатализа и квантово-химических исследований ТОО «Институт органического синтеза и углехимии Республики Казахстан»
Научные руководители: доктор химических наук,
профессор Кирилюс И.В.
доктор химических наук
Иванова Н.М.
Официальные оппоненты: доктор химических наук
Иргибаева И.С.
кандидат химических наук
Едильбаева Т.Т.
Ведущая организация: Казахский национальный университет им. аль-Фараби
Защита диссертации состоится 12 апреля 2008 года в 1100 часов на заседании диссертационного совета ОД 14.07.01 при Карагандинском государственном университете имени Е.А. Букетова по адресу: 100028, г. Караганда, ул. Университетская, 28, химический факультет, актовый зал.
С диссертацией можно ознакомиться в библиотеке Карагандинского государственного университета имени Е.А. Букетова.
Автореферат разослан « » марта 2008 года.
Ученый секретарь
диссертационного совета ОД 14.07.01,
доктор химических наук, профессор Ш.К. Амерханова
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. Электрокаталитический (ЭК) способ восстановления органических соединений на электродах, активированных дисперсным слоем ферромагнитного катализатора, разработанный в Институте органического синтеза и углехимии, включает достоинства электрохимических и каталитических методов гидрирования и имеет свои преимущества. К главным преимуществам можно отнести селективность восстановления на катализаторах различной химической природы, чистоту получаемого продукта, а также его экологическую безопасность, что для современных химических производств является особенно актуальным.
В данной диссертационной работе ЭК метод восстановления применен для получения ароматических спиртов, имеющих важное практическое значение как душистые вещества, обладающие приятным запахом и применяемые в качестве ароматизаторов в парфюмерной и пищевой промышленностях, и как реагенты в синтезах разнообразных химических соединений, используемых, в том числе, для получения лекарственных средств.
Несмотря на большой спектр органических соединений с ненасыщенными связями, исследованных к настоящему времени в ЭК системе, восстановление ароматических кетонов (ацетофенона, его п-замещенных производных и бензофенона) и фенилацетиленовых спиртов проведено в этой системе впервые.
В теоретическом отношении недостаточное использование математических методов кинетического анализа для ЭК реакций гидрирования восполнено применением общей кинетической модели для топохимических реакций – уравнения Колмогорова-Ерофеева. Кинетические характеристики исследованных процессов определены также на основе обобщенного многофакторного уравнения, полученного в результате применения вероятностно-детермини-рованного метода планирования эксперимента.
Степень разработанности проблемы. В научной литературе широко освещены каталитические, электрохимические и химические методы восстановления ацетофенона, его производных и подобных по строению других ароматических кетонов, а также ацетиленовых спиртов различного строения. Однако, наиболее часто в описанных экспериментах получается не один, а несколько продуктов восстановления и конденсации. В ЭК системе, как показали выполненные исследования, образуются только соответствующие ароматические спирты. Процессы восстановления фенилацетиленовых спиртов, рассмотренных в данной работе, являются малоизученными.
Цель и основные задачи исследования. Целью настоящей диссертационной работы является изучение процессов восстановления ацетофенона и его п-замещенных производных п-R1−C6H4−CO−СН3 (R1 = CH3, OCH3, NH2 и Br), бензофенона C6H5−CO−C6H5 и фенилацетиленовых спиртов С6H5−C≡C−CR1R2OH (R1= R2= H; R1= R2= CH3; R1= CH3, R2= C2H5) в ЭК системе на катоде, активированном d- и s-металлами-катализаторами.
В связи с указанной целью были определены следующие задачи:
1. Подбор эффективных катализаторов гидрогенизации и изучение влияния различных факторов (плотности тока, температуры реакционной среды, количества катализатора, природы и количества органического растворителя, концентрации щелочи) на ЭК процессы восстановления ароматических кетонов и фенилацетиленовых спиртов.
2. Применение уравнения Колмогорова-Ерофеева для описания реакций ЭК гидрирования изучаемых соединений.
3. Применение вероятностно-детерминированного метода планирования эксперимента и проведение на его основе кинетического анализа изучаемых процессов.
4. Исследование возможности селективного восстановления фенилацетиленовых спиртов до винилкарбинолов.
5. Разделение цис-и транс-изомеров коричного спирта – промежуточного продукта ЭК гидрирования фенилпропаргилового спирта.
6. Оптимизация процесса электрокаталитического гидрирования ацетофенона на укрупненной лабораторной установке.
Научная новизна работы обусловлена тем, что впервые:
– изучены процессы восстановления ацетофенона и его производных, бензофенона и третичных фенилацетиленовых спиртов в ЭК системе;
– применено известное уравнение для гетерогенных реакций (уравнение Колмогорова-Ерофеева) для описания процессов ЭК восстановления;
- на основе полученных многофакторных обобщающих уравнений проведен кинетический анализ ЭК гидрирования исследуемых ароматических кетонов;
– методами квантовой химии изучено влияние природы п-заместителей на реакционную способность карбонильной группы рассмотренных ацетофенонов;
– проведена оптимизация процесса ЭК восстановления ацетофенона на укрупненной лабораторной установке.
Научно-практическая значимость работы. Выполненные исследования по подбору эффективных катализаторов гидрогенизации, по влиянию различных факторов на ЭК восстановление изучаемых ароматических кетонов и третичных фенилацетиленовых спиртов, проведенный кинетический анализ этих процессов и оптимизация ЭК гидрирования на укрупненно-лабораторной установке являются научной базой для разработки новых технологий получения ряда ароматических спиртов, имеющих значительный практический интерес не только как душистые вещества, но и как исходные реагенты в синтезах многих практически важных химических соединений. Используемые в работе математические методы кинетического анализа, а также построение номограмм могут быть рекомендованы для надёжного способа описания других электрокаталитических процессов.
Основные положения, выносимые на защиту:
1. Результаты исследований по влиянию различных факторов (плотности тока, температуры реакционной среды, природы и количества катализатора и растворителя, концентрации щелочи) на ЭК гидрирование ацетофенона и его п-замещенных производных, бензофенона и фенилацетиленовых спиртов.
2. Результаты кинетических исследований по применению математической модели Колмогорова-Ерофеева к процессам ЭК восстановления изучаемых веществ.
3. Оптимальные условия ЭК восстановления бензофенона, определенные с помощью метода вероятностно-детерминированного планирования эксперимента.
4. Методика синтеза виниловых и предельных спиртов путем избирательного восстановления фенилацетиленовых спиртов в ЭК системе на катоде, активированном скелетным цинком, и разделение цис- и транс-изомеров коричного спирта.
5. Результаты квантово-химических расчетов электронного строения молекул гидрируемых веществ и продуктов их восстановления.
6. Оптимальная модель ЭК восстановления ацетофенона на укрупненной лабораторной установке, полученная с помощью метода вероятностно-детерми-нированного планирования эксперимента.
Личный вклад автора заключается в самостоятельном выполнении экспериментальных исследований, их математической обработке с помощью компьютерных программ, проведении квантово-химических расчетов, анализе и обобщении полученных результатов.
Апробация работы. Материалы диссертационной работы представлены и обсуждены на II Международной научно-практической конференции «Теоретическая и экспериментальная химия» (Караганда, 2004 г.), на 7-й Научной школе-конференции по органической химии (Екатеринбург, 2004 г.), на 8-й Научной школе-конференции по органической химии (Казань, 2005 г.), на Международной научно-практической конференции "Академик Е.А. Букетов – ученый, педагог, мыслитель", посвященной 80-летию Е.А. Букетова (Караганда, 2005 г.), на ІІІ Международной научно-практической конференции "Теоретическая и экспериментальная химия" (Караганда, 2006 г.), на XVI Всероссийском совещании по электрохимии органических соединений «ЭХОС-2006» (Новочеркасск, 2006 г.).
Связь темы с планом государственных научных программ. Диссертационная работа выполнена в рамках научных исследований, проводимых лабораторией электрокатализа и квантово-химических исследований ТОО «ИОСУ РК» по темам: «Исследование закономерностей и выдача рекомендаций превращения продуктов на основе ацетилена в жидкокристаллические соединения, моторные масла, пищевые жиры, душистые вещества и высокоактивные сажи» (гос. регистрационный номер 0100РК00196) за 2000-2002 гг. и «Разработка научных основ наукоемких технологий химической и термохимической переработки углей Центрального Казахстана с целью получения импортозамещающих и новых материалов» (гос. регистрационный номер 0104РК00298) за 2003-2005 гг.
Публикации. По результатам проведенных исследований опубликовано 16 печатных работ, в том числе 1 монография (в соавторстве), 3 статьи в журналах, входящих в список рекомендованных ККСОН МОН РК, тезисы 11 научных докладов, из них 7 – на международных конференциях; получен 1 предварительный патент РК.
Объем и структура диссертации. Диссертация состоит из введения, основной части, включающей четыре главы, заключения, списка использованных источников, состоящего из 223 наименований. Работа изложена на 136 страницах, содержит 41 таблицы и 39 рисунков.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
Во введении раскрыта актуальность проведенных в диссертационной работе исследований, отражена их научная новизна и практическая значимость, сформулированы цель и задачи ее достижения, основные положения, выносимые на защиту.
1 Метод электрокаталитического восстановления органических
соединений и методика проведения экспериментов
В данной главе рассмотрены общие положения электрокатализа. Приведены общая методика проведения ЭК гидрирования исследуемых соединений, описание ЭК ячейки, методики синтезов исходных веществ, их физико-химические характеристики и методики приготовления катализаторов.
2 Электрокаталитическое восстановление ацетофенона и его п-замещенных производных
В подразделе 2.1 приведен обзор литературных данных по каталитическим, химическим и электрохимическим методам восстановления ароматических кетонов, описаны возможные направления восстановления ацетофенона и его производных. Раскрыты некоторые преимущества ЭК метода над другими способами восстановления органических соединений и, в частности, ароматических кетонов.
В подразделе 2.2 представлены результаты исследований по влиянию природы и количества органических растворителей (метанола, этанола, пропанола, изо-пропанола, бутанола, диоксана, диметилформамида и диметилсульфоксида), а также химической природы катализаторов (электролитических порошков и скелетных катализаторов) на процесс ЭК гидрирования ацетофенона (1) в лабораторной диафрагменной ячейке. Эксперименты выполнены при плотности тока 2 кА/м2 (поверхность катода 5·10-4 м2) и температуре 303 К, на никеле Ренея (0,001 кг), с исходной концентрацией ацетофенона 0,074 моль/л.
Согласно результатам выполненных исследований, наиболее эффективными органическими растворителями, добавление которых в водно-щелочной раствор католита улучшает растворимость вещества 1, скорость гидрирования и степень его превращения, являются этиловый и изо-пропиловый спирты. Оптимальное количество этилового спирта, при котором поглощение водорода достигает 100 %, составляет 20 мл, а соотношение спирт/водно-щелочной раствор католита – 1:2. Католит такого состава был использован при проведении электрокаталитического гидрирования вещества 1 на различных катализаторах (таблица 1). Скорость гидрирования, выход вещества по току и коэффициент использования водорода вычислены по экспериментальным данным за период 50 %-го поглощения водорода.
Таблица 1 – Результаты ЭК гидрирования ацетофенона на различных катализаторах
Катализаторы
|
W, мл Н2/мин
|
Поглощение Н2, %
|
Выход по току, %
|
η, %
|
Cu
|
5,0
|
100
|
48,4
|
66,7
|
Fe
|
4,7
|
100
|
31,7
|
60,3
|
Ni
|
4,9
|
100
|
31,6
|
67,0
|
Co
|
4,4
|
100
|
28,1
|
61,0
|
Zn
|
3,6
|
70,2
|
21,9
|
55,3
|
Cuэлектрол.
|
5,8
|
100
|
49,5
|
87,0
|
Znэлектрол.
|
4,2
|
69,6
|
38,2
|
61,0
|
без катализатора
|
2,1
|
71,8
|
9,1
|
61,0
|
Выполненные эксперименты показали, что в исследуемых системах поглощение водорода достигает 100 % (кроме Zn катализаторов), а скорость гидрирования 1 уменьшается в следующем ряду скелетных катализаторов: Cu>Ni>Fe>Со>Zn. При использовании электролитического порошка Cu гидрирование 1 идет более интенсивно, чем на скелетных катализаторах, что обусловлено более развитой его поверхностью.
Электрохимическое восстановление 1 (в тех же условиях, но без катализатора), согласно данным таблицы 1, проходит с заметно меньшей средней скоростью (2,1 мл Н2/мин), и поглощение водорода не превышает 71,8 %.
Анализ полученных продуктов методом газо-жидкостной хроматографии показал, что при гидрировании 1 на всех исследуемых катализаторах, кроме цинковых, образуется один продукт – метилфенилкарбинол, известное и широко применяемое в парфюмерии душистое вещество. Электрохимическое, а также ЭК восстановление 1 с использованием скелетного и электролитического порошка Zn является не полным, поэтому после гидрирования в катализате содержатся исходный непрореагировавший ацетофенон и продукт метилфенилкарбинол.
Подраздел 2.3 посвящен изучению влияния природы п-заместителей на реакционную способность карбонильной группы и кинетику процессов ЭК восстановления ацетофенона и его п-замещенных производных: п-метилацетофенона (2), п-метоксиацетофенона (3), п-аминоацетофенона (4) и п-бромацетофенона (5). Эксперименты проводили в тех же условиях, что и для ацетофенона 1 с варьированием исходной концентрации исследуемых веществ (Со) от 0,074 до 0,298 моль/л. Полученные экспериментальные данные по ЭК гидрированию ацетофенонов 1-5 были оформлены в виде зависимостей степени превращения исходных веществ от продолжительности процесса t. Построеные зависимости были обработаны по уравнению общего вида для топохимических реакций – уравнению А.Н. Колмогорова – Б.В. Ерофеева:
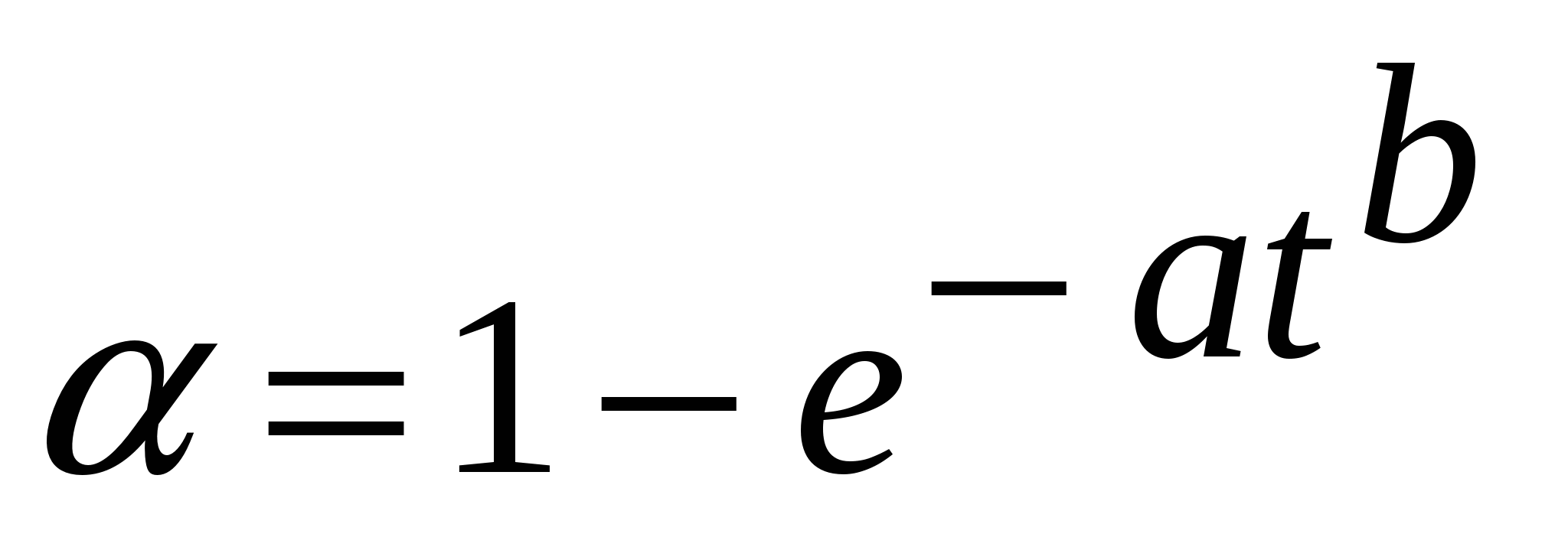 . (1) . (1)
Математической обработкой экспериментальных зависимостей были получены коэффициенты a и b, подстановка которых в уравнение (1) позволяет получить теоретические модели изучаемых процессов. На рисунке 1 изображены полученные кривые для ЭК гидрирования ацетофенонов 1 – 5 Со = 0,298 моль/л. Аналогичный вид имеют зависимости от t для исследуемых веществ с другими исходными концентрациями в католите. Рассчитанные коэффициенты корреляции R и их значимость tR подтверждают хорошую применимость этого уравнения для ЭК реакций.
Дифференцируя уравнение (1) по времени, получаем выражение для скорости рассматриваемых реакций:
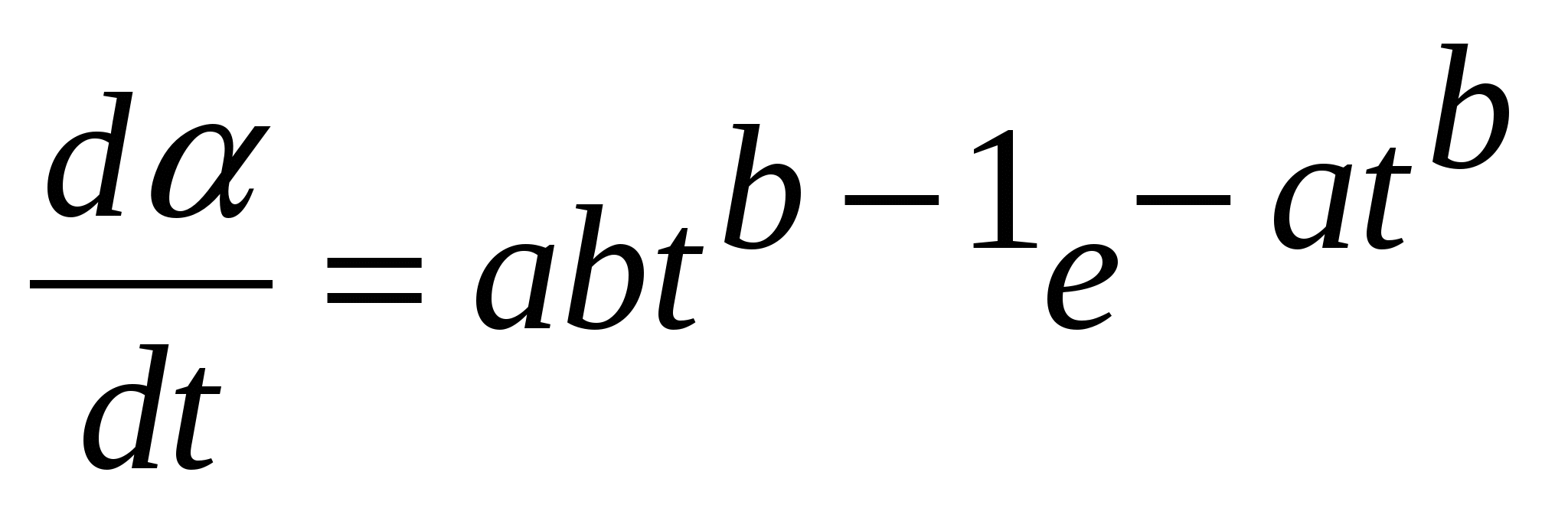 . (2) . (2)
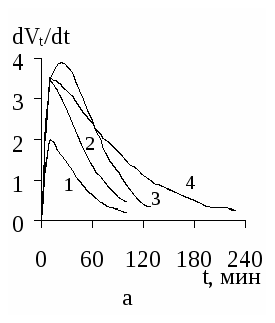
На рисунке 2 изображены кинетические кривые в координатах dVt/dt – t, построенные по уравнению (2) с учетом обозначения степени превращения, для ацетофенонов 1 – 5 с различными исходными концентрациями.
На основе анализа экспериментальных данных, кинетических зависимостей от t, а также рассчитанных значений среднеинтегральных и максимальных скоростей гидрирования ацетофенонов 1 – 5 составлен следующий ряд по уменьшению реакционной способности этих веществ в процессах ЭК гидрирования: NH2 > H > CH3O > CH3 > Br. Аналогичный ряд получается и по усредненным константам скоростей для этих процессов, рассчитанным по уравнению для скорости бимолекулярной реакции, полагая С[H2]= const.
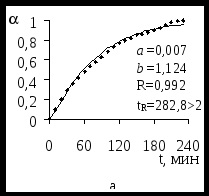 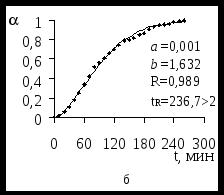 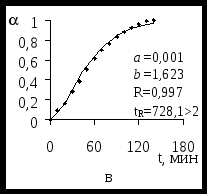 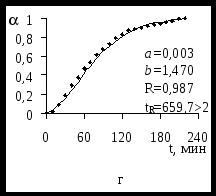 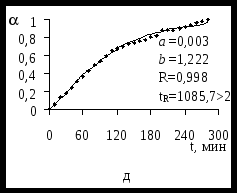
Рисунок 1 – Зависимости степени превращения веществ 1 (а), 2 (б), 3 (в), 4 (г), 5 (д)
Со=0,298 моль/л от продолжительности их ЭК гидрирования.
 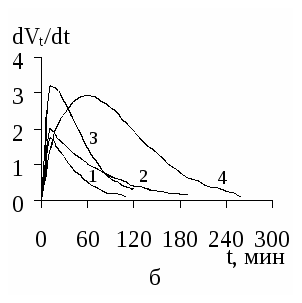 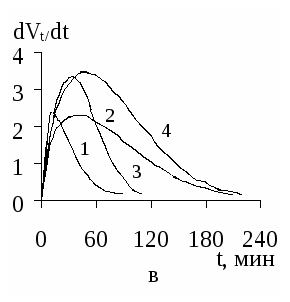
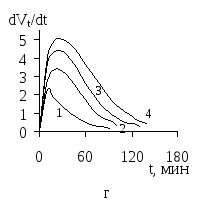 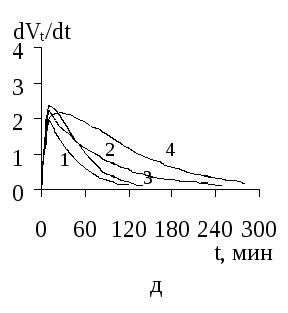
1 – 0,074; 2 – 0,149; 3 – 0,223; 4 – 0,298 моль/л.
Рисунок 2 – Кинетические зависимости для ЭК гидрирования ацетофенонов 1-5 (а-д)
Для определения энергии активации были проведены эксперименты по ЭК гидрированию ацетофенонов 1 и 4 при изменении температуры реакционной среды от 293 до 323 К. Согласно данным, приведенным в таблице 2, температурный фактор оказывает заметное влияние на кинетику гидрирования ацетофенонов 1, 4, и с повышением температуры скорость гидрирования возрастает.
Значения скоростей при одной и той же степени реагирования ( = 0,5) были вычислены на основе уравнения Колмогорова-Ерофеева, затем построены зависимости ln(dα/dt) от обратной температуры и по уравнению Аррениуса определены энергии активации. Вычисленные значения эффективной энергии активации 26,0 и 14,27 кДж/моль, соответственно для процессов ЭК гидрирования 1 и 4, действительно, получились в ожидаемом соотношении: для п-аминоацетофенона почти в два раза ниже, чем для незамещенного ацетофенона и они относятся к области лимитирования исследуемых процессов внутренней диффузией.
Таблица 2 – Значения коэффициентов а и b, коэффициентов корреляции R и их значимости tR
Вещество
|
Т, К
|
dα/dt, мин-1 при α =0,5
|
a
|
b
|
R
|
tR
|
1
|
293
|
0,006
|
0,004
|
1,205
|
0,985
|
176,10>2
|
303
|
0,008
|
0,006
|
1,218
|
0,995
|
566,33>2
|
313
|
0,012
|
0,008
|
1,263
|
0,999
|
2179,89>2
|
323
|
0,016
|
0,006
|
1,387
|
0,999
|
190,74>2
|
4
|
293
|
0,011
|
0,006
|
1,294
|
0,999
|
1786,62>2
|
303
|
0,011
|
0,008
|
1,213
|
0,998
|
956,77>2
|
313
|
0,014
|
0,011
|
1,225
|
0,999
|
1979,14>2
|
323
|
0,018
|
0,009
|
1,340
|
0,999
|
1967,42>2
|
В подразделе 2.4 представлены результаты квантово-химических расчетов молекул ацетофенонов 1 – 5 полуэмпирическим методом MNDO, а также неэмпирическим методом RHF/6-31G** с учетом электронной корреляции по теории возмущений Меллера-Плессета второго порядка (MP2/6-31G**). На основе зарядовых распределений по атомам в молекулах 1 – 5 влияние электронных эффектов заместителей на реакционную способность карбонильной группы выражено двумя последовательностями: NH2 ≥ H > OCH3 > CH3 > Br и NH2 > OCH3 > CH3 @ H > Br. Первая последовательность, полученная на основе полуэмпирических расчетов, совпадает с экспериментальными данными.
С целью приближения к промышленным условиям был изучен процесс восстановления ацетофенона на скелетном никелевом катализаторе на укрупненной установке емкостью 700 мл (подраздел 2.5). Влияние различных факторов (с учетом результатов, полученных в лабораторной ячейке на 60 мл) изучалось методом вероятностно-детерминированного планирования эксперимента, разработанным В.П. Малышевым, в котором для описания статистических многофакторных зависимостей используется обобщенное уравнение М.М. Протодьяконова.
Была составлена матрица проведения экспериментов для четырех факторов, варьируемых по трем уровням (9 опытов), то есть в зависимости от изменения таких факторов, как плотность тока: 10, 20, 30 кA/м2; количество катализатора: 0,005; 0,010; 0,015 кг; исходная концентрация ацетофенона: 0,064; 0,128; 0,191 моль/л; количество растворителя – этилового спирта: 0,05; 0,10; 0,15 л. Функцией отклика при обработке экспериментальных данных была выбрана степень превращения вещества, a.
По частным зависимостям степени превращения ацетофенона от исследуемых факторов, были определены их аппроксимирующие функции, с помощью которых было получено уравнение Протодьяконова, введенное под экспоненту для ограничения степени реагирования, равной единице:
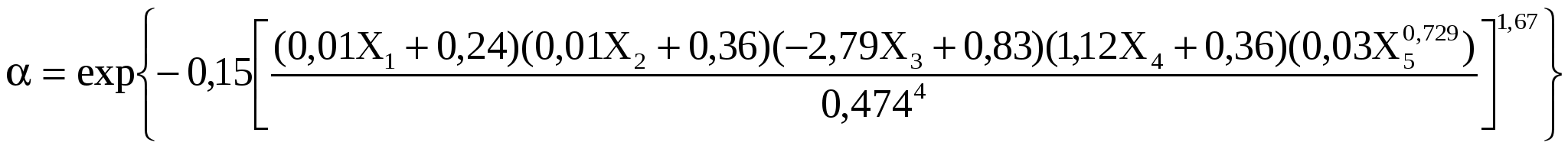 (3) (3)
На основе полученной многофакторной модели (3) была составлена номограмма для реальных пределов изменения факторов и определены максимальные зоны степени превращения ацетофенона, а, следовательно, и оптимальные параметры влияющих на этот процесс факторов. Анализ полученной номограммы позволил выделить области наибольшего выхода метилфенилкарбинола (a = 0,95-0,96).
3 Электрокаталитическое гидрирование бензофенона
В подразделе 3.1 приведен обзор литературных данных по восстановлению бензофенона (6) каталитическими, химическими и электрохимическими методами. Согласно литературным данным, в зависимости от условий проведения экспериментов и природы катализатора возможно восстановление как карбонильной С=О группы, так и двух фенильных колец с образованием различных продуктов, а также образование бензпинакона – продукта реакции гидродимеризации. Исследованиями, выполненными в данной работе, было показано, что в условиях электрокатализа (при невысоких температурах и нормальном давлении) бензофенон восстанавливается только по карбонильной группе с образованием соответствующего спирта – бензгидрола С6Н5−СН(ОН)−С6Н5.
В подразделе 3.2 проведен сравнительный анализ электронного строения бензофенона и ацетофенона. Молекула бензофенона 6, согласно выполненным квантово-химическим расчетам (метод B3LYP/6-31G**), имеет две стабильные конформации – планарную и с выходом фенильных колец из плоскости карбонильной группы приблизительно на 30о, причем неплоская конформация является более стабильной.
Рассчитанные электронные характеристики и более сложное пространственное строение молекулы 6, затрудняющее взаимодействие карбонильной группы с катализатором, предсказывают его меньшую реакционную способность в процессах ЭК гидрирования.
В подразделе 3.3 представлены результаты по ЭК восстановлению бензофенона. Эксперименты, проведенные в оптимальных условиях, подобранных для ацетофенона, показали, что гидрирование 6 в этих условиях проходит менее эффективно, чем ацетофенона: поглощение водорода составило только 18,6 %. Поэтому были проведены исследования по подбору добавляемого в щелочной раствор католита органического растворителя – этилового спирта и концентрации электролита - гидроксида натрия. Было определено, что для получения количественного выхода бензгидрола необходимо в 6 %-ный раствор NaOH добавить этанол в соотношении 1:1 (при общем объеме католита 60 мл).
Определение влияния ряда факторов и изучение химической кинетики процесса восстановления 6 было проведено с использованием метода вероятностно-детерминированного планирования эксперимента на основе четырехфакторной матрицы на пяти уровнях. Так как каждый опыт проводился при многократной регистрации результатов через определенные промежутки времени вплоть до полного прекращения процесса, при обработке экспериментальных данных в качестве дополнительного пятого фактора была учтена продолжительность гидрирования путем введения соответствующих результатов в матрицу планирования эксперимента. Значения активных факторов варьировались в следующих пределах: плотность тока 1-3 кА/м2, количество катализатора (никель Рения) 0,2-1,0 ·10-3 кг, концентрация 6 0,075-0,223 моль/л и температура 293-313 К. Значимые частные зависимости для восстановления бензофенона обобщены многофакторным уравнением с введением его в экспоненту:
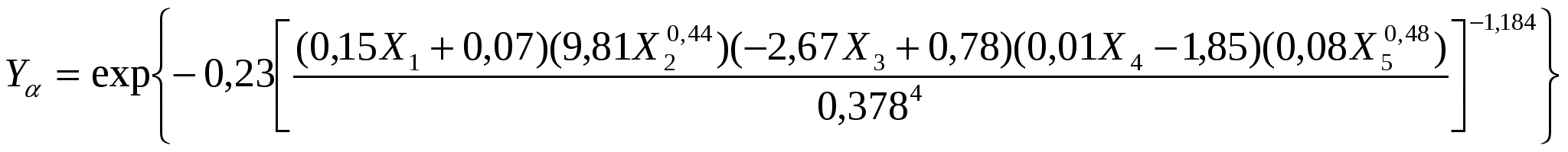 (4) (4)
На основе уравнения (4) была составлена номограмма табличного типа для реальных пределов изменения факторов (при фиксированном расходе катализатора 0,8 ·10-3 кг) и определены оптимальные зоны данного процесса. Так, для рассматриваемого процесса при заданной степени превращения 0,90-0,91 соответствующие значения факторов равны: плотность тока 3 кA/м2, концентрация вещества 0,075 моль/л, температура 303 К, продолжительность процесса 120 минут.
Если в уравнении (4) принять за постоянную величину К сомножители:
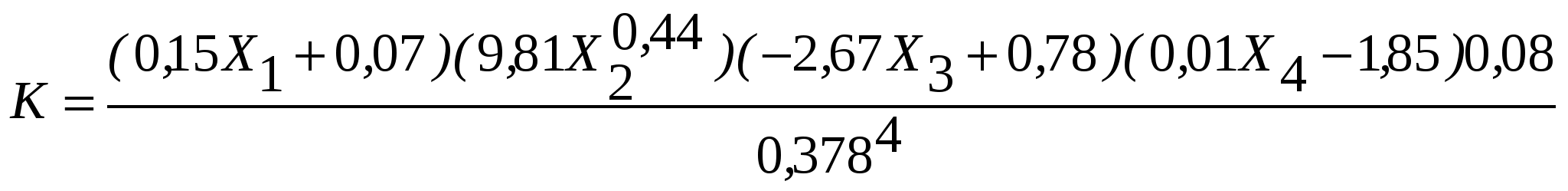 , (5) , (5)
и ввести обозначения для a, b и c, это уравнение примет вид:
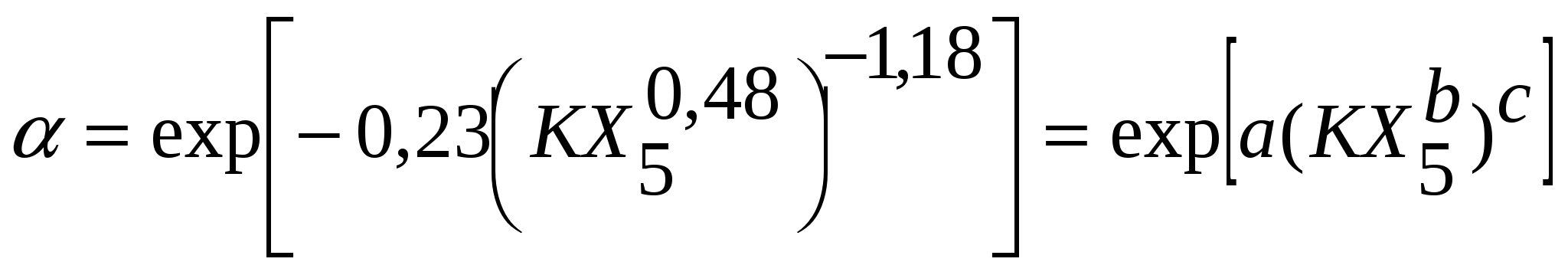 . (6) . (6)
Отсюда скорость процесса будет равна:
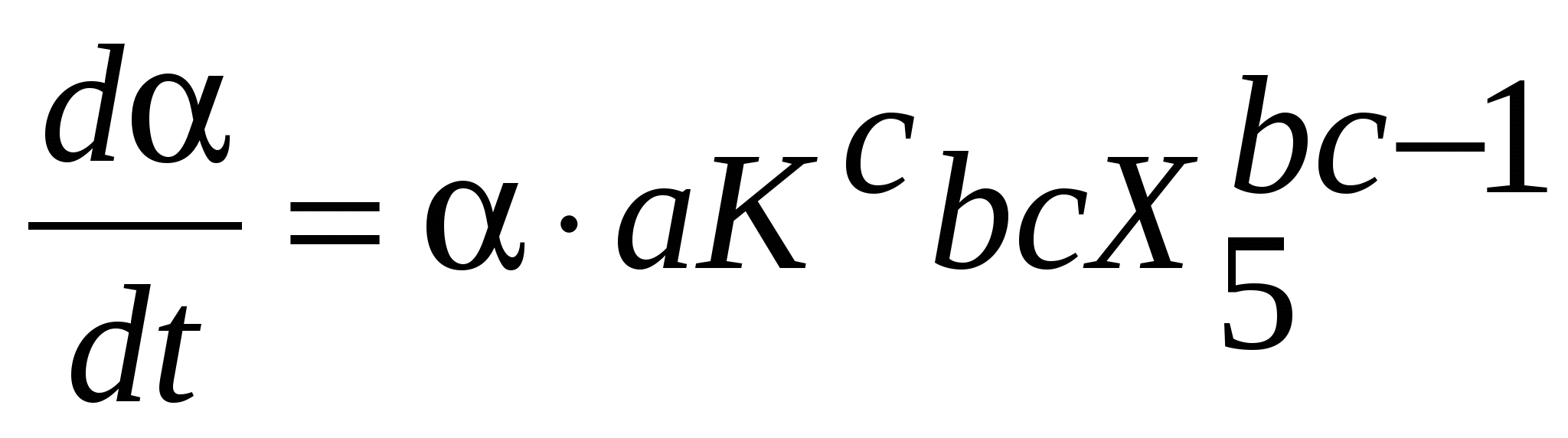 . (7) . (7)
Для определения скорости процесса при постоянной степени реагирования проводим обращение переменных в уравнении (7). После преобразований получаем:
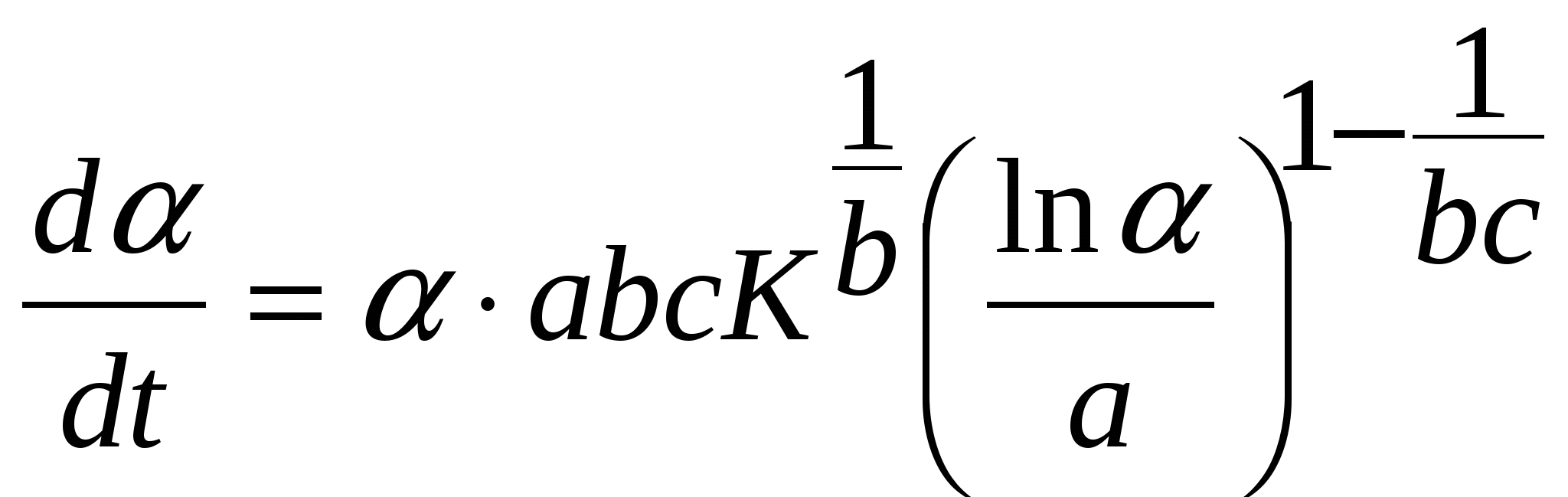 . (8) . (8)
Приведенные в таблице 3 массивы скоростей, вычисленные по уравнению (8), были обработаны в аррениусовых координатах и определены значения эффективных энергий активации. Для рассматриваемого процесса при всех заданных степенях реагирования энергии активации получились одинаковыми и равными 27,78 кДж/моль, что указывает на единство механизма и лимитирующей стадии гидрирования бензофенона в течение всего данного процесса.
Таблица 3 – Значения скоростей гидрирования 6 при различных 
в интервале температур 293-333 К
Т, К
|
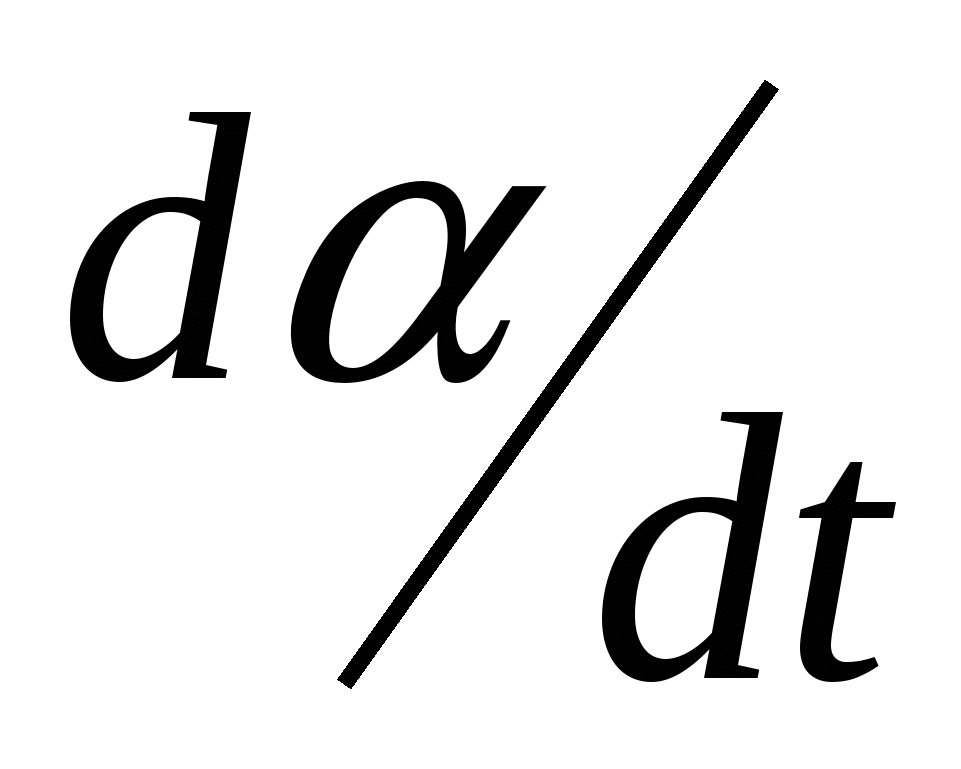 , мин-1 при следующих , мин-1 при следующих 
|
0,1
|
0,5
|
0,9
|
293
303
313
323
333
|
2,7·10-3
4,1·10-3
5,9·10-3
8,0·10-3
11,0·10-3
|
0,5·10-3
0,8·10-3
1,1·10-3
1,5·10-3
1,9·10-3
|
0,5·10-5
0,7·10-5
1,1·10-5
1,4·10-5
1,9·10-5
|
4 Электрокаталитическое гидрирование фенилацетиленовых спиртов
Подраздел 4.1. Приведен литературный обзор по восстановлению ацетиленовых спиртов каталитическими, химическими, электрохимическими и ЭК методами. Выполненный литературный обзор показал, что до настоящего времени фенилацетиленовые спирты в ЭК системе не изучались, поэтому в качестве объектов исследования были выбраны фенилпропаргиловый спирт (7), диметил(фенилэтинил)карбинол (8) и метилэтил(фенилэтинил)карбинол (9), продукты восстановления которых по ацетиленовой связи являются душистыми веществами.
Подраздел 4.2. С целью прогнозирования и объяснения влияния алкильных заместителей на реакционную способность исследуемых реагентов были выполнены квантово-химические расчеты молекул 7 - 9, и полупродуктов их восстановления до двойной связи в полуэмпирическом приближении РМ3. Анализ структурных параметров и электронных характеристик рассчитанных молекул 7–9 показал, что введение алкильных заместителей у гидроксилсодержащего атома углерода не оказывает электронодонорного эффекта на соседнюю ацетиленовую связь. Наоборот, частичный отрицательный заряд на С2-атоме ацетиленовой связи, который является предполагаемым центром первичной атаки атомарного водорода при ЭК гидрировании ацетиленовых карбинолов, уменьшается в ряду 7 > 8 > 9.
Кроме того, выполненные квантово-химические расчеты (методом B3LYP/6-31G** по программе РС GAMESS) для комплексов атомов Ni и Zn с молекулой 7 показали, что формирование σ-комплекса фенилацетиленовых спиртов с атомом цинка сопровождается небольшим транс-изгибом исходной молекулы (рисунок 3, б), что объясняет преимущественное образование транс-изомеров винилкарбинолов. В то же время, согласно полученным результатам, атом никеля взаимодействует с ацетиленовой связью фенилпропаргилового спирта, образуя довольно прочный π-комплекс, и сопровождается цис-искажением молекулы 7 (рисунок 3, а).

а
|
б
|
Рисунок 3 – Пространственные структуры комплексов Ni + ФПС (а) и Zn + ФПС (б)
Подраздел 4.3. Электрокаталитическое гидрирование карбинола 7 проводилось в диафрагменной ячейке на катоде, активированном скелетными катализаторами на основе d- и s-металлов (Ni, Cu, Fe и Co) и на электролитических порошках Cu и Zn при плотности тока 2 кА/м2, концентрации вещества 0,112 моль/л и температуре 303 К. В качестве анолита использовали 50 мл 20 %-ного раствора NaOH, католита – спиртово-водно-щелочной раствор (45 мл 2 %-ного раствора NaOH и 10 мл этилового спирта) (таблица 4).
Как следует из данных таблицы 4, наибольшую активность по скорости и коэффициенту использования водорода показали Ni Ренея и скелетная Cu: на них реакция восстановления идёт до конца с образованием гидрокоричного спирта. Катализаторы на основе цинка проявили высокую селективность по промежуточному продукту, чем и объясняется самопроизвольная остановка реакции при 50%-ном поглощении водорода и накопление в катализате коричного спирта.
Таблица 4 – Гидрирование фенилпропаргилового спирта на различных катализаторах
-
Катализатор
|
Поглощение Н2, %
|
W, мл Н2/мин
|
h, %
|
Состав католита, %
|
С=С
|
С-С
|
Ni скел.
|
100
|
6,8
|
76
|
0
|
100
|
Cu скел.
|
100
|
6,0
|
72
|
0
|
100
|
Zn скел.
|
50
|
3,8
|
45
|
100
|
0
|
Zn электрол.
|
50
|
2,7
|
42
|
100
|
0
|
Cu электрол.
|
74
|
4,3
|
46
|
26
|
74
|
Хроматографический анализ выделенного коричного спирта – продукта ЭК гидрирования спирта 7 на Zn катализаторе – показал наличие двойного пика, обусловленного смесью цис- (40%) и транс- (60%) изомеров. Методом колоночной хроматографии на твердой фазе оксид кремния с использованием системы растворителей гексан-диэтиловый эфир (1:1) были разделены цис- и транс-изомеры; их соотношение (40:60) хорошо согласуется с данными хроматографического анализа.
В подразделе 4.4 представлены результаты исследований по влиянию природы и количества органического растворителя (этанола, изо-пропанола, диметилсульфоксида и диоксана), а также химической природы катализаторов на процесс ЭК восстановления карбинола 8. Эксперименты выполнены при плотности тока 2 кА/м2, температуре 303 К, количестве катализатора – 0,001 кг и концентрации вещества 0,112 моль/л.
Полученные результаты показали, что максимальное поглощение водорода наблюдается при гидрировании вещества 8 с использованием этилового спирта. Скорость гидрирования в этом растворителе также оказалась наиболее высокой: 4,5 мл Н2/мин. В случае использования диметилсульфоксида и диоксана скорости гидрирования существенно ниже, чем в этаноле: 2,9 и 3,6 мл Н2/мин; поглощение Н2 – 65 и 61 %, соответственно.
Как следует из данных таблицы 5, при гидрировании карбинола 8 на скелетном никеле и меди реакция его восстановления идет до конца с образованием предельного спирта. Скелетный Zn, также как и в случае спирта 7, проявил селективность к промежуточному продукту. При этом скорость гидрирования карбинола 8 на Ni и Cu выше, чем на Zn.
Подраздел 4.5. Эксперименты по гидрированию метилэтил(фенилэтинил)-карбинола 9, выполненные в следующих общих условиях: плотность тока 2 кА/м2, температура 293 К, катализатор – никель Ренея 0,001 кг, Со = 0,112 моль/л, также показали сильную зависимость ЭК гидрирования 9 от количества добавляемого органического растворителя – этилового спирта (рисунок 4, а). Скорость гидрирования карбинола 9 заметно увеличивается при добавлении в католит 30 мл С2Н5ОН, но поглощение водорода составляет 72 %. С целью улучшения растворимости данного карбинола в спиртово-щелочной среде и повышения поглощения водорода были выполнены исследования с использованием перемешивания католита, которые показали существенное влияние этого фактора на процесс ЭК восстановления карбинола 9 (рисунок 4, б).
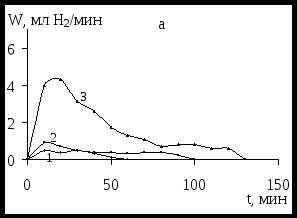 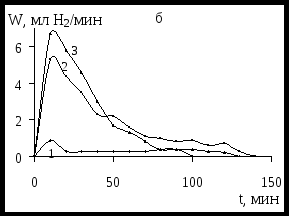
|
1 – 10 мл; 2 – 20 мл; 3 – 30 мл С2Н5ОН.
Рисунок 4 – Кинетические кривые ЭК гидрирования карбинола 9
без перемешивания (а) и с перемешиванием (б) католита при добавлении различного количества этанола
Однако поглощение водорода в условиях перемешивания католита также было не полным (85 %). 100 %-ное поглощение водорода при гидрировании карбинола 9 наблюдалось при увеличении температуры реакционной среды до 303 К. Полученные экспериментальные зависимости степени превращения данного карбинола от продолжительности процесса восстановления при варьировании температуры от 293 до 323 К были обработаны по уравнению Колмогорова-Ерофеева (1), и определены коэффициенты a и b (таблица 6).
Таблица 6 – Значения коэффициентов a и b в уравнении (1), коэффициентов корреляции R, значимости tR и скоростей гидрирования карбинола 9
Т, К
|
а
|
b
|
R
|
tR
|
d/dt, мин-1 при следующих
|
0,1
|
0,2
|
0,5
|
293
|
0,012
|
1,036
|
0,987
|
168,1>2
|
0,13·10-2
|
0,12·10-2
|
0,01·10-2
|
303
|
0,003
|
1,723
|
0,992
|
223,2>2
|
2,03·10-2
|
2,45·10-2
|
2,49·10-2
|
313
|
0,011
|
1,335
|
0,980
|
310,3>2
|
2,28·10-2
|
2,45·10-2
|
2,04·10-2
|
323
|
0,013
|
1,301
|
0,991
|
206>2
|
2,43·10-2
|
2,57·10-2
|
2,09·10-2
|
Коэффициенты корреляции рассчитанных величин с её экспериментальными значениями также показывают хорошую применимость математической модели для топохимических реакций к процессам ЭК восстановления органических веществ.
Для исследования влияния химической природы катализатора на процесс ЭК гидрирования вещества 9 были использованы скелетные и электролитические катализаторы (таблица 7). Эксперименты проводили в тех же условиях, что и для фенилацетиленовых спиртов 7, 8.
Таблица 7 – Гидрирование карбинола 9 на различных катализаторах (Т = 303 К, Vэтанола = 30 мл)
Катализаторы
|
Поглощение Н2, %
|
W, мл Н2/мин
|
η, %
| Состав католита, % |
С≡С
|
С=С
|
С–С
|
Ni скел.
|
100
|
4,8
|
69,7
|
–
|
–
|
100
|
Cu скел.
|
94
|
4,3
|
71,3
|
–
|
6
|
94
|
Cu электрол.
|
78
|
2,2
|
31,0
|
–
|
22
|
78
|
Zn скел.
|
14
|
0,5
|
6,0
|
86
|
14
|
–
|
Zn электрол.
|
13
|
0,4
|
5,0
|
87
|
13
|
–
|
Лучшие результаты по электрокаталитическому гидрированию карбинола 9 получены на скелетных Ni и Cu, на которых этот карбинол восстанавливается с поглощением двух молей водорода, образуя метилэтил(фенилэтил)карбинол. На электролитической Cu получена смесь винилового и предельного спиртов, на Zn катализаторах – виниловый спирт с небольшими выходами.
В подразделе 4.5 проведен сравнительный анализ полученных результатов по восстановлению фенилацетиленовых спиртов в ЭК системе на катоде, активированном Ni и Zn катализаторами. Отмечено, что выведенная на основе квантово-химических расчетов последовательность фенилацетиленовых спиртов по уменьшению их реакционной способности подтверждена экспериментальными исследованиями по их ЭК восстановлению.
ЗАКЛЮЧЕНИЕ
На основе выполненных исследований по ЭК восстановлению ацетофенона и его п-замещенных производных, бензофенона и фенилацетиленовых спиртов можно сделать следующие выводы:
1. Электрокаталитическое восстановление ацетофенона до метилфенилкар-бинола проходит с наибольшим поглощением водорода и лучшими скоростями гидрирования в водно-щелочной среде католита с добавлением этилового спирта на Cu и Ni скелетных катализаторах и электролитическом порошке Cu. Метилфенилкарбинол, относящийся к душистым веществам, получается с высоким выходом.
2. На примере зависимостей степени превращения ацетофенона и его четырех пара-замещенных производных от начальной концентрации гидрируемого вещества и температуры реакционной среды показана хорошая применимость кинетической модели Колмогорова-Ерофеева для описания ЭК процессов восстановления, что подтверждено расчетом коэффициентов корреляции и их значимости; определены скорости гидрирования этих веществ при различных степенях превращения, константы скорости и энергии активации (для R= H, NH2).
3. Проведены укрупненно-лабораторные исследования по получению метилфенилкарбинола ЭК гидрированием ацетофенона, по результатам которых построена номограмма степени превращения ацетофенона в диапазоне взаимного влияния изученных факторов и определены оптимальные зоны их действия.
4. На основе применения метода вероятностно-детерминированного планирования эксперимента изучено влияние различных факторов (плотность тока, количество катализатора, начальная концентрация вещества, температура реакционной среды и продолжительность процесса) на ЭК восстановление бензофенона. Полученное обобщенное многофакторное уравнение применено для кинетического анализа данного процесса. Показано, что в сравнении с ацетофеноном восстановление бензофенона проходит с меньшей скоростью и с меньшими выходами, что объяснено электронным строением и меньшей его растворимостью в среде католита.
5. Проведенными исследованиями по ЭК гидрированию фенилацетиленовых спиртов установлено селективное образование продуктов на различных катализаторах. На скелетных Ni и Cu восстановление тройной связи в этих спиртах проходит до конца с образованием предельных спиртов. Скорость гидрирования уменьшается в ряду фенилпропаргиловый спирт >диметил(фенилэтинил)карби-нол > метилэтил(фенилэтинил)карбинол и существенно зависит от объема органического растворителя, добавляемого в щелочной раствор католита. Селективными по промежуточным продуктам – фенилвиниловым спиртам – проявили себя катализаторы на основе Zn. Полученный продукт восстановления фенилпропаргилового спирта – коричный спирт был разделен на цис- и транс-изомеры (в соотношении 40:60 %) на хроматографической колонке.
Оценка полноты решения поставленных задач. Поставленные задачи по подбору эффективных катализаторов гидрогенизации, изучению влияния различных факторов на ЭК процессы восстановления ароматических кетонов и фенилацетиленовых спиртов, по применению уравнения Колмогорова-Еро-феева для описания реакций ЭК гидрирования изучаемых соединений, использованию вероятностно-детерминированного метода планирования эксперимента и проведению на его основе кинетического анализа изучаемых процессов, исследованию возможности селективного восстановления фенилацетиленовых спиртов до винилкарбинолов, разделению цис-и транс-изомеров коричного спирта и оптимизации процесса ЭК гидрирования ацетофенона на укрупненной лабораторной установке решены полностью, что подтверждают сформулированные выводы по результатам работы.
Оценка научного уровня выполненной работы в сравнении с лучшими достижениями в данной области. В литературе имеется довольно много описанных научных разработок по восстановлению ароматических кетонов и ацетиленовых спиртов каталитическими, электрохимическими и химическими методами. Поиск более эффективных способов восстановления этих веществ продолжается и в настоящее время. Электрокаталитический метод гидрирования органических соединений обладает рядом преимуществ по сравнению с другими методами, одним из которых является его экологическая безопасность. Необходимо отметить также, что гидрирование исследуемых в данной работе веществ в ЭК системе ранее не проводилось, а третичные фенилацетиленовые спирты не восстанавливались и другими методами. Изучение кинетики ЭК процессов восстановления п-замещенных ацетофенонов и третичных ацетиленовых спиртов выполняет прогностическую функцию и определяет зависимость реакционной способности этих веществ от их строения.
Рекомендации по конкретному использованию результатов диссертации. Полученные в ЭК системе продукты восстановления являются душистыми веществами и широко применяются в парфюмерной и пищевой промышленностях. Запатентованный метод электрокаталитического синтеза метилфенилкарбинола из ацетофенона на медном катализаторе может быть внедрен в промышленном масштабе для малотоннажного производства. Методики построения математических моделей изученных процессов и кинетический анализ, выполненный на их основе, могут быть использованы для математического моделирования подобных химических процессов.
Список опубликованных работ по теме диссертации
1 Соболева Е.А., Бекенова У.Б., Кирилюс И.В., Иванова Н.М. Влияние внеиндексных групп на скорость электрокаталитического гидрирования карбонильной группы / Тезисы докл. VII Научн. школы-конф. по органической химии. – Екатеринбург, 2004. – С. 91.
2 Бекенова У.Б., Кирилюс И.В., Соболева Е.А. Электрокаталитическое гидрирование ацетофенона / Тезисы докл. VII Научн. школы-конф. по органической химии. – Екатеринбург, 2004. – С. 108.
3 Иванова Н.М., Соболева Е.А. Электронное строение пара-замещенных производных ацетофенона / Материалы II Межд. научно-практ. конф. "Теоретическая и экспериментальная химия". – Караганда, Изд-во КарГУ, 2004. – С. 78-80.
4 Кулакова Е.В., Кирилюс И.В., Иванова Н.М., Соболева Е.А., Бекенова У.Б. Влияние количества катализатора на электрокаталитическое гид-рирование ацетофенона / Материалы II Межд. научно-практ. конф. "Теоретическая и экспериментальная химия". – Караганда, Изд-во КарГУ, 2004. – С. 173-176.
5 Соболева Е.А., Иванова Н.М., Бекенова У.Б., Кирилюс И.В., Сиволобова О.А. Влияние пара-заместителей на скорость электрокаталитического гидрирования ацетофенонов // Известия НАН РК. Серия хим. – 2004. – № 4. – С. 3-10.
6 Кирилюс И.В., Кулакова Е.В., Соболева Е.А., Закарин С.З. О математическом планировании эксперимента на примере электрокаталитического гидрирования ацетофенона // Вестник КазНУ им. аль-Фараби. Серия хим. – 2004. – № 4 (36). – С. 256-261.
7 Соболева Е.А., Иванова Н.М. Сиволобова О.А., Кулакова Е.В. Электрокаталитическое гидрирование метиэтил(фенилэтинил)карбинола / Тезисы докл. 8 научной школы-конф. по органической химии. – Казань, 2005. – С.374.
8 Кирилюс И.В., Кулакова Е.В., Соболева Е.А. Матрица и планирование экспериментов / Материалы Межд. научно-практ. конф. "Академик Е.А. Букетов – ученый, педагог, мыслитель" посвященной 80-летию Е.А. Букетова. – Караганда, 2005. – С. 212-217.
9 Соболева Е.А., Бекенова У.Б., Кулакова Е.В., Иванова Н.М., Сиволобова О.А. Электрокаталитическое гидрирование ароматических ацетиленовых спиртов / Материалы Межд. научно-практ. конф. "Академик Е.А. Букетов – ученый, педагог, мыслитель" посвященной 80-летию Е.А. Букетова. – Караганда, 2005. –С. 461-464.
10 Соболева Е.В., Кулакова Е.В., Иванова Н.М., Бекенова У.Б., Сиволобова О.А. Влияние количества растворителя и природы катализатора на электрокатлитическое восстановление третичных фенилацетиленовых спиртов / Материалы Межд. научно-практ. конф. "Физико-химические процессы в газовых и жидких средах". – Караганда, 2005. – С. 186-188.
11 Иванова Н.М., Соболева Е.А., Мулдахметов З.М. Расчеты комплексов цинка с молекулами С6Н5−С≡С−R и С6Н5−С=С−R методом В3LYP/6-31G** / Материалы Межд. научно-практ. конф. "Современные проблемы органического синтеза, электрохимии и катализа", посвященной 80-летию проф. И.В. Кирилюса. – Караганда, 2006. – С. 75-79.
12 Кирилюс И.В., Бекенова У.Б., Кулакова Е.В., Соболева Е.А., До С.В., Иванова Н.М., Сиволобова О.А. Электрокатализ в синтезе душистых веществ. – Караганда: Изд-во КарГУ, 2006. – 173 с.
13 Соболева Е.А, Иванова Н.М., Кулакова Е.В., Бекенова У.Б., Кирилюс И.В. Электрокаталитическое гидрирование фенилацетиленовых спиртов на цинковом катализаторе / Материалы ІІІ Межд. научно-практ. конф. "Теоретическая и экспериментальная химия". – Караганда, 2006. – С. 239-243.
14 Соболева Е.А., Иванова Н.М., Кирилюс И.В., Сиволобова О.А., Бекенова У.Б. Электрокаталитическое гидрирование диметил(фенилэтинил)карбинола / Тезисы докл. XVI Всерос. совещания по электрохимии органических соединений "ЭХОС-2006 г". – Новочеркасск, 2006. – С. 113-114.
15 Соболева Е.А., Кулакова Е.В., Иванова Н.М., Бекенова У.Б., Сиволобова О.А. Электрокаталитическое гидрирование диметил- и метилэтил(фенил-этинил)карбинолов // Электрохимия – М.: 2007. –Т. 43., № 1. – С. 113-116.
16 Предпатент № 19050 РК. Способ получения метилфенилкарбинола / Соболева Е.А., Бекенова У.Б., Кирилюс И.В., Иванова Н.М., Тусупбекова Г.К., Закарин С.З. заявка № 2005/1213.1 от 17.10.2005 г.
Соболева Елена Анатольевна
ЭЛЕКТРОКАТАЛИТИКАЛЫҚ ЖҮЙЕДЕ КЕЙБІР ХОШ ИІСТІ КЕТОНДАРДЫ ЖӘНЕ ҮШІНШІЛІК АЦЕТИЛЕНДІК СПИРТТЕРДІ ТОТЫҚСЫЗДАНДЫРУДЫҢ ФИЗИКО-ХИМИЯЛЫҚ АСПЕКТІЛЕРІ
02.00.04- физикалық химия мамандығы бойынша химия ғылымдарының кандидаты атағын алуға арналған диссертацияның авторефераты
ТҮЙІНДЕМЕ
Зерттеу объектілері. Хош иісті кетондар: ацетофенон, n- метилацетофенон, n- метоксиацетофенон, n- бромацетофенон және бензофенон; фенилацетилендік спирттер: фенилпропаргилды спирт, диметил (фенилэтинил) карбинол, метилэтил (фенилэтинил) карбинол.
Жұмыстың мақсаттары: Ацетофенонның қалпына келу үрдісін және оның пара- ауыстырылған өнімдерін n-R1-C6H4-CO-CH3 (R1= СН3, ОСН3, NH2 және Br), бензофенон және фенилацетиленді спирт C6H5-C=C-CR1R2OH (R1=R2 =H; R1 =R2=CH3; R1=CH3, R2= C2H5) туындыларын катодтағы электрокаталитикалық белсенділендірілген d- және s-металл катализаторлары бар жүйеде зерттеу.
Зерттеу әдістері: Зерттелетін байланыстардың орнына келуі катализатордың белсенді дисперстік қабаты бар катодтағы электрокаталитикалық жүйеде өткізілді. Синтезделген бастапқы заттардың және гидрленген өнімдердің сараптамасы үшін зерттеудің хроматографиялық және ИҚ-спектроскопиялық әдістер қолданылды. Кванттық-химиялық есептеулер кванттық химияның жартылай эмпирикалық (МОРАС бағдарламасының пакеті) және эмпирикалық емес (GAMESS) әдістерімен орындалды.
Жүргізілғен зерттеулердің.
1. Ацетофенонның метилфенилкарбинол түріне дейін электрокаталитикалық тотықсыздануы сутегінің айтарлықтай қосып алуымен және мыст пен никельді қаңқалы катализаторда этил спиртін қосу арқылы мыстың электролитикалық ұнтағында католиттің сулы-сілтілі ортасында гидрленудің жоғары жылдамдығымен өтеді.
2. Ацетофенонның айналу деңгейіне байланысты мысалда және оның төрт пара-ауыстырылған өнімдерін гидрленетін заттардың бастапқы концентрациясынан және реакциялық ортаның температуралары Колмогоров-Ерофеевті қалпына келудің электрокаталитикалық үрдісін сипаттау үшін арналған кинетикалық моделінде жақсы қолдануға болатыны көрсетілген. Корреляция коэффициентін және олардың маңыздылығын есептеу электрокаталитикалық реакциялар үшін осы есептеудің жақсы пайдаланатынын растайды. Ацетофенонның және оның пара-ауыстырылған өнімдерінің: айналудың әр түрлі деңгейлері кезіндегі гидрлену жылдамдығы, белсенділендіру энергиясы мен жылдамдық константасының орнына келуінің электрокаталитикалық үрдісі үшін физико-химиялық параметрлер анықталған.
3. Ацетофенонды электрокаталитикалық гидрлеу арқылы метилфенилкарбинолды алу бойынша ірілендірілген-зертханалық зерттеулер жүргізілді, осының нәтижесінде ацетофенонның қарастырылған факторларының өзара қарым-қатынас диапозонында айналу деңгейінің номограммасы жасалды және оның әсер етуінің оптималды аймағы анықталды.
4. Эксперименттің болжамдық-детерминирленген жоспарлану әдісін пайдалану-дың негізінде бензофенонның электрокаталитикалық тотықсыздануына әртүрлі факторлардың (тоқтың тығыздығы, катализатордың саны, заттардың бастапқы концентрациясы, реакциялық ортаның температурасы мен үрдістің жалғасымдығы) әсер етуі қарастырылды. Протодьяконовтың қорытындыланған көп факторлы теңестірулері осы үрдістің кинетикалық сараптамасын жасауға қолданылды. Ацетофенонмен салыстырғанда бензофенонның қалпына келуі айтарлықтай баяу болатыны және азырақ шығын шығатыны көрсетілді, осы электрондық құрылыммен және католит орталығында бензофенонның азырақ еритіндігімен түсіндірілді.
5. Фенилацетиленді спирттерді электрокаталитикалық гидрлеу бойынша жүргізілген зерттеулерде әр түрлі катализаторларда өнімдердің селективті құрылуы анықталды. Никель мен мыстың қаңқасында үштік байланыстың қалпына келуі осы спирттерде шекті спирттердің пайда болуымен аяғына дейін жүреді. Аралық өнімдер – фенилвинилді спирттерге селективті катализатор ретінде цинкті қолдануға болатыны көрсетілді. Фенилпропаргильді спирттің қалпына келуінен алынған өнім – корич спирті хроматографикалық тізбекте цис- және транс-изомерлер (40:60 % қатысында) деп бөлінді.
Зерттеу нәтижелерінің практикалық маңызы. Ацетофенонның электрокаталитикалық тотықсыздануы бойынша алынған нәтижелер, оның пара-ауыстырылған туындылары және фенилацетиленді спирттері парфюмериядағы иістендіргіш заттардың орнына кеңінен қолданылатын, сол сияқты тамақ өндірісінде хош иіс беруші (мысалы, корич және гидрокорич спирттері) заттардың орнына кеңінен қолдануға болатын сәйкес хош иісті спирттерді алу бойынша аз тоннажды өндірістерді құру барысында қолданыла алады.
Пайдалану аймағы: электрокаталитикалық үрдістер кинетикасы, теориялық органикалық химия, химиялық үрдістерді математикалық модельдеу.
Soboleva Elena Anatolievna
PHYSICAL AND CHEMICAL ASPECTS OF THE SOME AROMATIC CETONES AND TERTIARY ACETYLENIC ALCOHOLS REDUCTION
IN ELECTROCATALYTIC SYSTEM
The autoabstract of the dissertation for a candidate chemical science
degree on speciality 02.00.04 – physical chemistry
Summary
The objects of researches. Aromatic cetones: acetophenone and its para-substituted derivatives (methyl-, methoxy-, amino- and bromoacetophenones), benzophenone and phenylacetylenic alcohols: phenyl propargyl alcohol, dimethyl- and methylethyl(phenylethynyl)carbinols.
The purpose of the dissertation work is investigation of reduction processes of acetophenone and its para-substituted derivatives p-R1−C6H4−CO−CН3 (R1 = CH3, OCH3, NH2 and Br), as well as benzophenone, and phenyl acetylenic alcohols С6H5−C≡C−CR1R2OH (R1= R2= H; R1= R2= CH3; R1= CH3, R2= C2H5) in the electrocatalytic system on the cathode activated by d- and s-metal-catalysts.
The methods of researches. The reduction of studied compounds was carried out in the electrocatalytic system on the cathode activated by a catalyst dispersive layer. The chromatography and IR spectroscopy methods have been used for the analysis of synthesized initial compounds and hydrogenation products. The quantum-chemical calculations were performed by means of semiempirical (MOPAC program package) and ab initio (GAMESS program package) methods of quantum chemistry.
The main results of the work.
-
The electrocatalytic reduction of acetophenone to methylphenylcarbinol proceeds with the largest hydrogen absorption and the best hydrogenation reaction rates in the alkaline solution catholyte with ethanol addition on the copper and nickel skeleton catalysts and electrolytical copper powder.
-
A good applicability of Kolmogorov-Erofeev kinetic model to the description of electrocatalytic reduction processes is shown on the example of acetophenone and its four para-substituted derivatives conversion degree dependences on the initial concentration of the hydrogenating substance. The calculation of correlation coefficients and their meaningfulness confirms a good applicability of the equation for electrocatalytic reactions. The physical and chemical parameters for electrocatalytic reduction processes of the acetophenone and its para-substituted derivatives, namely, hydrogenation rates at various conversion degrees, rate constants and activation energies have been determined. The correlation of effective charge on carbonyl group of acetophenones, as the result of quantum-chemical calculations, with the hydrogenation rate constants is established.
-
The extended laboratory researches on the methylphenylcarbinol preparation by the electrocatalytic hydrogenation of acetophenone have been performed. On the base of these experimental data the nomogram for acetophenone conversion degree is modeled in diapason of the mutual influence of investigated factors, and the optimum zones of their operation are determined.
-
On a basis of the application of the probabilistically-determined method of experiment planning the influence of various factors (current density, catalysts amount, substance initial concentration, catholyte solution temperature, and process time) on the benzophenone electrocatalytic reduction is studied. The resulting general many-factor equation is used for the kinetic analyses of this process. It is shown, that in comparison with acetophenone the benzophenone reduction proceeds more slowly and with less product yields, that was explained by the electronic structure and worse solubility of benzophenone in the catholyte medium.
-
A selective products formation on the various catalysts is deduced by the researches performed on the electrocatalytic hydration of phenylacetylenic alcohols. On the skeleton Ni and Cu catalysts the reduction of acetylenic bond in the alcohols proceeds to completion with saturated alcohols formation. The Zn catalyst showed itself as a selective one to intermediate products – phenyl vinyl alcohols. Cinnamic alcohol - a half-product obtained at the phenyl propargyl alcohol reduction has been separated on the chromatographic column into cis- and trans-isomers (in the ratio 40:60%).
The practical importance of the work. The resulting data on the electro-catalytic reduction of acetophenone, its para-substituted derivatives and phenyl acetylenic alcohols can be used by a realizing of small-tonnage production of the respond aromatic alcohols, that are applied widely as the fragrant substances in perfumery and as the aromatizators (for example, cinnamic and hydrocinnamic alcohols) in the food industry, as well as in the synthesis of many practical important chemical substances.
The areas of application: kinetics of electrocatalytic processes, theoretic organic chemistry, mathematic modeling of chemical processes.
страница 1
|