страница 1 страница 2 | страница 3
Министерство образования и науки республики Казахстан
Павлодарский государственный университет
им. С.Торайгырова
Факультет металлургии, машиностроения и транспорта
Кафедра металлургии
ТЕОРИЯ ЭЛЕКТРОМЕТАЛЛУРГИЧЕСКИХ ПРОЦЕССОВ
Методические указания к практическим занятиям и выполнению контрольных работ заочников
для студентов металлургических специальностей
Павлодар
Кереку
2008
УДК 669.2/.8.053(07)
ББК 34. 33 я7
Т 33
Рекомендовано на заседании кафедры металлургии ПГУ
им. С.Торайгырова
Рецензент: кандидат технических наук, профессор Суюндиков М.М.
Составители: Каршигина З.Б., Байдильдаева Г.Б., Таскарина А.Ж.
Т 33 Теория электрометаллургических процессов. Методические
указания к практическим занятиям/ Сост. Каршигина З.Б.,
Байдильдаева Г.Б., Таскарина А.Ж. – Павлодар: Кереку, 2008. – 40с.
В методических указаниях приводятся краткие сведения об основных определениях электролиза, формулы для расчета технологических параметров процесса. Приведены примеры расчетов, задачи и варианты контрольных заданий.
Методические указания разработаны с учетом требований ГОСО РК 3.08.084 – 2004 специальности 050709 «Металлургия».
УДК 669.2/.8.053(07)
ББК 34. 33 я7
©Каршигина З.Б., Байдильдаева Г.Б., Таскарина А.Ж.
©Павлодарский государственный университет
им. С. Торайгырова, 2008
Введение
Электролизом называют совокупность процессов электрохимического окисления-восстановления, происходящих под воздействием электрического тока на погруженных в электролит электродах.
Открытие электролиза позволило легко проводить такие окислительно-восстановительные процессы, которые обычными химическими способами осуществить трудно. Посредством электролиза были открыты сначала щелочные, а затем щелочноземельные металлы.
Развитие техники электролиза привело к возникновению электрометаллургии, использующей для восстановления природных соединений металлов электрический ток на катоде.
Получение металлов электролизом их водных растворов называется гидроэлектрометаллургией, подразделяющейся на электроэкстракцию и электролитическое рафинирование.
При электроэкстракции металл выделяют из раствора, полученного в результате выщелачивания металлсодержащих рудных материалов или промежуточных продуктов технологии.
Электролитическое рафинирование применяют для очистки металла от примесей. В процессе электролиза очищаемый металл, из которого изготовлен один из электродов, окисляется и переходит в раствор в виде ионов, восстанавливающихся на другом электроде.
Процессы электролиза водных растворов используют при получении практически всей производимой в мире меди, большей части никеля, цинка, золота, серебра и кадмия, значительной доли олова, свинца, сурьмы и других цветных и редких металлов.
Электролиз расплавленных солей позволил восстанавливать металлы, чисто химическое восстановление которых представляло большие трудности.
Металлы, относящиеся к группе легких: алюминий, магний, натрий, литий, бериллий и другие, будучи наиболее электроотрицательными в ряду напряжений, не могут быть выделены электролизом водных растворов их солей. На катоде в этом случае выделяется водород и образуются гидраты оксидов металлов. Поэтому выделять легкие металлы в свободном виде можно только из электролитов, не содержащих свободных ионов водорода. Такими электролитами являются расплавленные соли, электролиз которых и служит по существу основным (а иногда и единственным) промышленным способом получения легких металлов.
В первом разделе методических указаний приводится краткое пояснение электрохимических параметров, параметров электролиза, используемых при решении задач.
В следующем разделе приводятся примеры основных расчетов, в конце каждого примера даны варианты с целью более углубленного разбора приведенного решения.
В последнем разделе представлены задачи для самостоятельного решения. Каждому студенту выдается индивидуальное задание.
1 Основные определения электролиза и формулы для расчета технологических параметров процесса
Прохождение электрического тока через электрохимические системы связано с химическими превращениями. Зависимость, существующая между количеством протекающего электричества и количеством прореагировавших веществ, была открыта Фарадеем и получила свое выражение в законах, названных впоследствии законами Фарадея.
Согласно закону Фарадея, количество вещества, полученного на электроде, пропорционально количеству прошедшего через электролизер электричества:
gтеор = q∙I∙τ (1)
где gтеор – количество вещества в г, выделившегося на
электроде;
q – коэффициент (электрохимический эквивалент);
при I∙τ = 1 А∙ч, gтеор = q.
Электрохимическим эквивалентом q называется теоретическое количество вещества, которое должно участвовать в электрохимическом процессе при прохождении через электролизер (или элемент) единицы количества электричества.
Для электролитического выделения одного грамма-эквивалента любого вещества требуется 96500 кулонов или 26,8 А∙ч.
Следовательно,
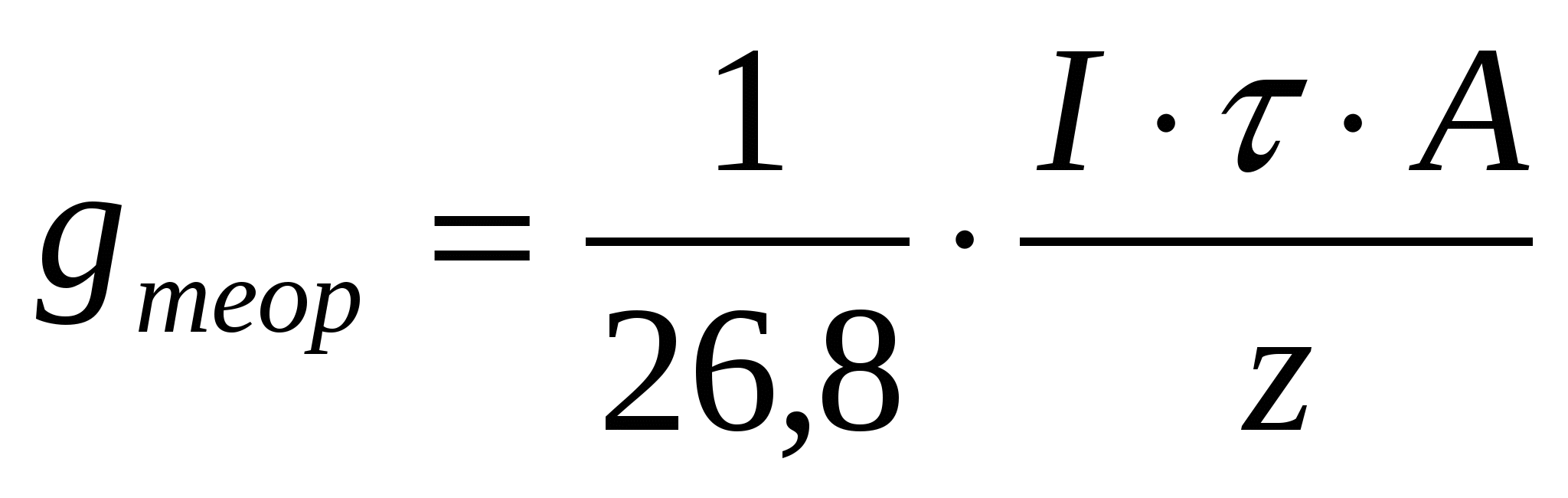 ; ; 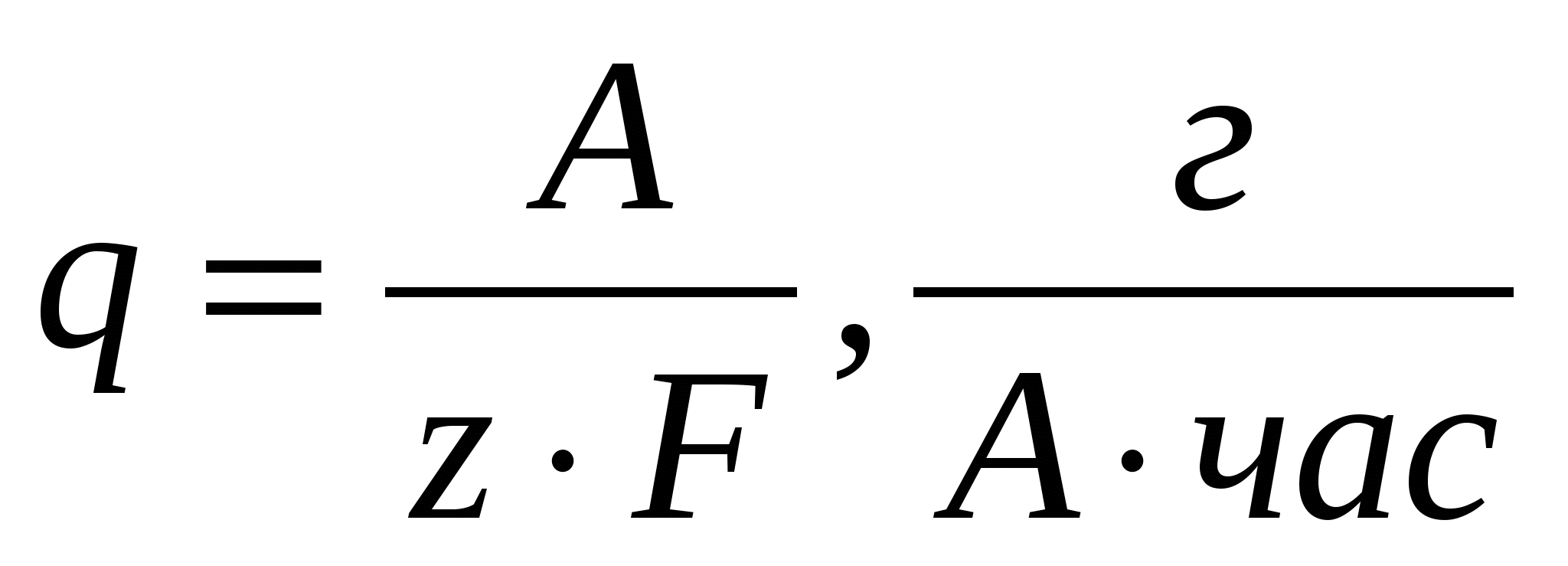 (2) (2)
где А – атомный вес выделяющегося вещества,
z – число электронов, участвующих в реакции.
Если q выражается в миллиграммах на кулон, то формула приобретает вид
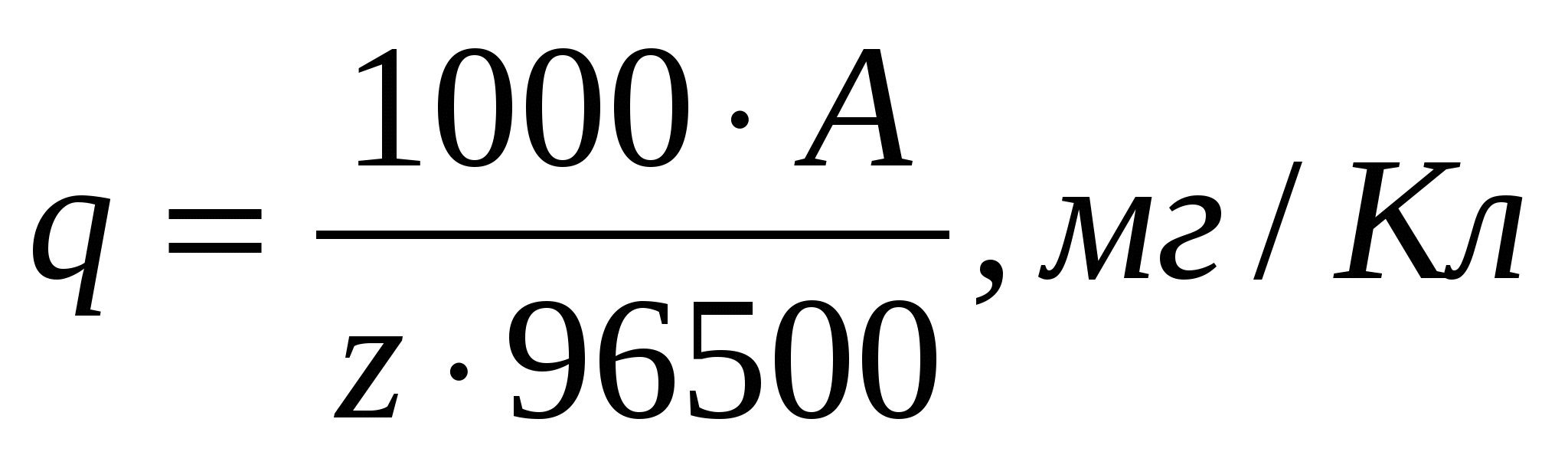 (3) (3)
Расчеты количества реагирующего вещества по его электрохимическому эквиваленту применимы для всех видов электрохимических процессов – катодных и анодных: для выделения на катоде металлов и газов, для растворения анодного металла и выделения на аноде продуктов электрохимического окисления, для электрохимических процессов, протекающих без образования новой фазы и т.д.
В большинстве реальных электрохимических процессов количество фактически реагирующего вещества отличается от теоретической, расчетной величины. Это может быть обусловлено параллельным протеканием других электрохимических реакций (например, одновременное выделение на катоде цинка и водорода при электролитической экстракции цинка), взаимодействием катодных и анодных продуктов, присутствием в электролите солей металлов, дающих несколько степеней окисления, появлением шунтирующих замыканий между электродами и т.д.
Степень отклонения количества фактически прореагировавшего вещества gфакт от величины gтеор, рассчитанной по законам Фарадея, характеризуется при электролизе выходом по току ВТ. Эта величина обычно выражается в процентах и, реже, в долях единицы:
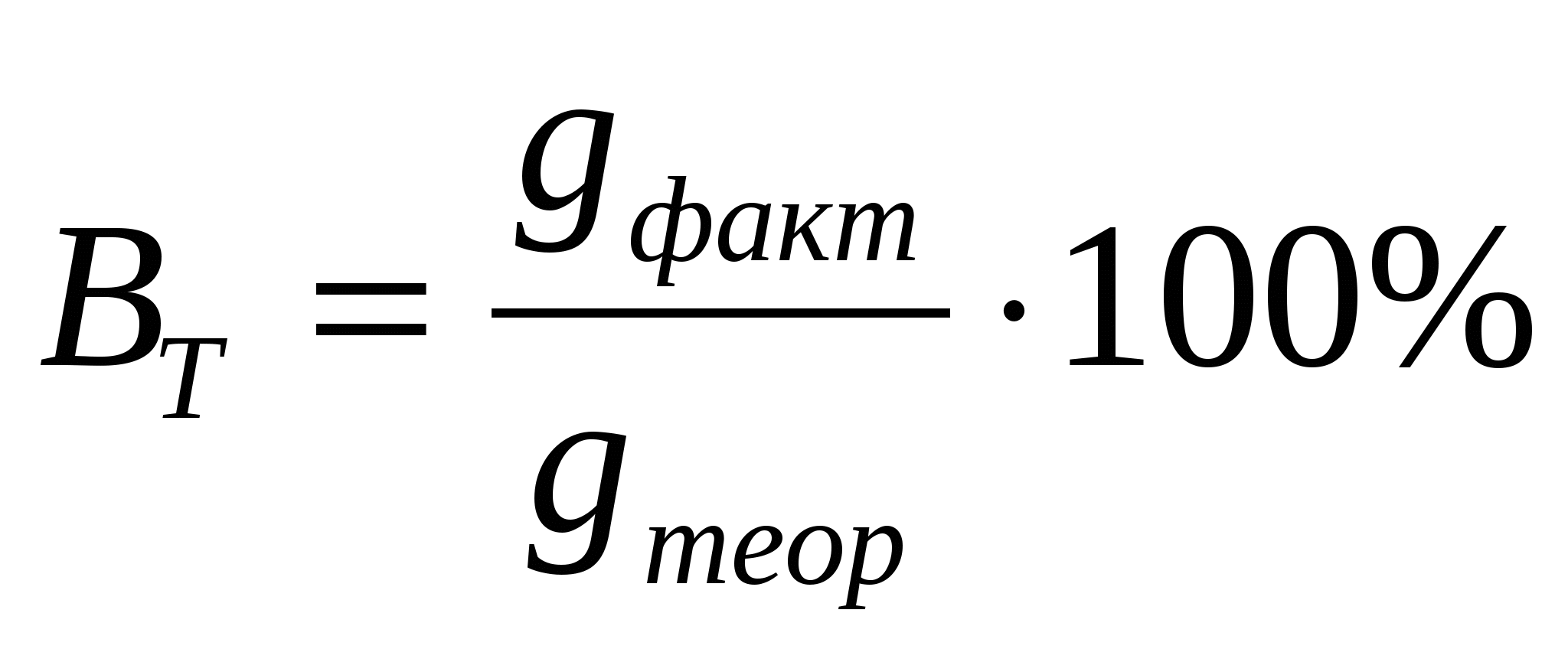 (4) (4)
Выход по току можно представить также отношением:
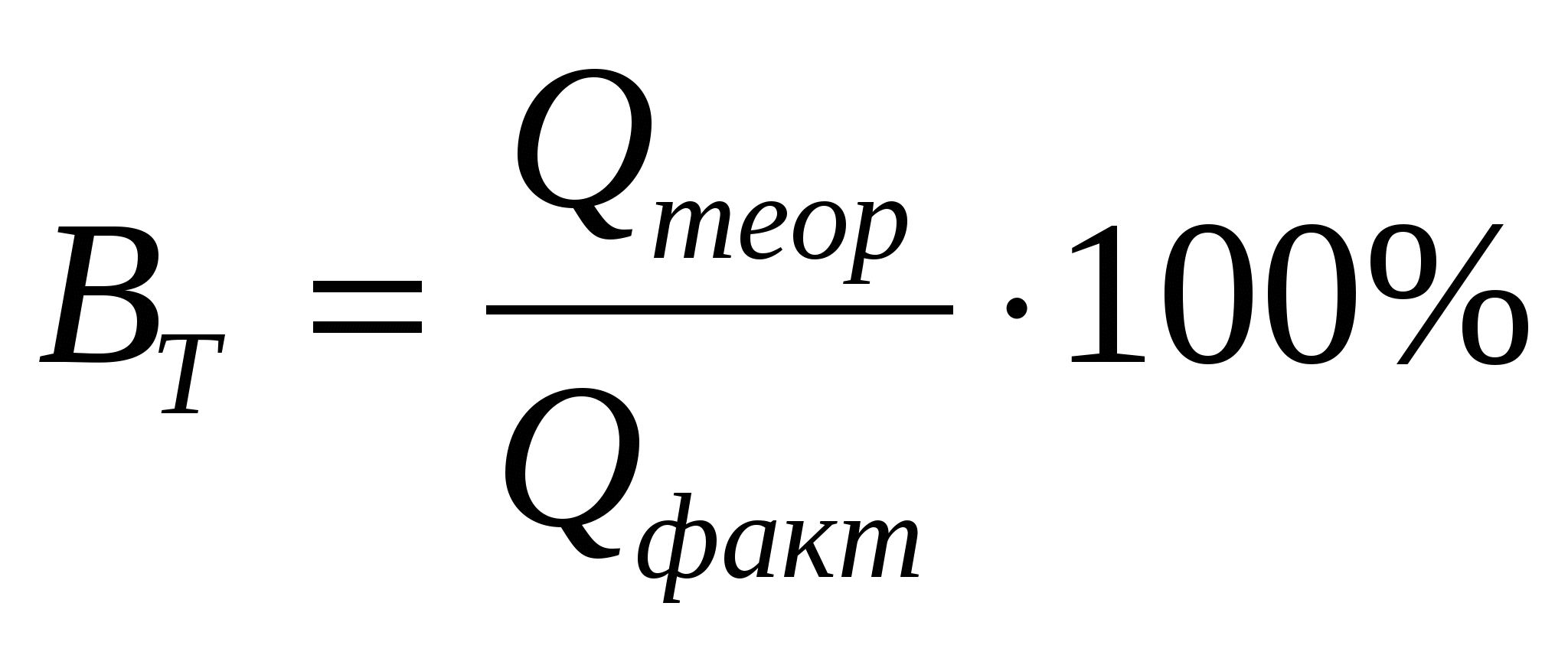 (5) (5)
где Qтеор – количество электричества, которое должно было
быть затрачено на проведение данного процесса по
закону Фарадея;
Qфакт – действительные затраты электричества на единицу
вещества.
Равновесным потенциалом электрода φравн называется потенциал неполяризованного (неработающего) электрода, находящегося в обратимом равновесии с электролитом.
Зависимость равновесного электродного потенциала от активностей (концентраций) веществ, участвующих в электродных процессах и от температуры выражается уравнением Нернста:
φравн. = φ0 + 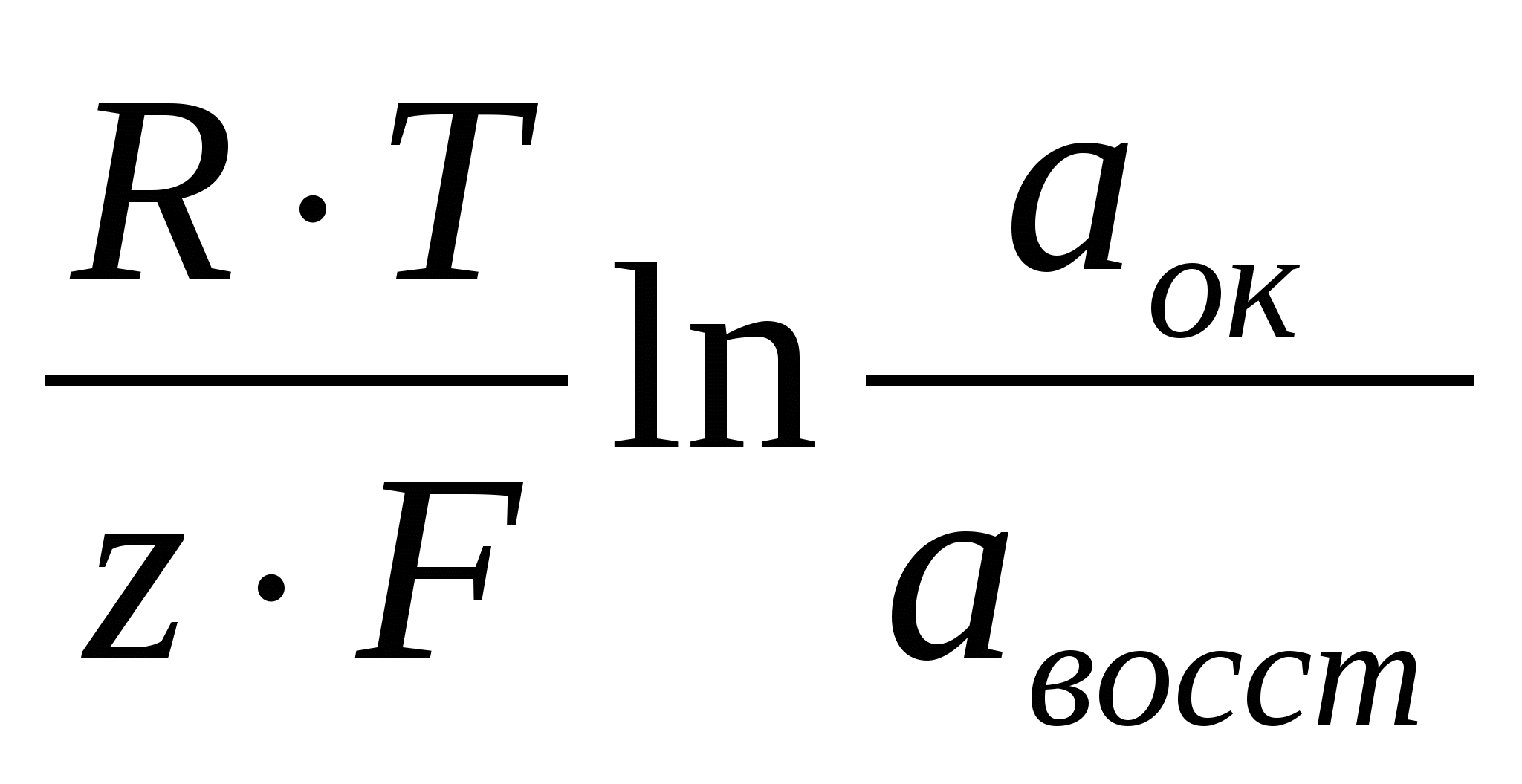 (6) (6)
где φ0 – стандартный электродный потенциал (находят по
справочным таблицам);
R – универсальная газовая постоянная, Дж/(моль∙ 0С);
Т – температура, К;
z – число электронов, участвующих в реакции;
F – число Фарадея, Кл/г-экв;
аок и авосст – произведения активностей окисленной и
восстановленной форм вещества.
Для практического использования уравнения (6) удобно перейти из натуральных логарифмов к десятичным и подставить соответствующие значения коэффициентов (R=8,314Дж, F=96500 Кл/г-экв.) при этом получим выражение
φравн= φ0 + 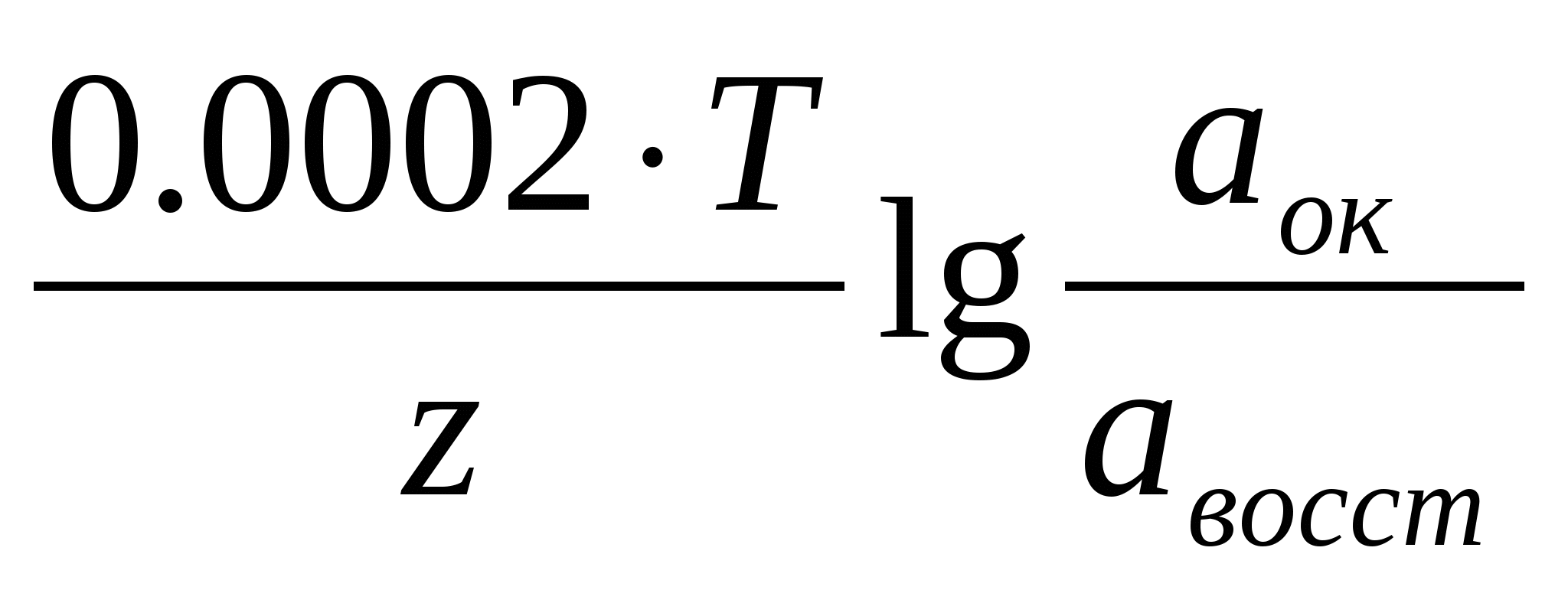 (7) (7)
Напряжение разложения какого-либо компонента электролита есть то минимальное напряжение, которое необходимо приложить извне к электродам, чтобы происходил длительный электролиз с выделением продуктов электролиза.
Если электролиз происходит без перенапряжения и деполяризации, то напряжение разложения равно разности равновесных электродных потенциалов:
Еразл. = 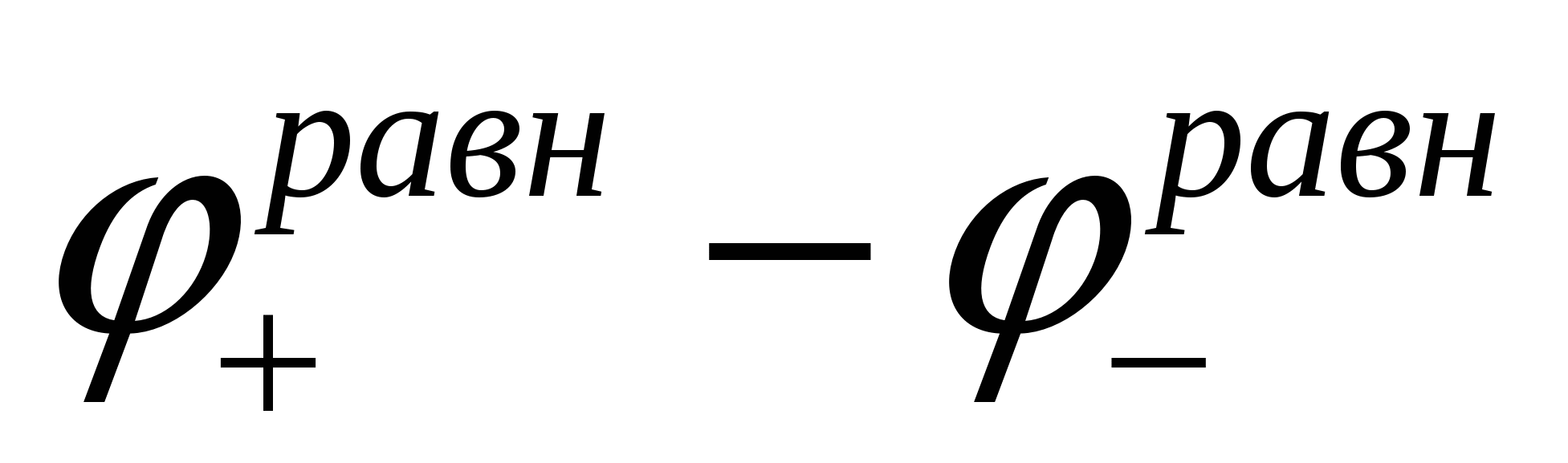 (8) (8)
Значение Еразл может быть использовано при расчетах теоретического удельного расхода электроэнергии Wтеор. и выхода по энергии ВЭ:
Wтеор.= 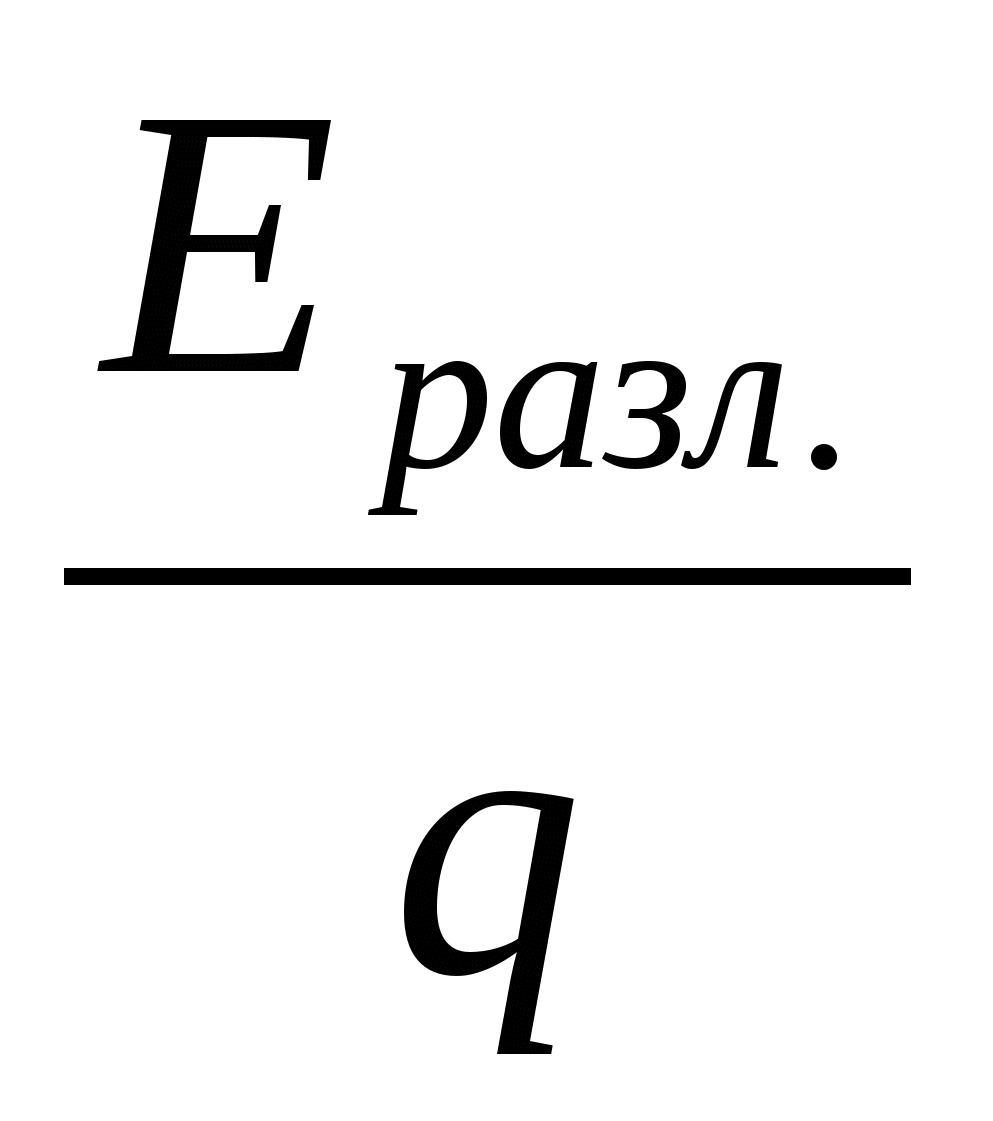 (9) (9)
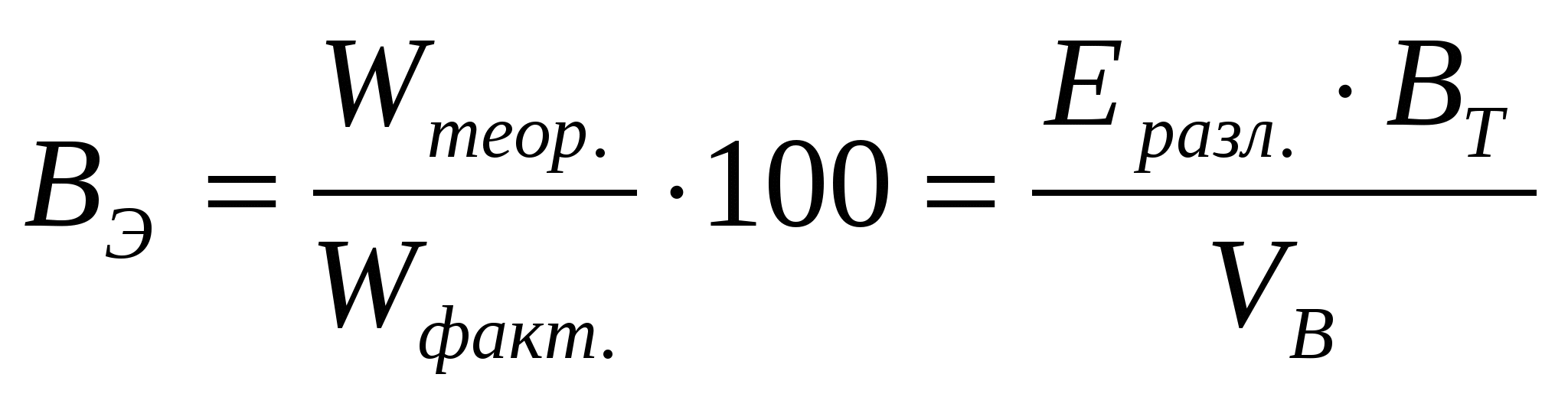 (10) (10)
где VB – напряжение на ванне, В;
ВТ – выход по току, %.
Фактический удельный расход электроэнергии
Wфакт. = 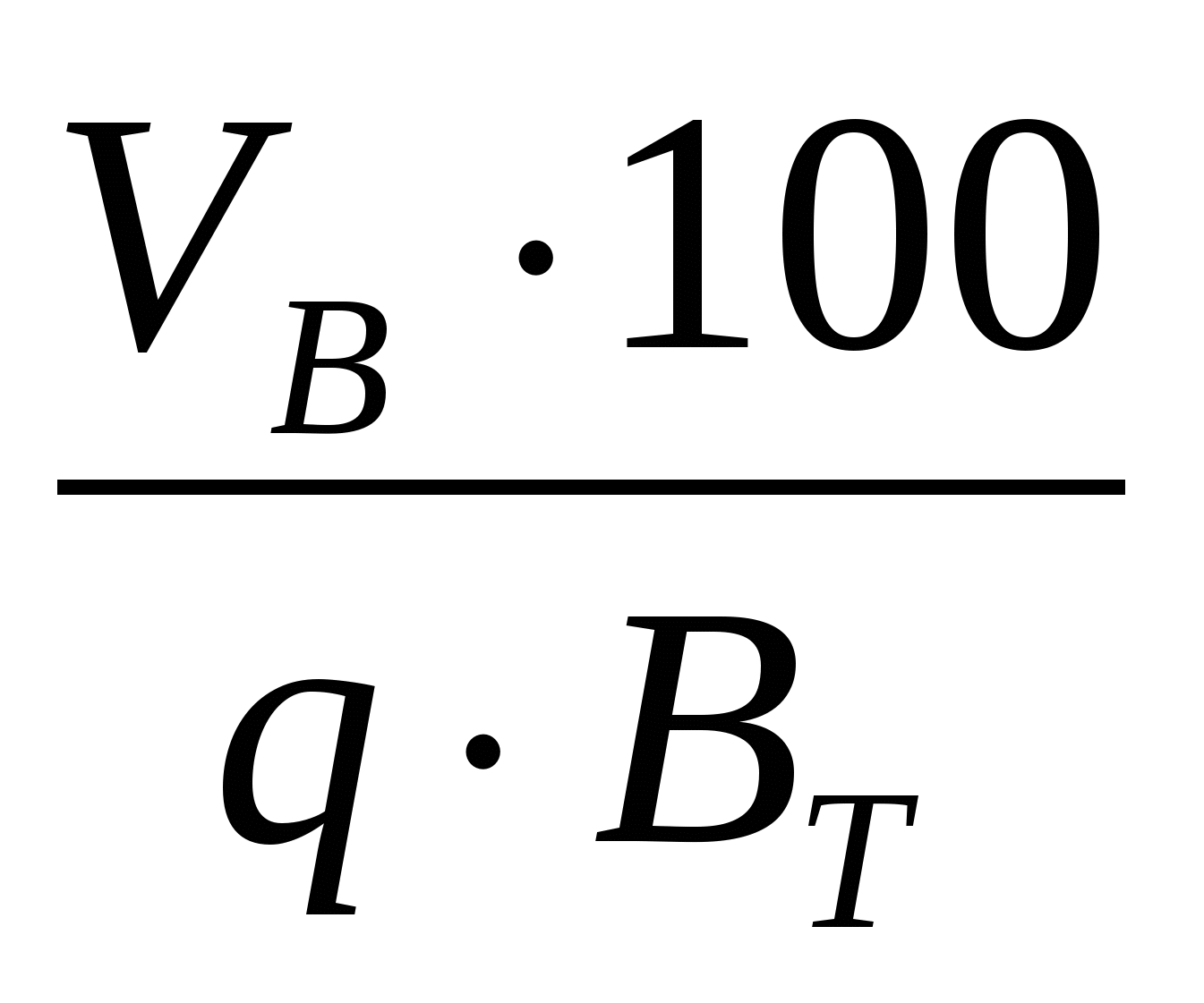 , Вт∙ч/т (11) , Вт∙ч/т (11)
Напряжение на работающей ванне VB больше Еразл. на абсолютные величины катодной и анодной поляризации ηк и ηа и значения омических потерь напряжения в электролите, электродах и контактах:
VB = Eразл. + (ηа – ηк) + I∙R/ + I∙R// + ∆Vконт. (12)
где R/ и R// – омические сопротивления электролита и
электродов.
Падения напряжения в контактах берутся по практическим данным. Потери напряжения в проводниках (электролит и электроды) рассчитываются следующим образом:
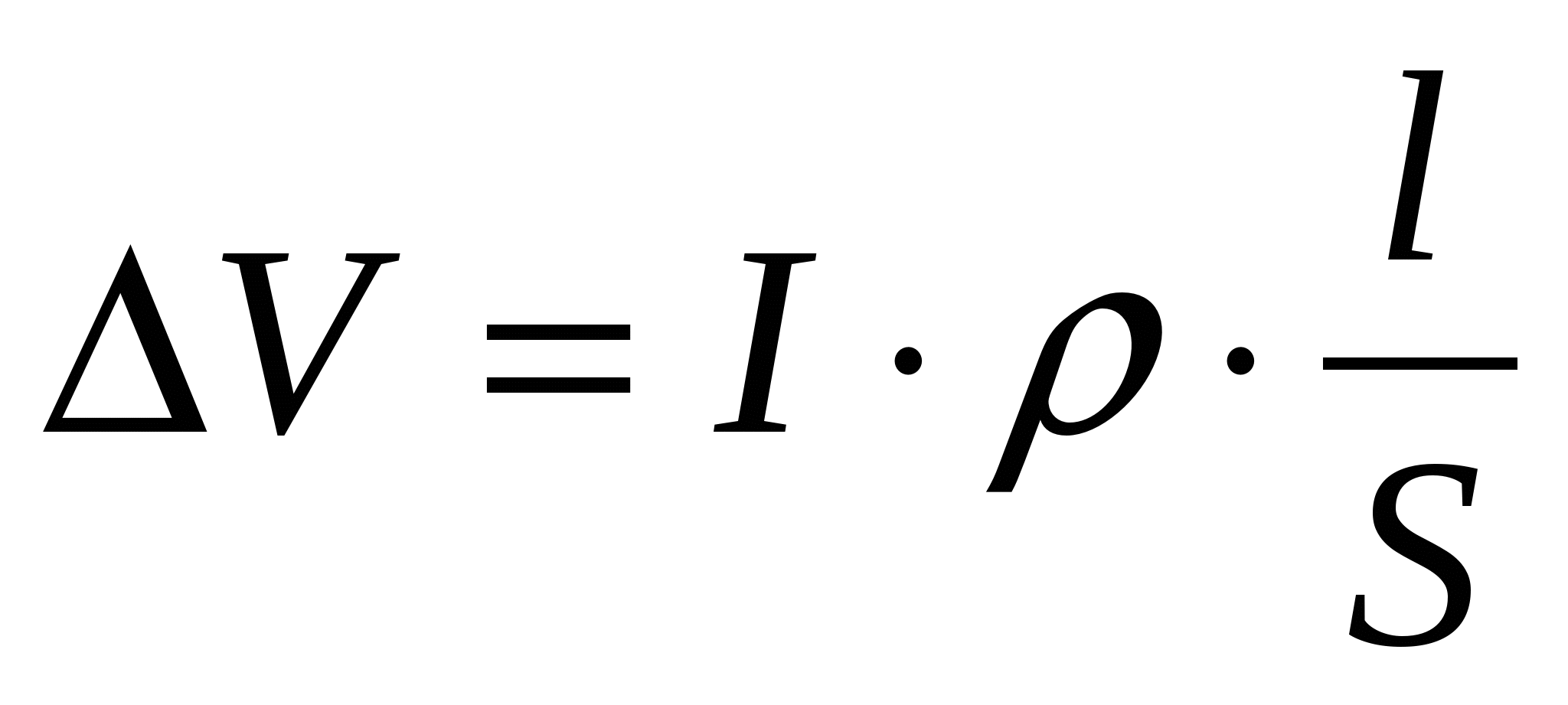 (13) (13)
где I – сила тока, протекающего в данном проводнике, А;
ρ – удельное сопротивление при температуре, в которой
работает проводник, Ом·см;
l – длина проводника (при расчете падения напряжения в
электролите – межэлектродное расстояние), см;
S – сечение (или площадь) проводника, см2.
Для расчета падения напряжения в криолит-глиноземном расплаве при электролизе алюминия обычно используют уравнение, полученное на основании построения профиля электрического поля в электролите (уравнение Форсблома-Машовца):
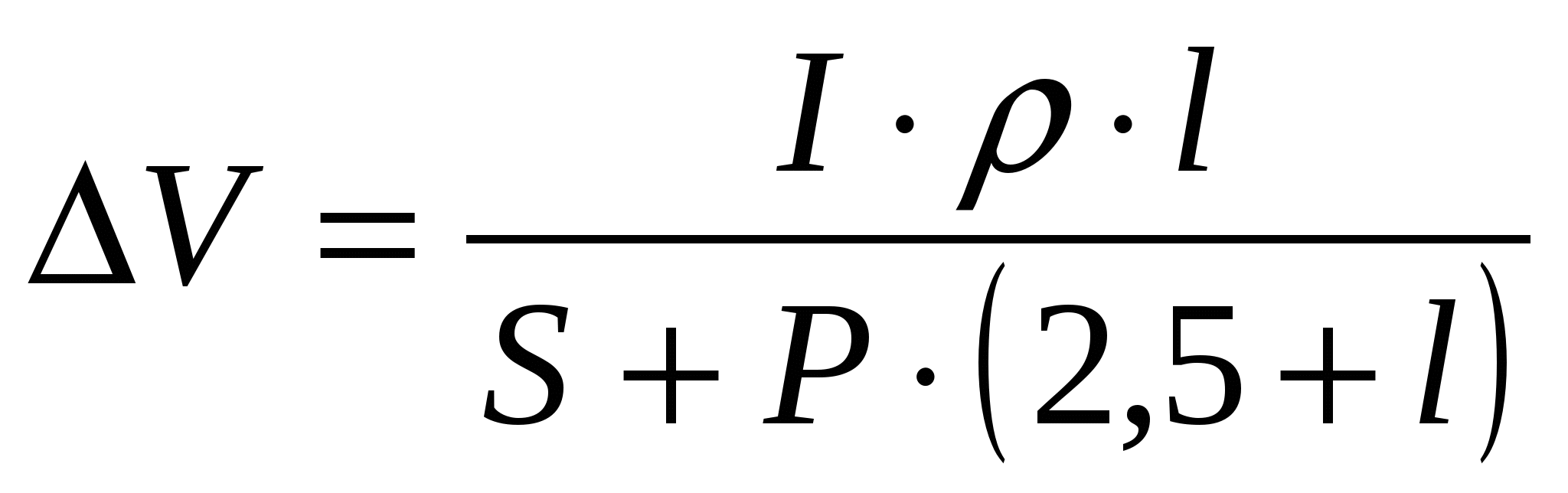 (14) (14)
где ρ – удельное сопротивление электролита при температуре
электролиза, Ом·см;
l – межполюсное расстояние, см;
Р – периметр анода, см;
S – анодная поверхность (сечение анода), см2.
Степень участия вещества в электрохимическом процессе в электролизерах характеризуется степенью разложения вещества и выходом по веществу.
Степень разложения вещества показывает, какая доля данного компонента электролита подверглась электрохимическому превращению за время процесса:
Кр = 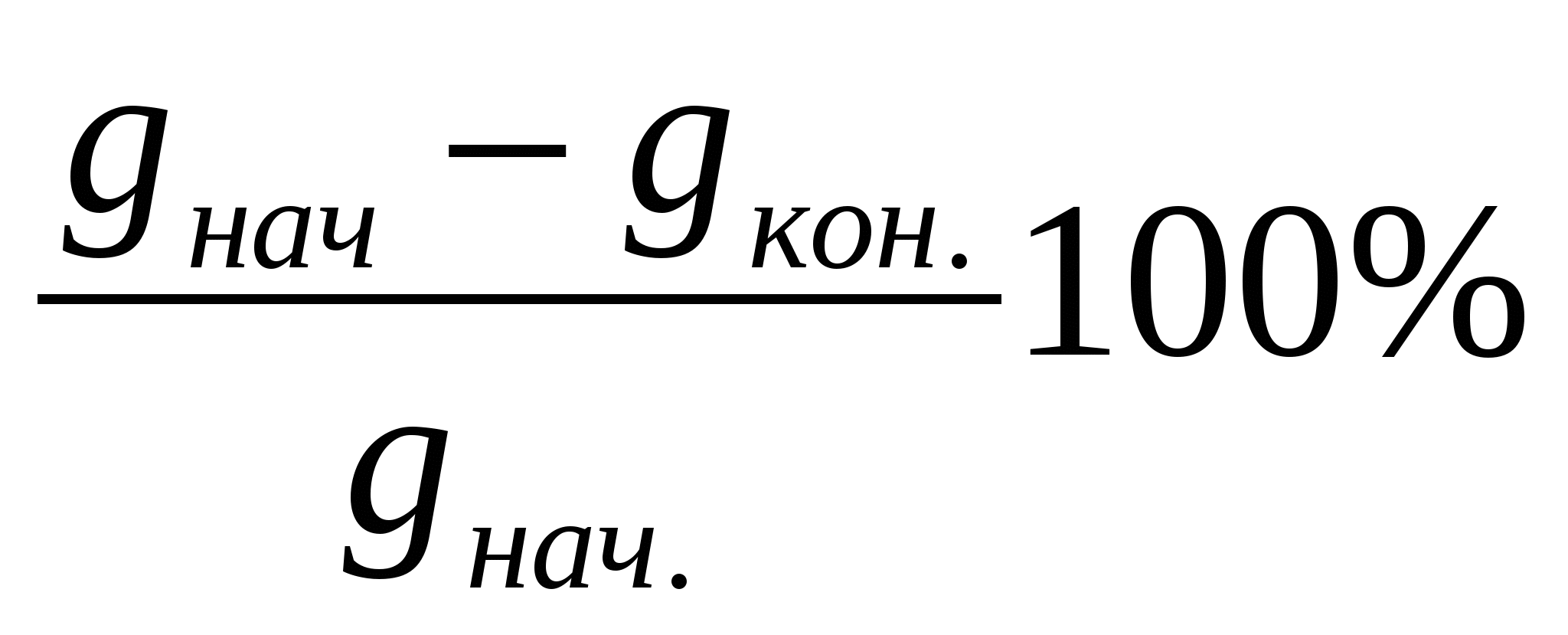 (15) (15)
где gнач. и gкон. – начальное и конечное количество вещества в
электролите.
Выход по веществу равен отношению количества продукта, полученного за время процесса, к тому его количеству, которое можно получить при полном превращении всего исходного вещества, введенного в ванну:
ВВ = 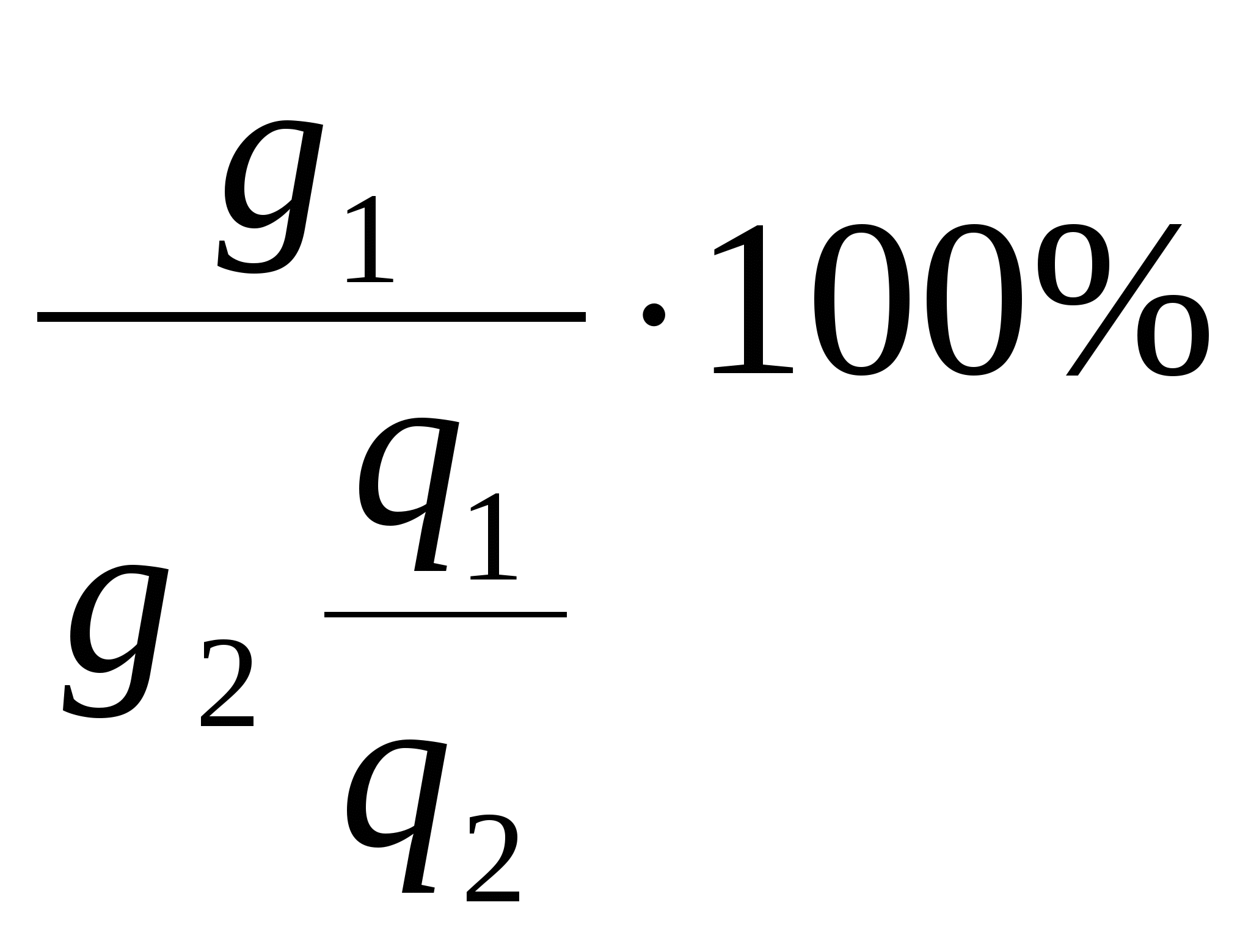 (16) (16)
где g1 – количество полученного продукта;
g2 – количество исходного вещества;
q1 и q2 – электрохимические эквиваленты полученного и
исходного вещества.
Скорость электрохимического процесса измеряется числом ионов, переходящих из фазы в фазу с единицы поверхности в единицу времени. Поскольку ионы представляют электрически заряженные частицы, их передвижение создает электрический ток. Поэтому скорость электрохимической реакции (окисления и восстановления) можно измерять плотностью тока
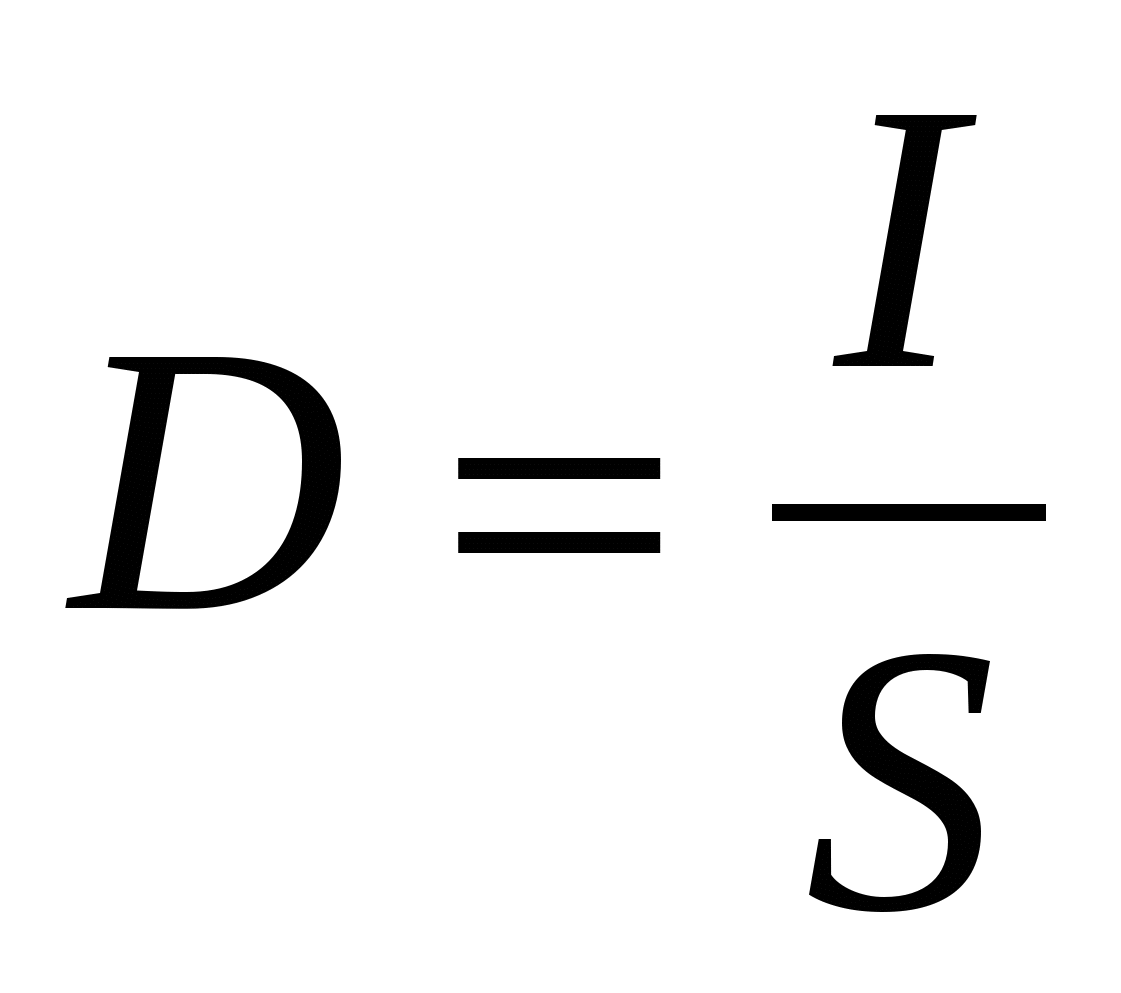 , А/см2 (17) , А/см2 (17)
где S – площадь поверхности электрода (рабочая поверхность),
см2.
В зависимости от того, на каком электроде происходит процесс (на катоде или на аноде), плотность тока может быть катодной и анодной.
Расчеты в процессах электролиза могут основываться на принципах термодинамики. Наиболее употребительными являются три термодинамические функции – термодинамический потенциал Гиббса G, называемый также свободной энергией при постоянном давлении, энтальпия Н и энтропия S.
Изменение термодинамического потенциала при каком-либо процессе равно максимально полезной работе:
∆G = –Aмакс.
Если эта максимально полезная работа совершается при электрохимическом процессе, то значение величины Амакс. позволяет рассчитать ЭДС – разность равновесных электродных потенциалов:
Aмакс. = – ∆G = z∙F∙E (18)
Изменение термодинамического потенциала при электрохимическом процессе равно сумме термодинамических потенциалов конечных веществ за вычетом суммы ∆G для исходных веществ реакции, записанной в направлении самопроизвольного протекания.
Зная величину термодинамического потенциала Гиббса, можно рассчитать значение теоретического напряжения разложения электролита
Еразл.= 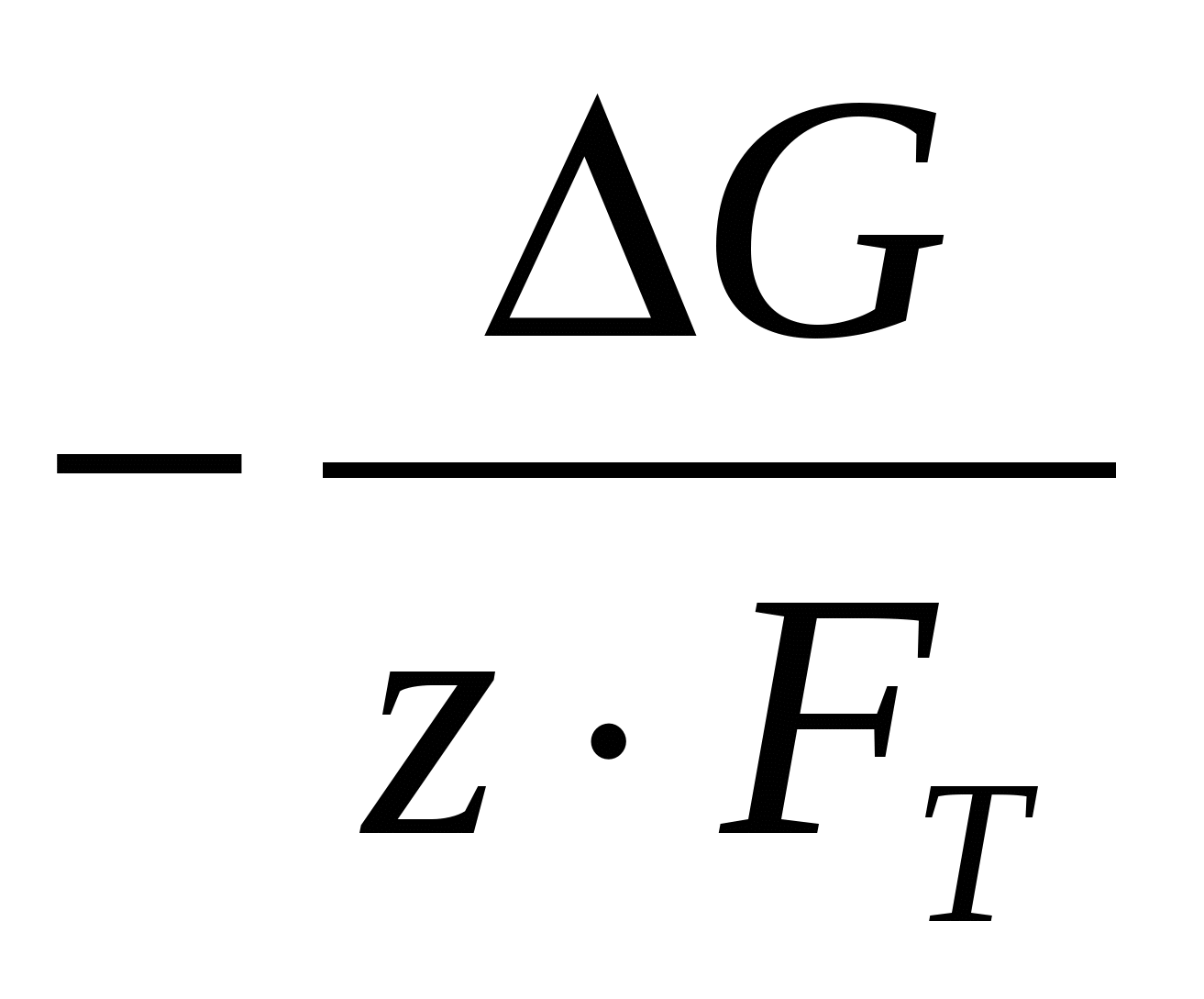 (19) (19)
где ∆G выражено в калориях на количество молей реагирующего вещества, а E – в вольтах;
FT = 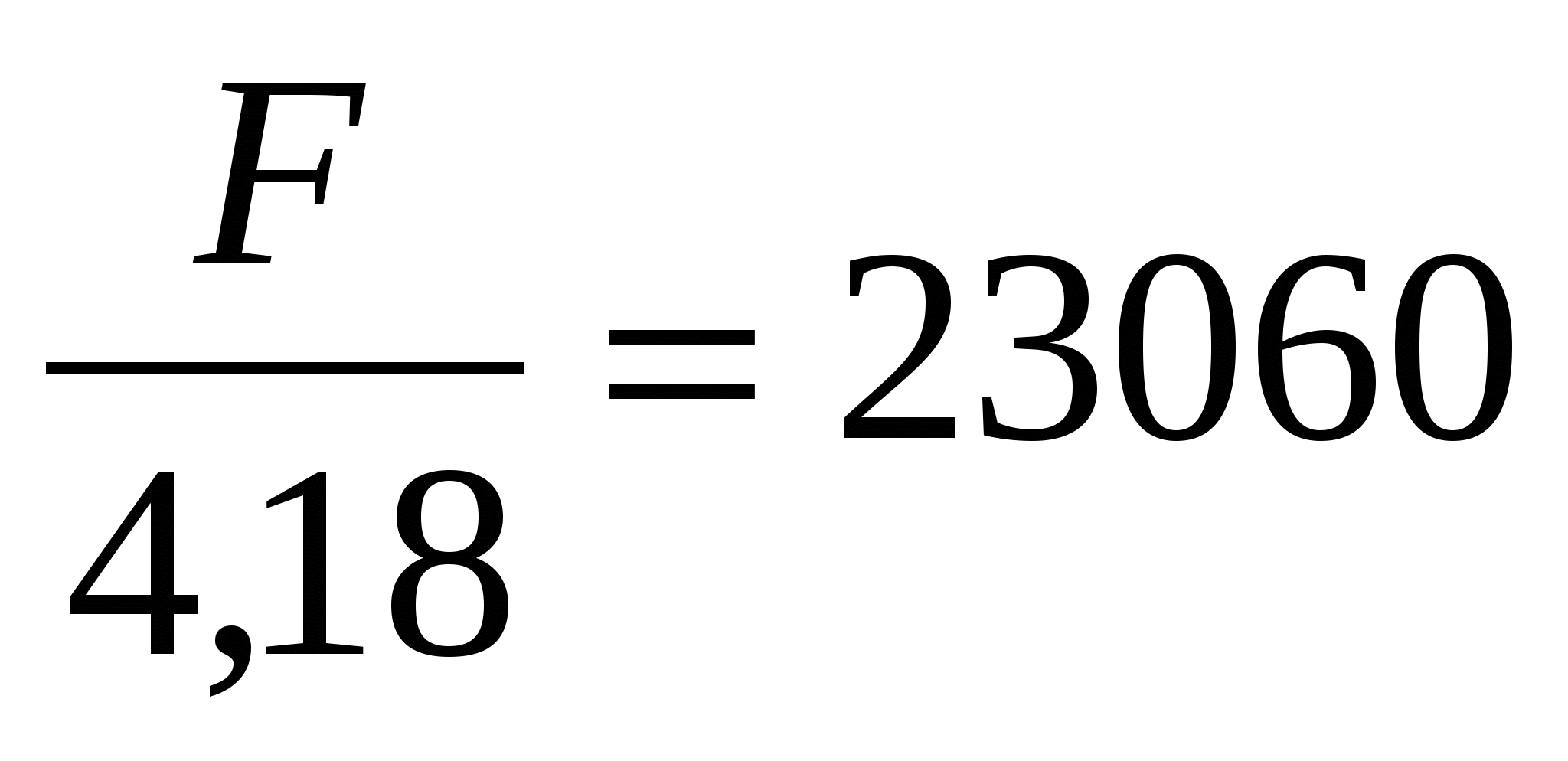 , (1 кал = 4,18 Дж) , (1 кал = 4,18 Дж)
Изменение энтальпии ∆Н при реакции численно равно тепловому эффекту реакции при постоянном давлении, отнесенному к количеству молей реагирующего вещества, 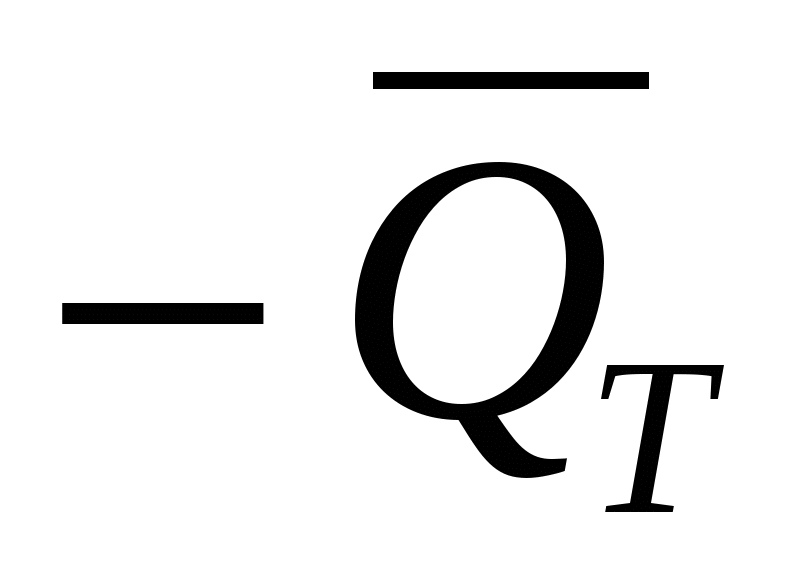 (взятому с обратным знаком): (взятому с обратным знаком):
∆Н = 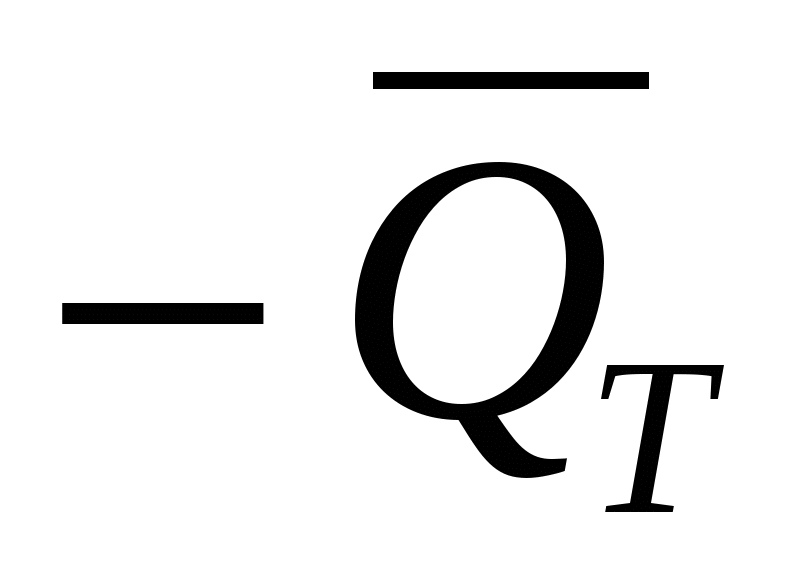 (20) (20)
Зная энтальпию отдельных соединений, участвующих в электрохимической реакции, можно определить ее тепловой эффект, использовав тот же принцип, который был применен выше для расчета изменения термодинамического потенциала при реакции
∆Н = ∑∆Нкон. – ∑∆Ннач. (21)
Критерием, позволяющим судить о направлении термодинамических процессов в изолированных системах, является энтропия S.
Для обратимого процесса все эти три термодинамические функции связаны между собой следующей зависимостью:
G = H – T∙S (22)
где Т – температура, К.
Согласно уравнению Гиббса – Гельмгольца
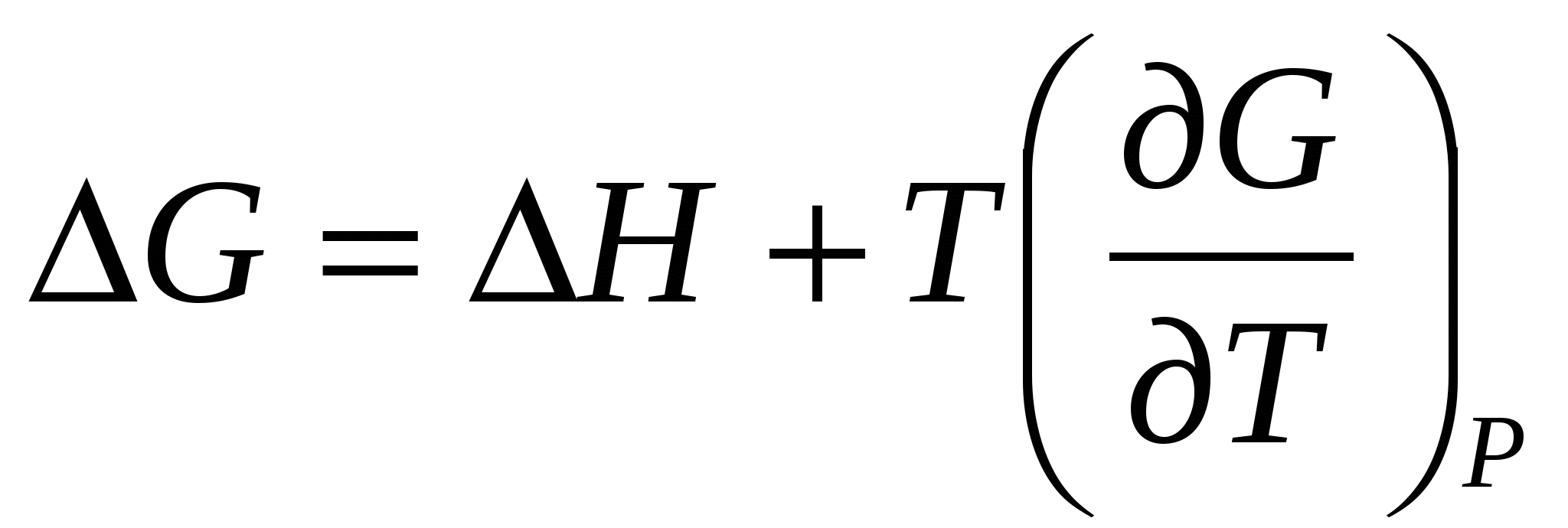 (23) (23)
Отсюда
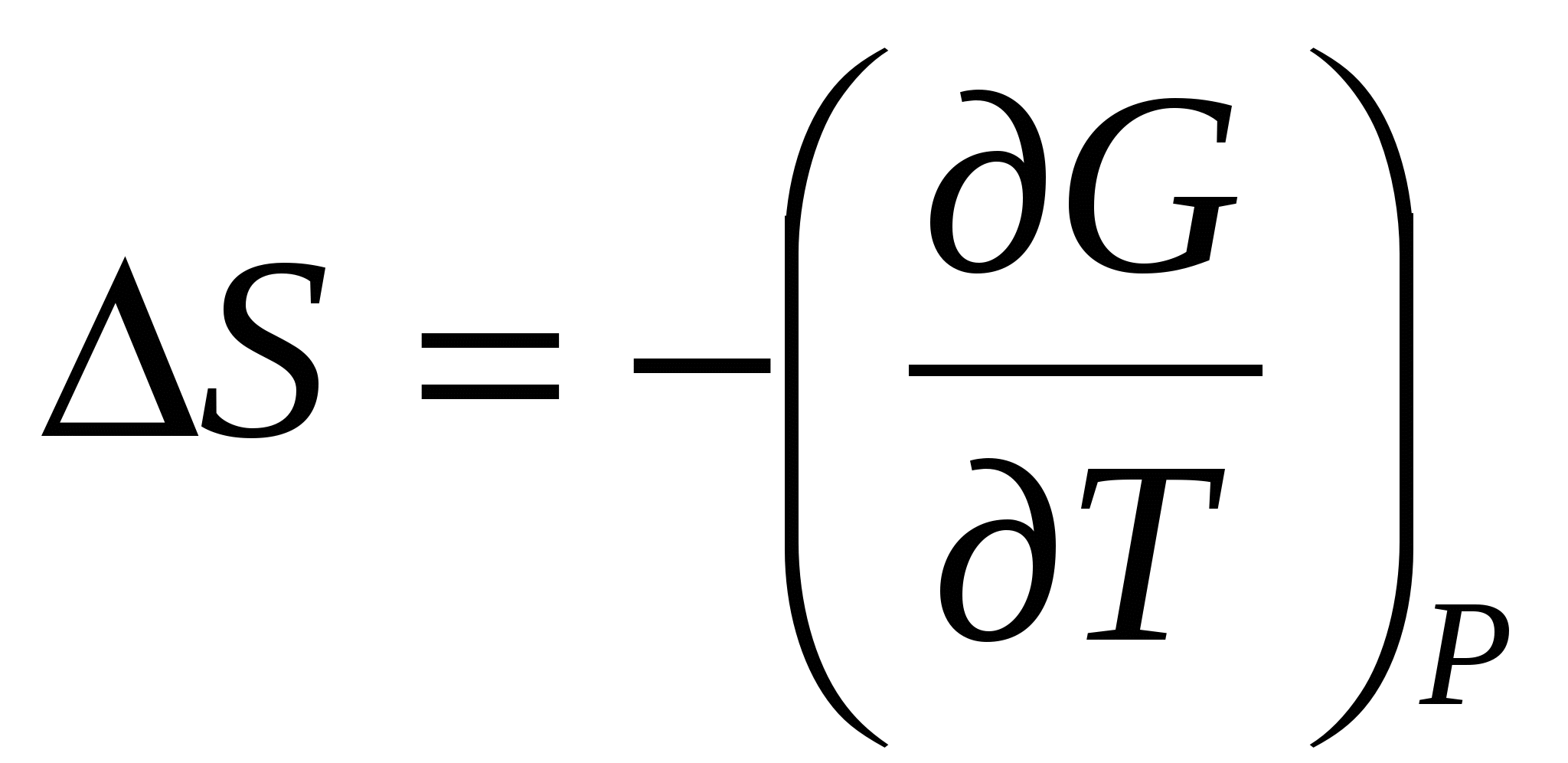 (24) (24)
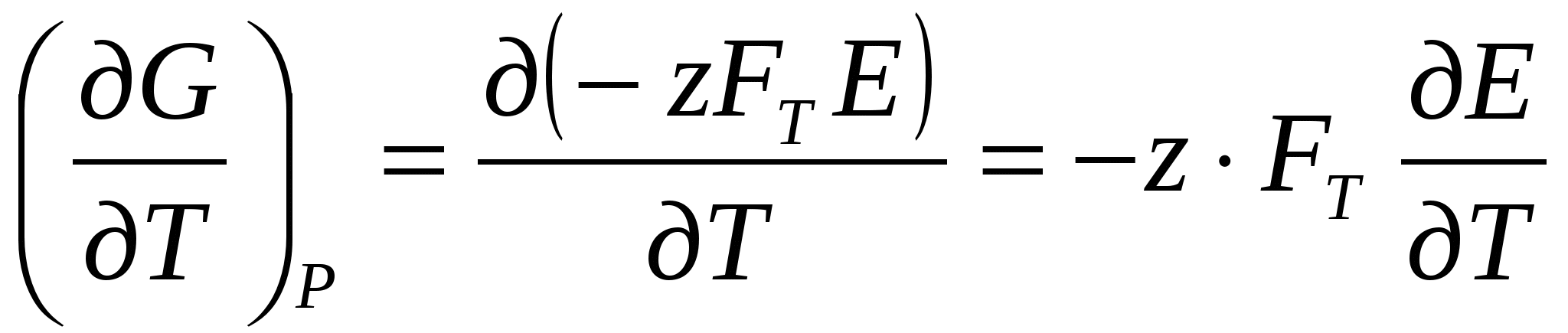 (25) (25)
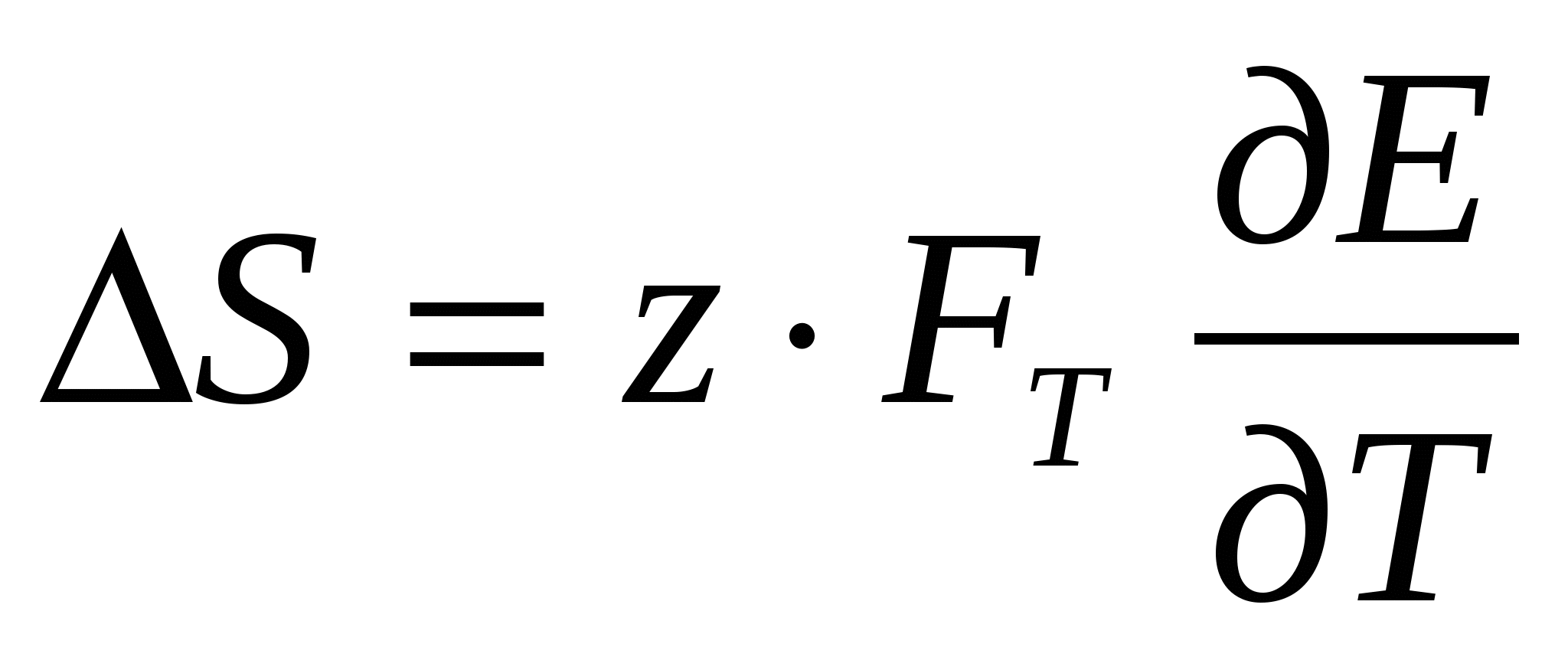 (26) (26)
Таким образом, зная ∆S при электрохимической реакции, можно определить температурный коэффициент ЭДС электрохимической системы (и наоборот):
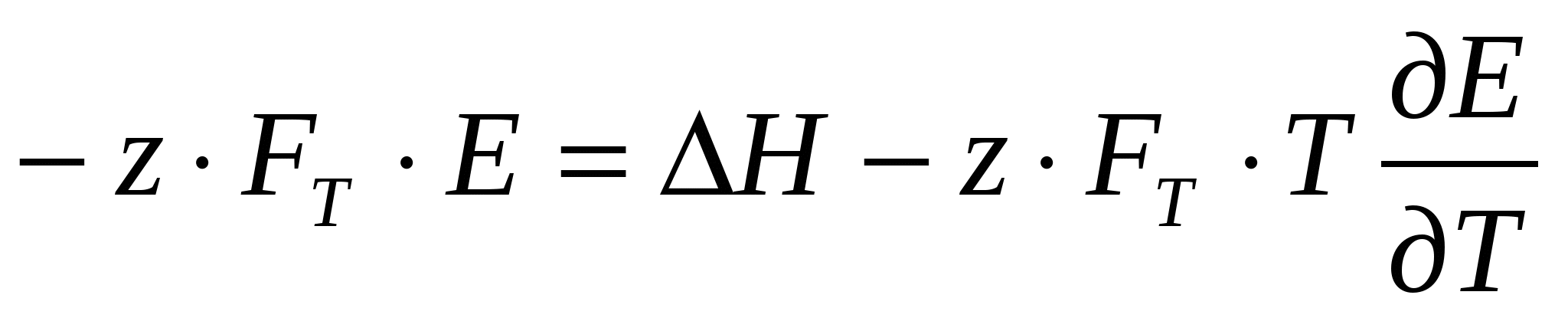 (27) (27)
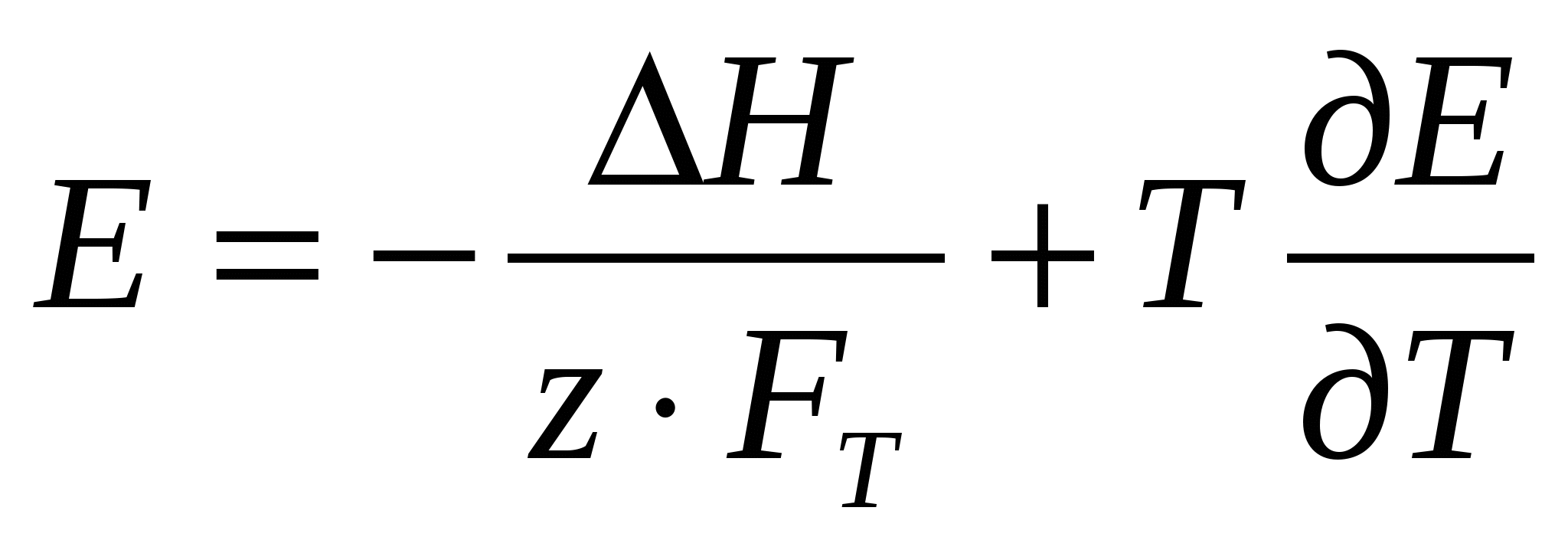 (28) (28)
Большинство электрохимических процессов должно протекать в узком температурном интервале, что может быть достигнуто только при высокой сбалансированности прихода и расхода тепла.
Составление теплового баланса для таких электрохимических систем предполагает прежде всего правильное определение количества тепла, выделяемого в электролизере при прохождении электрического тока.
Количество тепла QТ, выделяющееся при прохождении электрического тока («джоулево тепло»), равно
QT = 0,239 ∙ I∙V∙τ, кал (29)
где I – сила тока, А;
V – напряжение, В;
Τ – время, с.
Если τ выразить в часах, то уравнение (29) примет вид
QT = 0,239 ∙ 3600 ∙ I∙V∙τ = 860 ∙ I·V∙τ, кал (30)
В тепло может переходить не все количество затраченной электроэнергии, а только часть её, за вычетом энергии, пошедшей на химическое превращение в системе:
QT = 0,239 ∙ I∙V∙τ 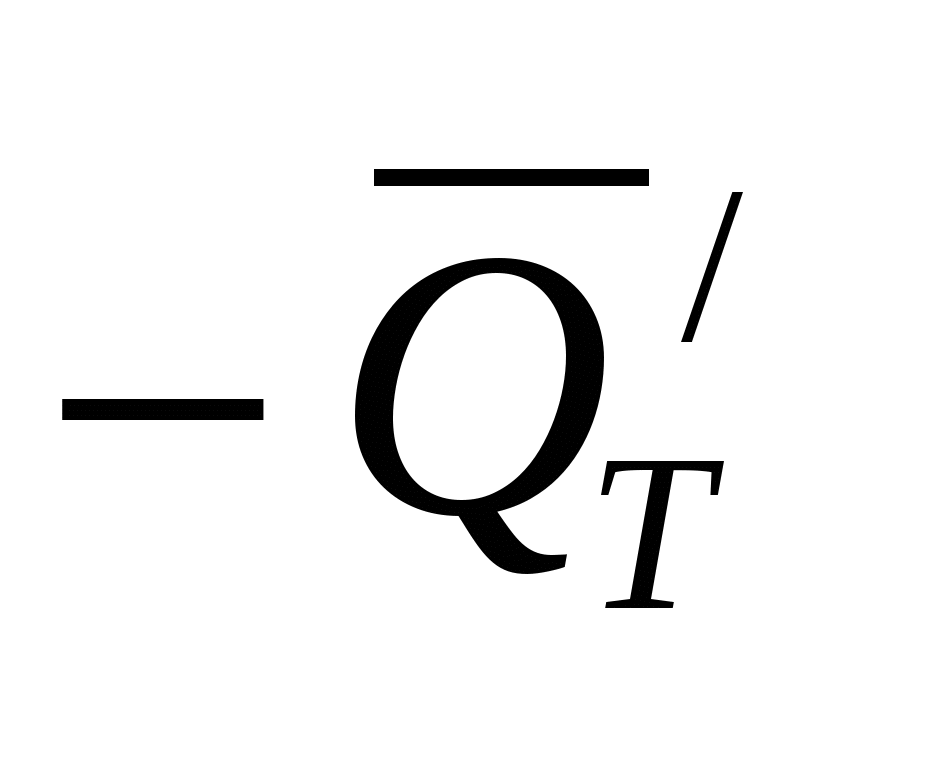 (31) (31)
где 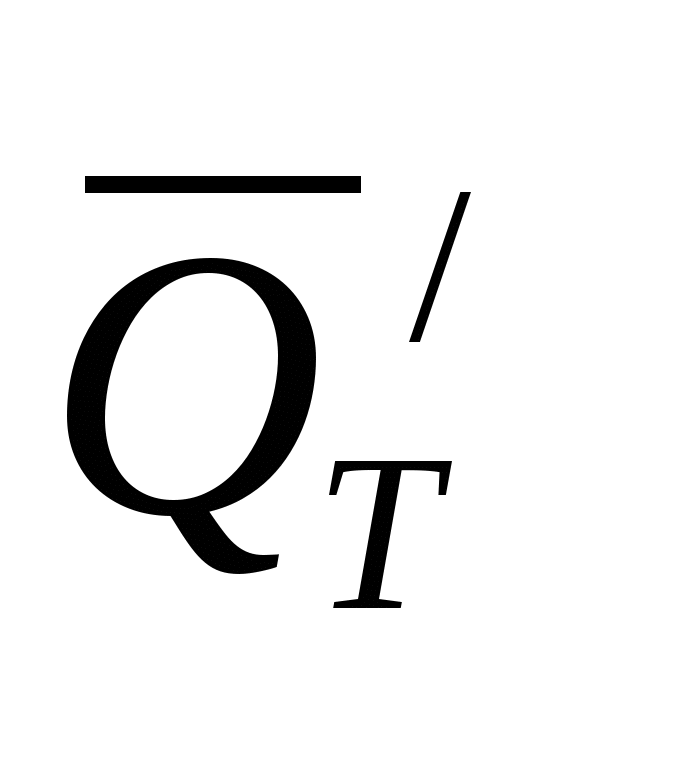 - тепловой эффект химического процесса (процессов), отнесенный к количеству веществ, реагирующих в электролизере при прохождении тока I в течение времени τ. - тепловой эффект химического процесса (процессов), отнесенный к количеству веществ, реагирующих в электролизере при прохождении тока I в течение времени τ.
Если в системе идет один химический процесс при ВТ=100%, то
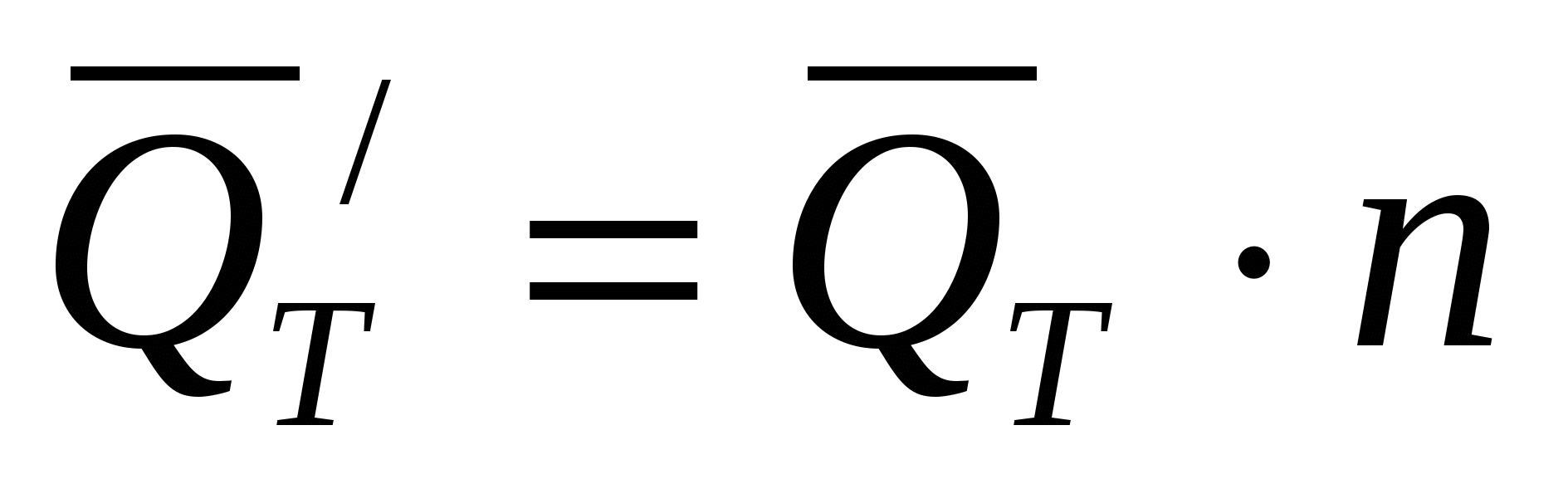 (32) (32)
где 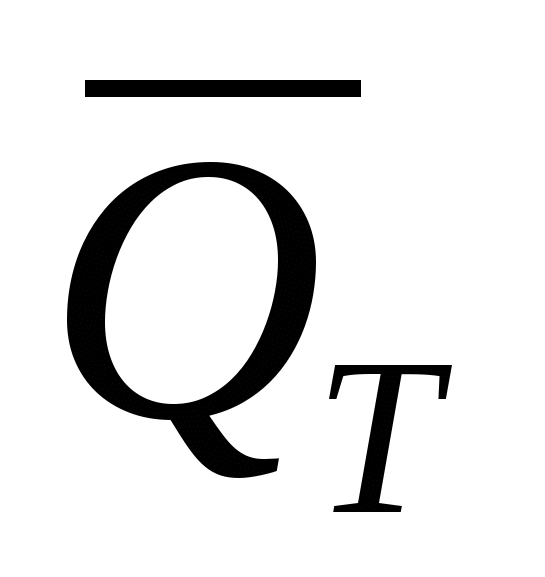 - тепловой эффект реакции, кал/моль; - тепловой эффект реакции, кал/моль;
n - число реагирующих молей вещества:
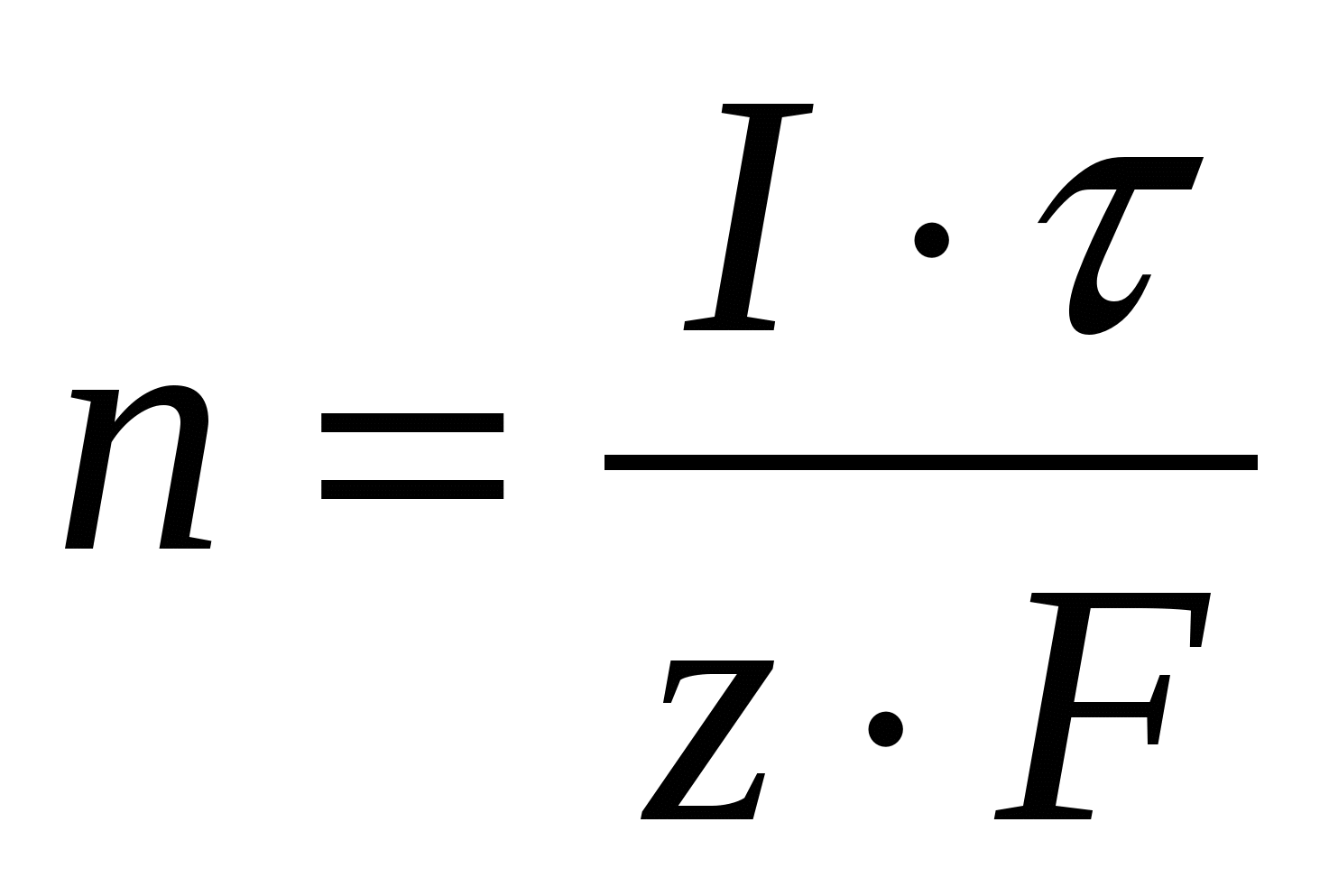 (33) (33)
Отсюда,
 (34) (34)
Подставляя последнее выражение в уравнение (31), проведя соответствующие преобразования, получим
QT = 0,239 ∙ I∙V∙τ – 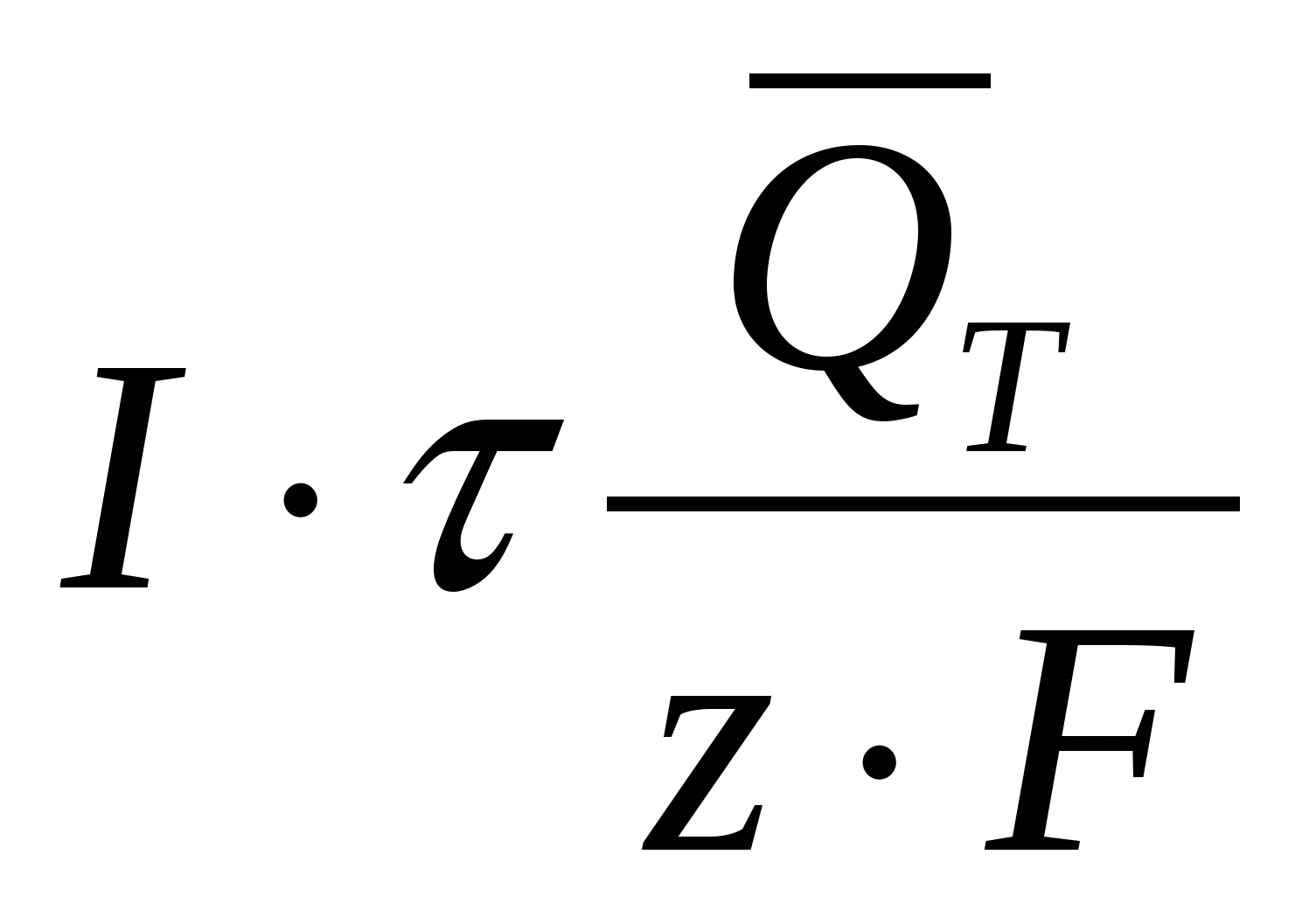 = =
=0,239 ∙ I ∙τ 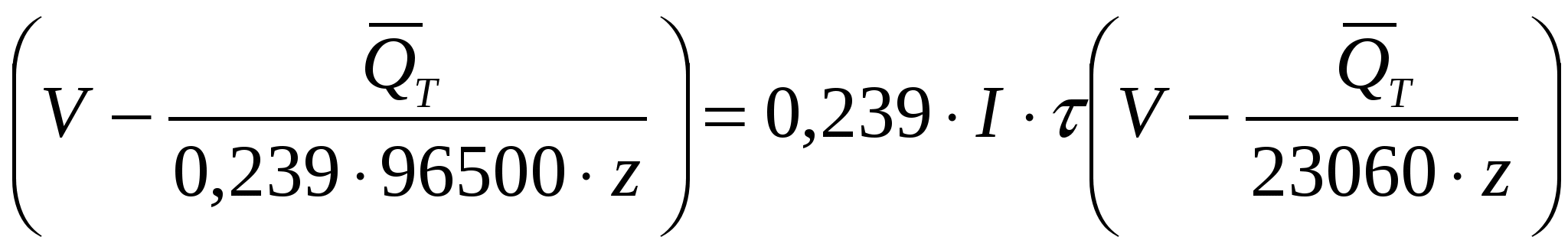 , кал (35) , кал (35)
Выразив QT и 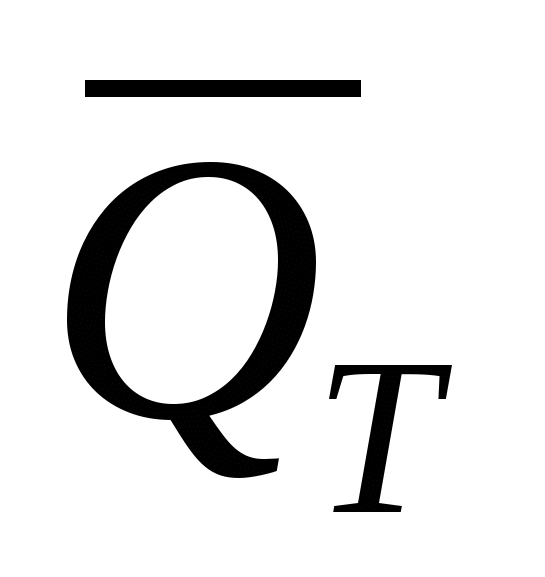 соответственно в килокалориях и килокалориях на моль, а τ – в часах, получим соответственно в килокалориях и килокалориях на моль, а τ – в часах, получим
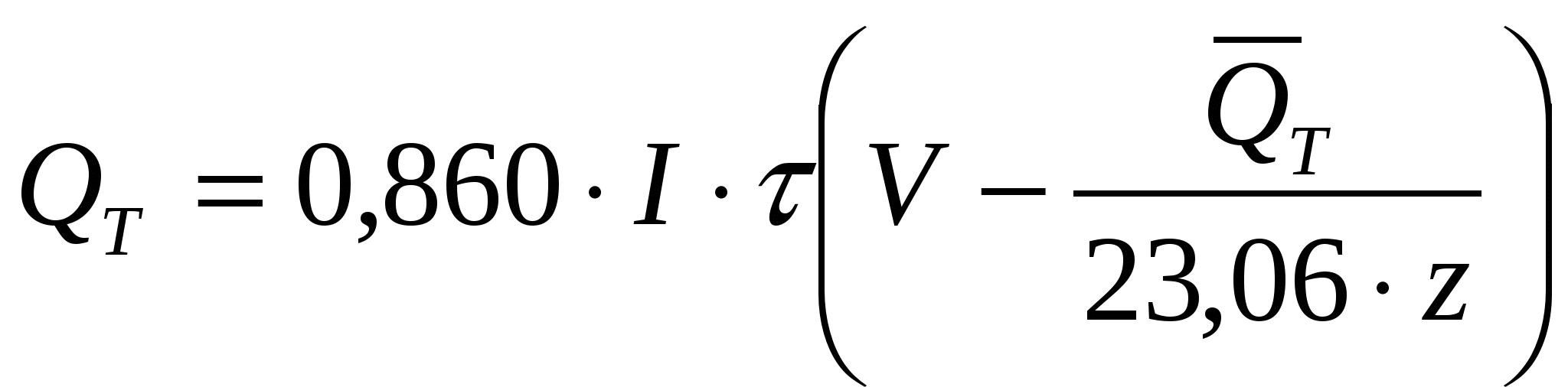 , ккал (36) , ккал (36)
Если снижение ВТ не обусловлено параллельным протеканием какого-либо другого электрохимического процесса, а вызвано взаимодействием катодных и анодных продуктов или реагированием их на электродах другой полярности с образованием исходных веществ, то
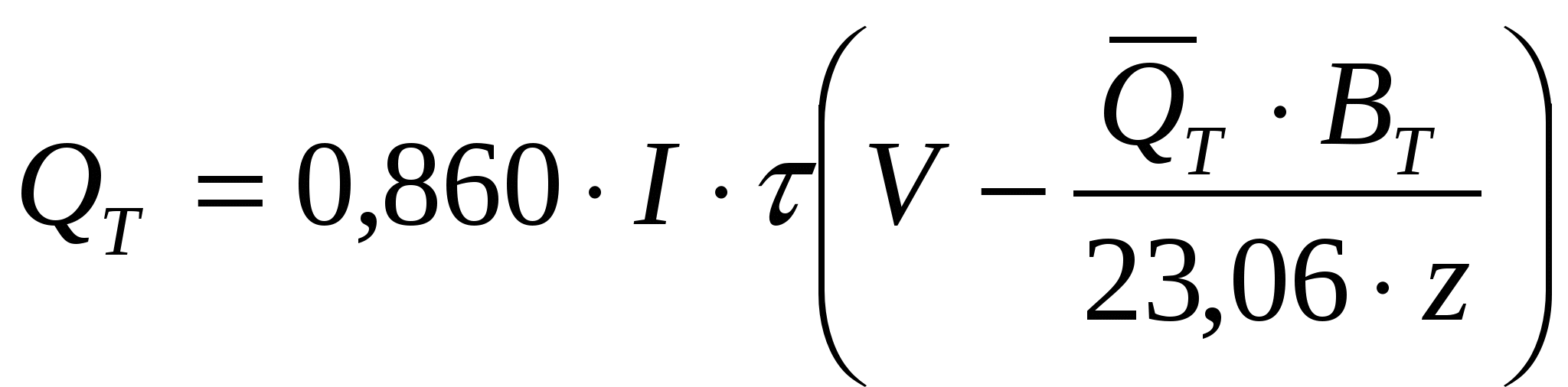 , ккал, (37) , ккал, (37)
где ВТ выражен в долях единицы.
Если в системе протекает несколько параллельных электрохимических процессов, то необходимо учитывать затраты энергии, идущие на все эти процессы:
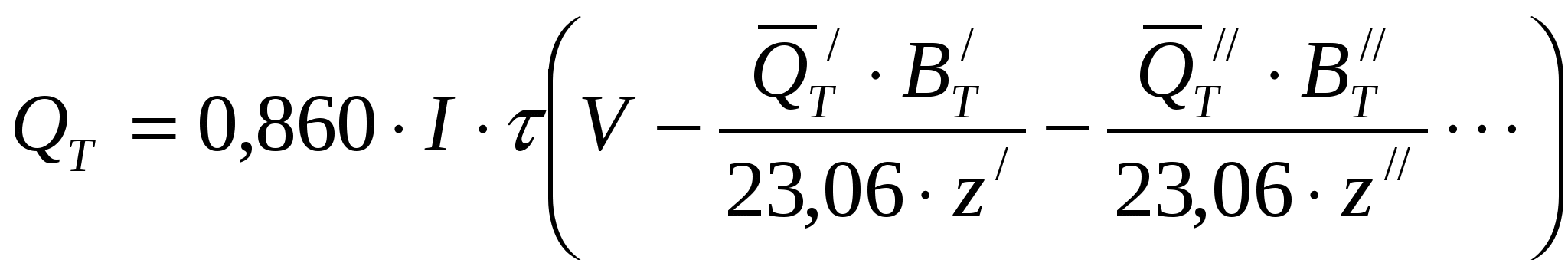 , ккал (38) , ккал (38)
где 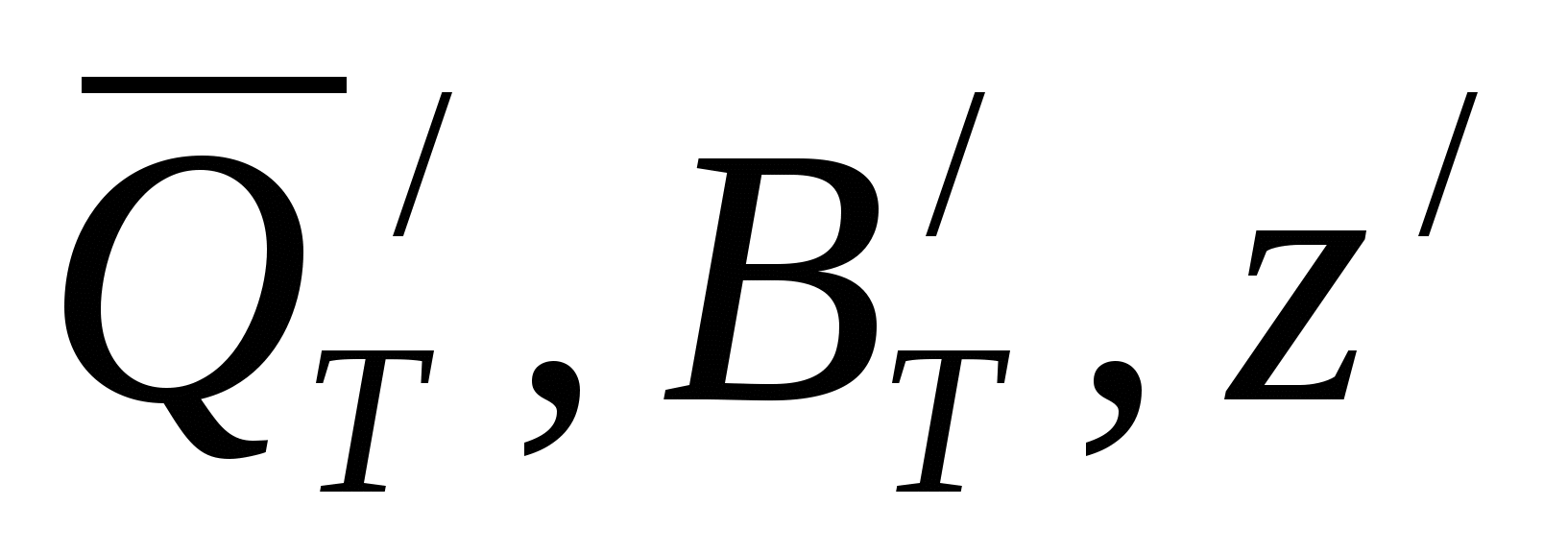 относятся к одному электрохимическому процессу; относятся к одному электрохимическому процессу; 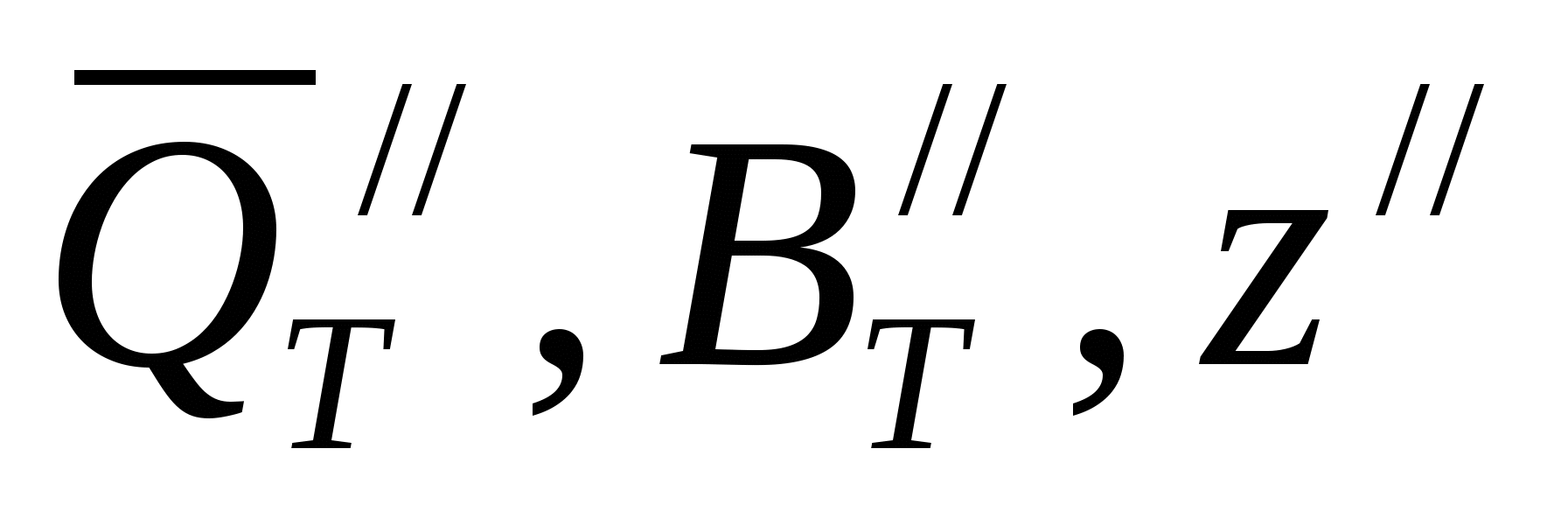 - к другому. - к другому.
Вместо теплового эффекта реакции в уравнение можно подставить численно равную ему величину расчетного изменения энтальпии ∆Н.
Если ввести понятие теплового напряжения разложения ЕТ:
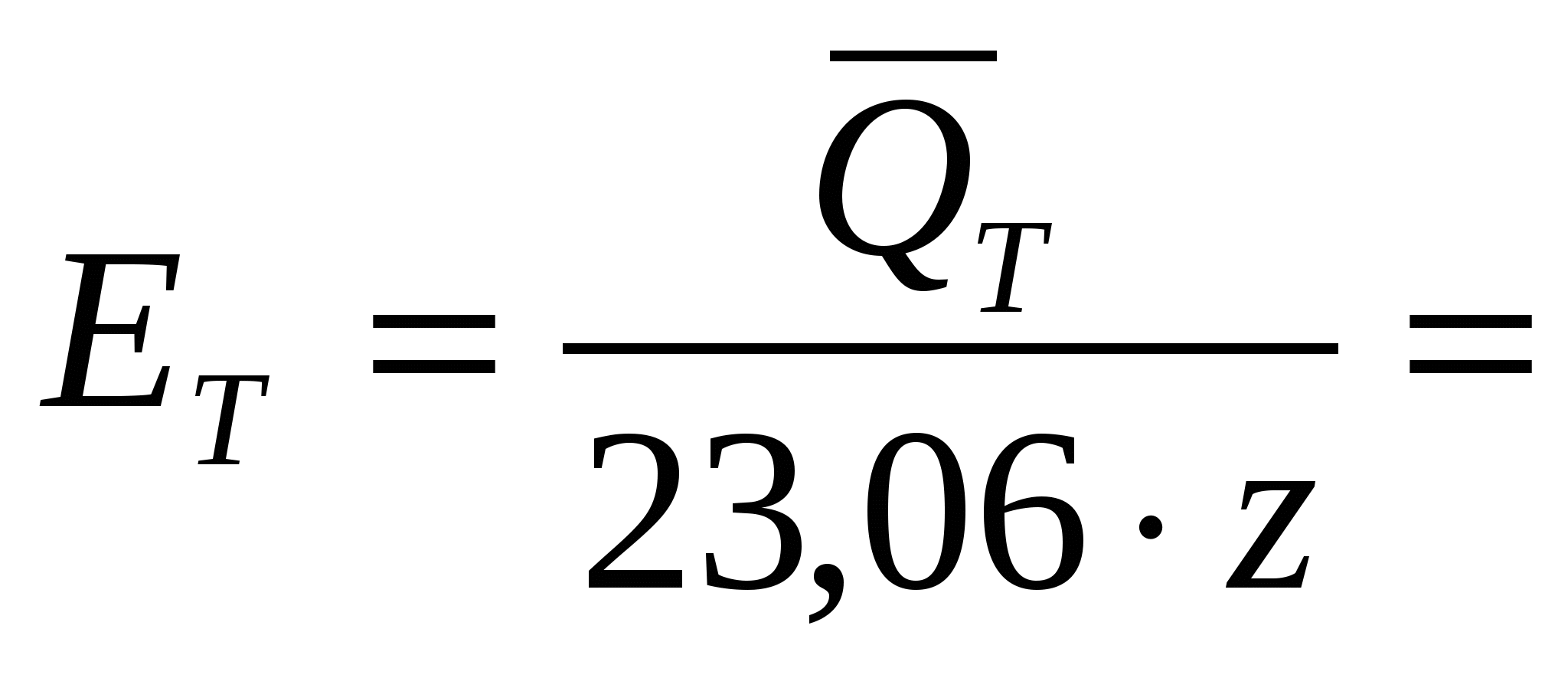 – –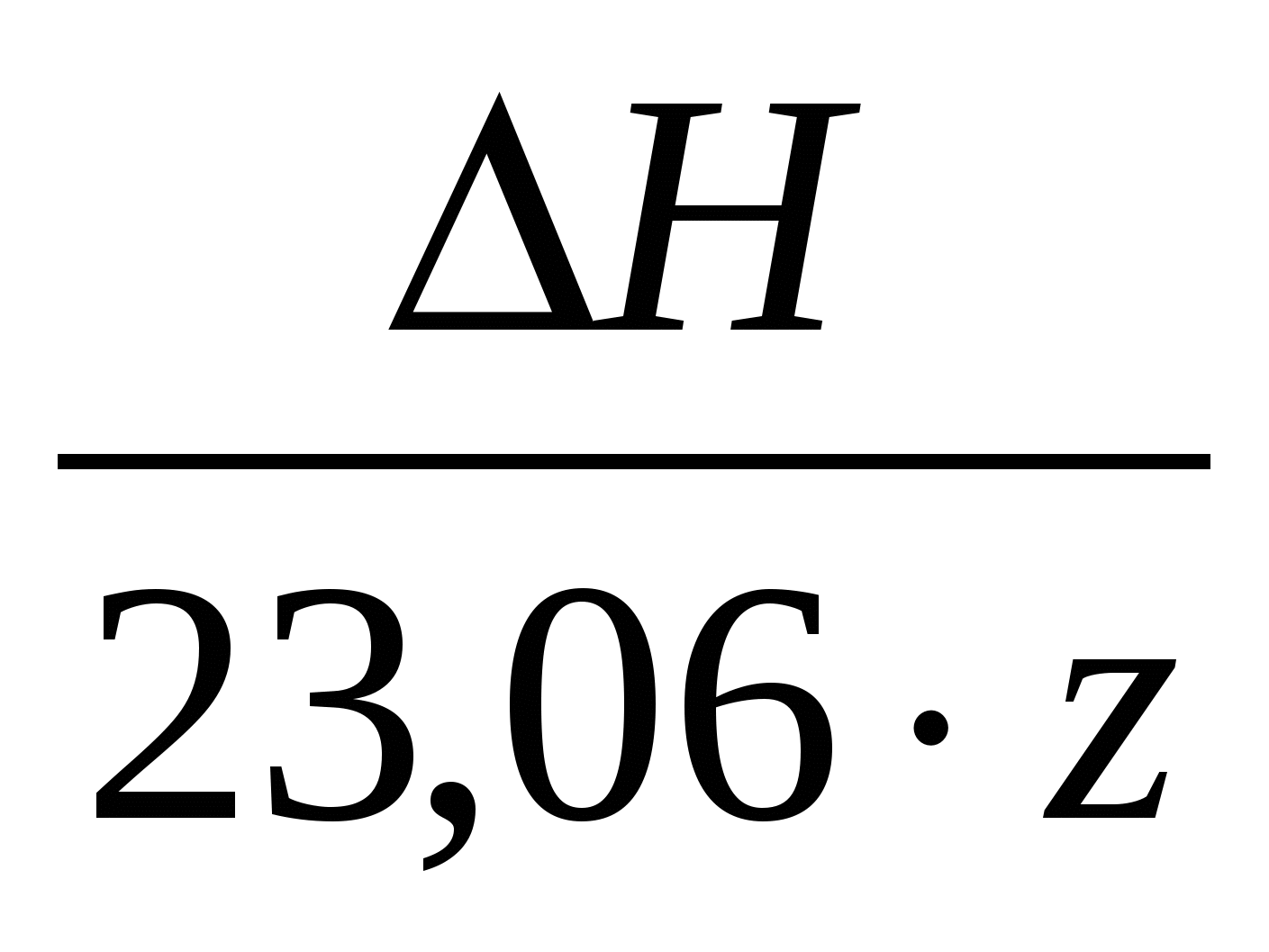 , В (39) , В (39)
тогда выражение (38) можно представить:
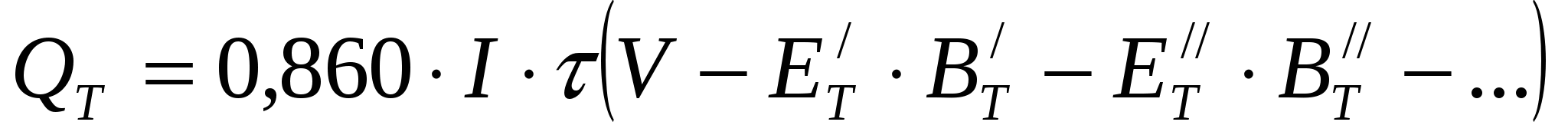 , ккал (40) , ккал (40)
2 Примеры основных расчетов
Пример 1. Электролитические ванны рафинирования меди нагрузкой I =10 кA эксплуатируются при электродной плотности тока D = 200 А/м², tЭ =50 °С и катодном выходе по току ВТ = 96%. Зеркало поверхности раствора в ванне S = 4,2м², скорость циркуляции электролита υЭ = 20 л/мин на одну ванну; межэлектродное расстояние l=5,0 см. Электродная поляризация и падение напряжения в электродах ∆V1 = 80 мВ. Удельное сопротивление электролита ρ50 = 1,815Ом∙см; c = 0,855 ккал/кг∙°С; d = 1,23 г/см³.
Количество воды, испаряющейся с 1м2 поверхности электролита, 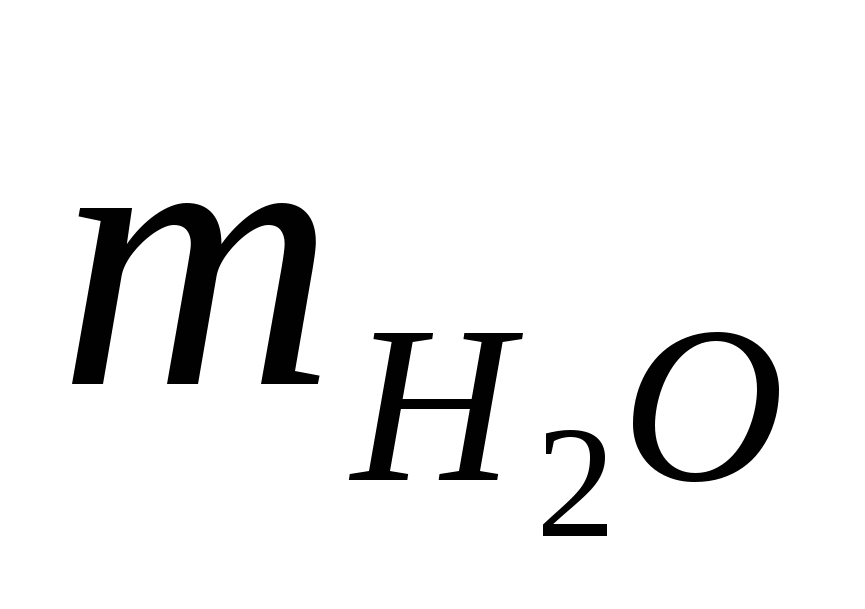 = 1.90 кг/ч (теплота преобразования = 1.90 кг/ч (теплота преобразования 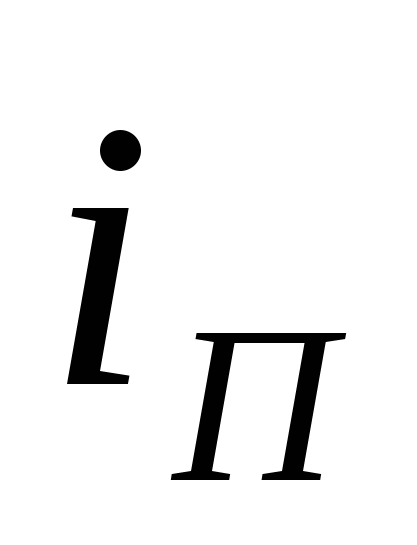 =568ккал/кг). Доля потерь тепла за счет испарения воды составляет 60% от общих потерь тепла ванной (без учета тепла, уносимого циркулирующим электролитом). Для подогрева электролита (осуществляемого вне ванны) применяется сухой пар с полным теплосодержанием =568ккал/кг). Доля потерь тепла за счет испарения воды составляет 60% от общих потерь тепла ванной (без учета тепла, уносимого циркулирующим электролитом). Для подогрева электролита (осуществляемого вне ванны) применяется сухой пар с полным теплосодержанием  =645ккал/кг; образующийся конденсат обладает теплосодержанием ik = 70 ккал/кг. =645ккал/кг; образующийся конденсат обладает теплосодержанием ik = 70 ккал/кг.
Рассчитать расходные коэффициенты на 1 т катодной меди:
а) электроэнергии постоянного тока;
б) пара на подогрев циркулирующего электролита;
в) воды на компенсацию испарения из ванны.
Решение:
-
Количество катодной меди, получаемой в ванне за 1ч,
g 1 =I · τ · qCu · ВТ 1 =I · τ · qCu · ВТ
g1 = 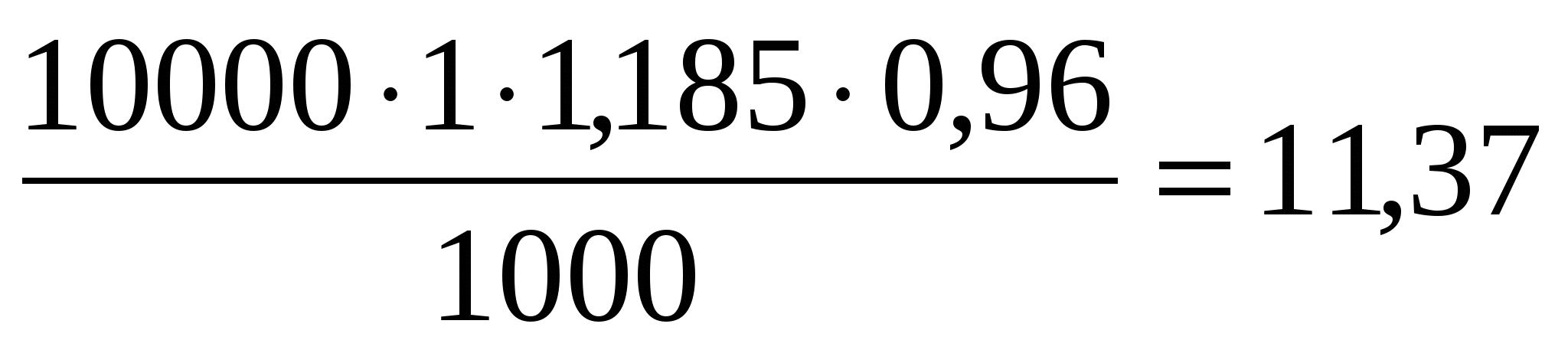 кг/час кг/час
2) Напряжение на электродах ванны рафинирования
V=I∙RОМ +∆V1=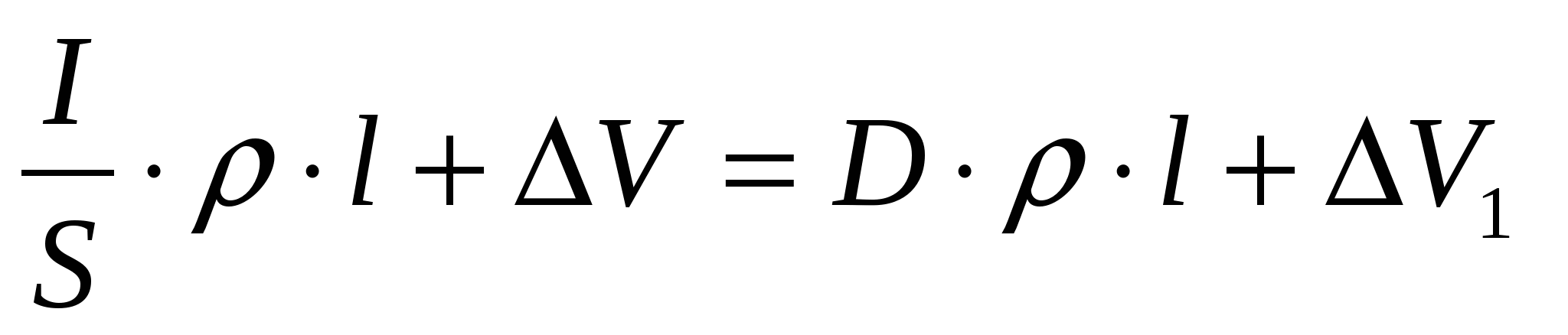
V = 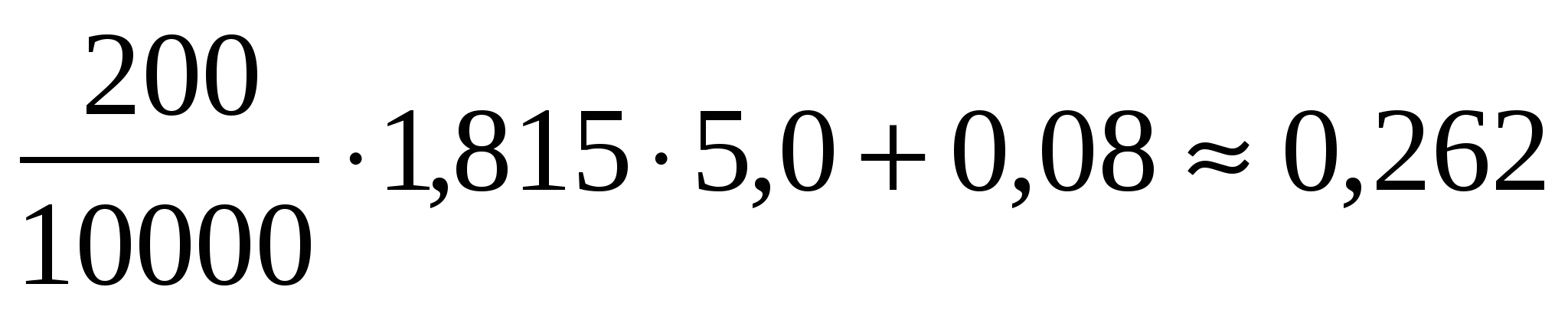 В В
(напряжение разложения в процессах рафинирования равно нулю)
-
Удельный расход электроэнергии на 1т меди
Wg =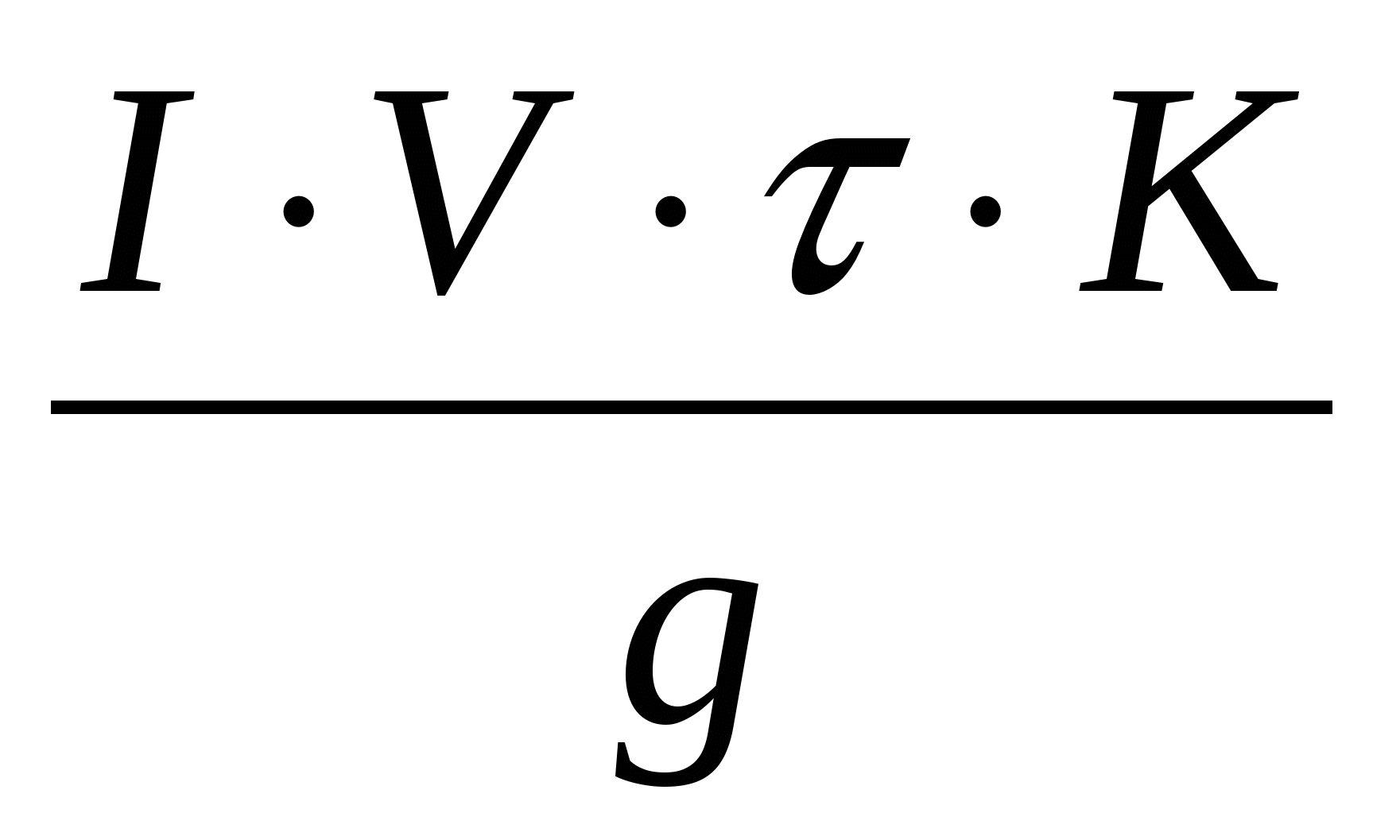
Wg = 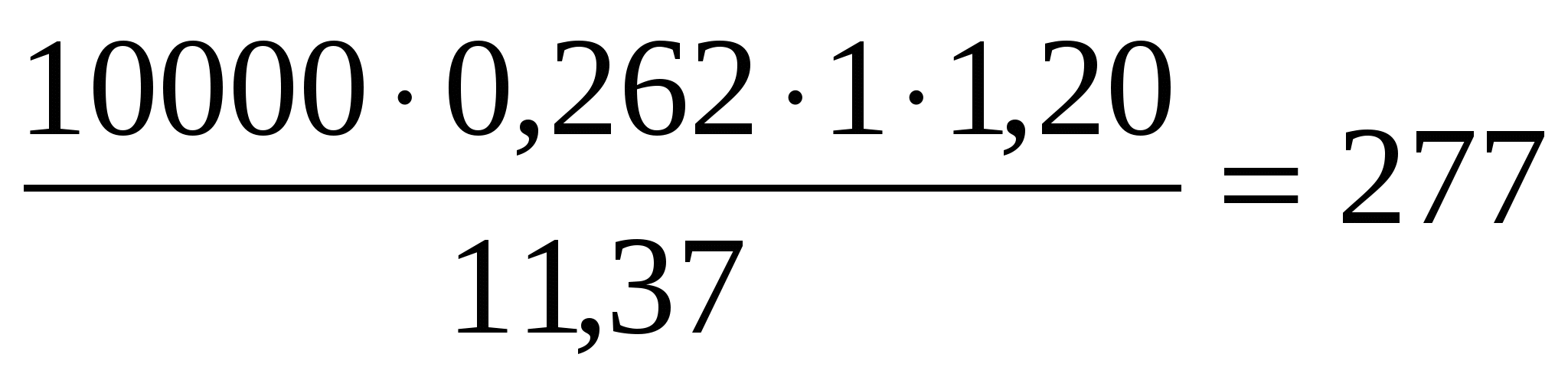 кВт·час/т кВт·час/т
где К = 1,20 – коэффициент, учитывающий потери напряжения в контактах, шинопроводах и повышенное напряжение в ваннах регенерации электролита.
-
Удельные потери воды за счет испарения из ванны
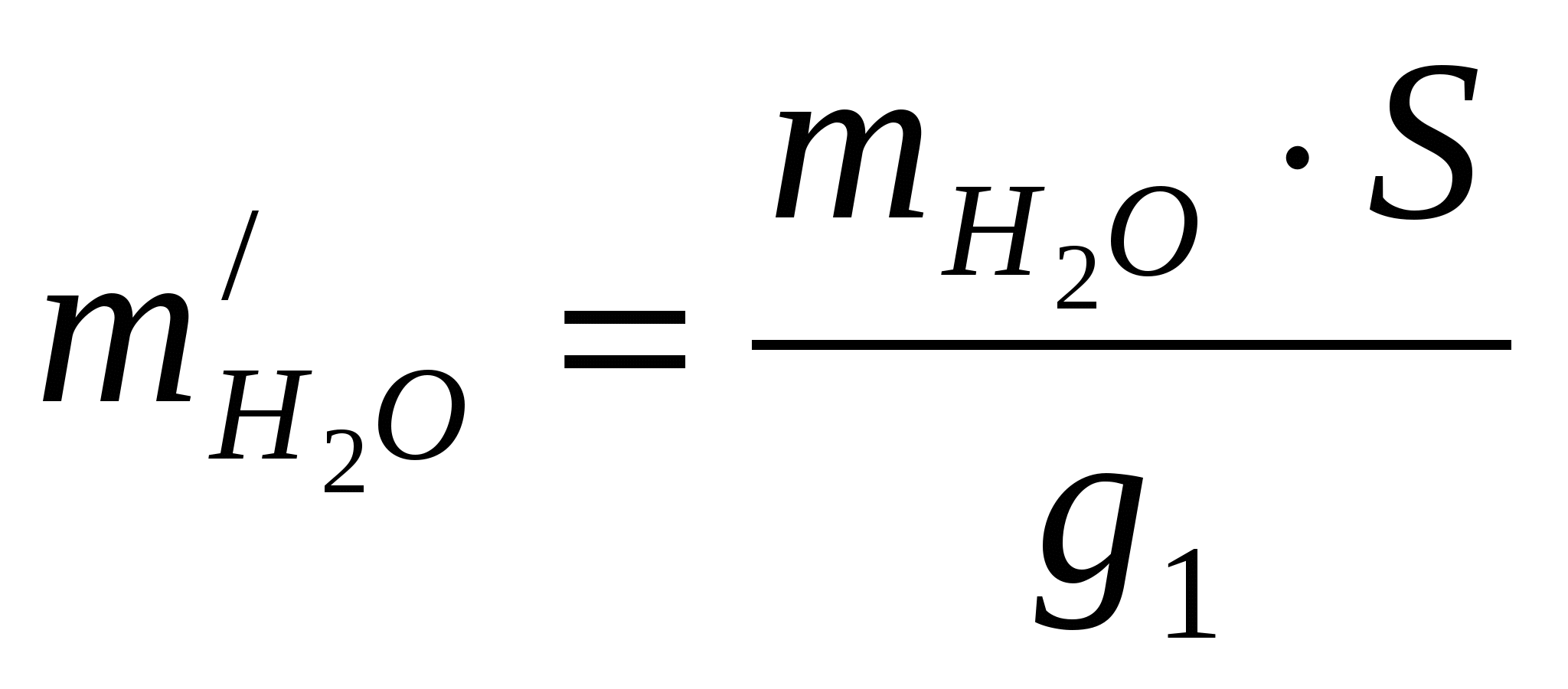
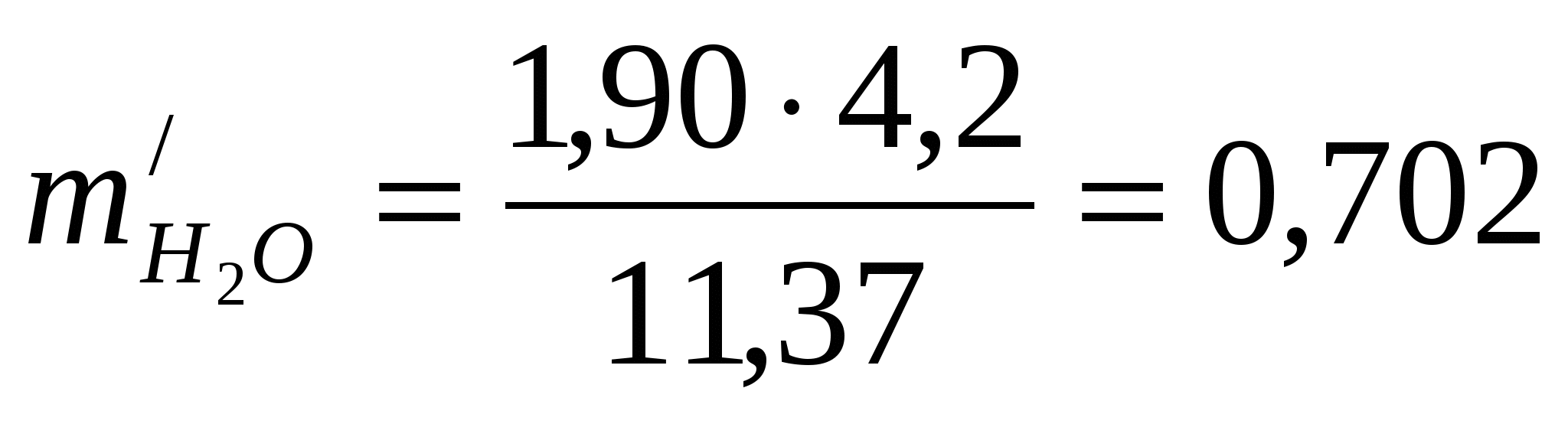 м3/т меди м3/т меди
-
Количество джоулева тепла, выделяющегося за 1ч в ванне,
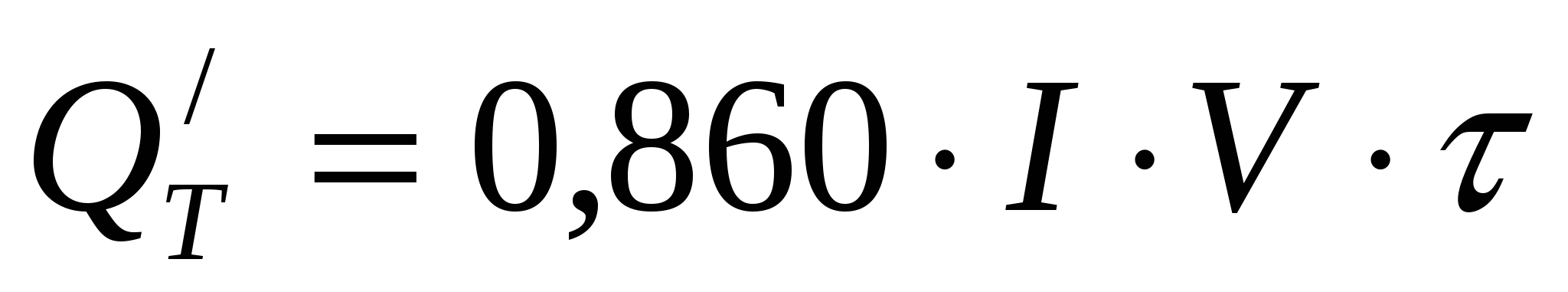
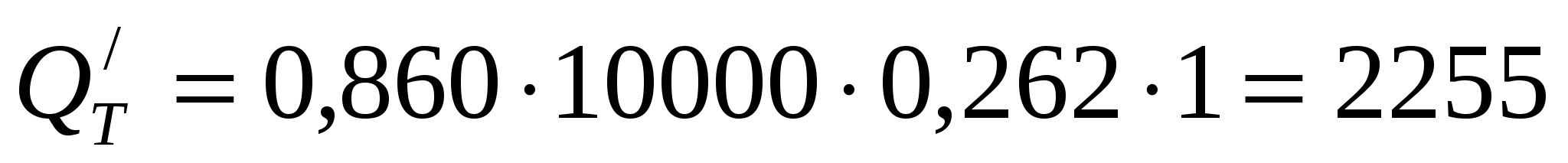 ккал/час ккал/час
(предполагаем, что снижение ВТ полностью обусловлено межэлектродными замыканиями).
-
Часовая потеря тепла из ванны в окружающую среду (по условию 60% потерь тепла составляют его потери за счет испарения воды)
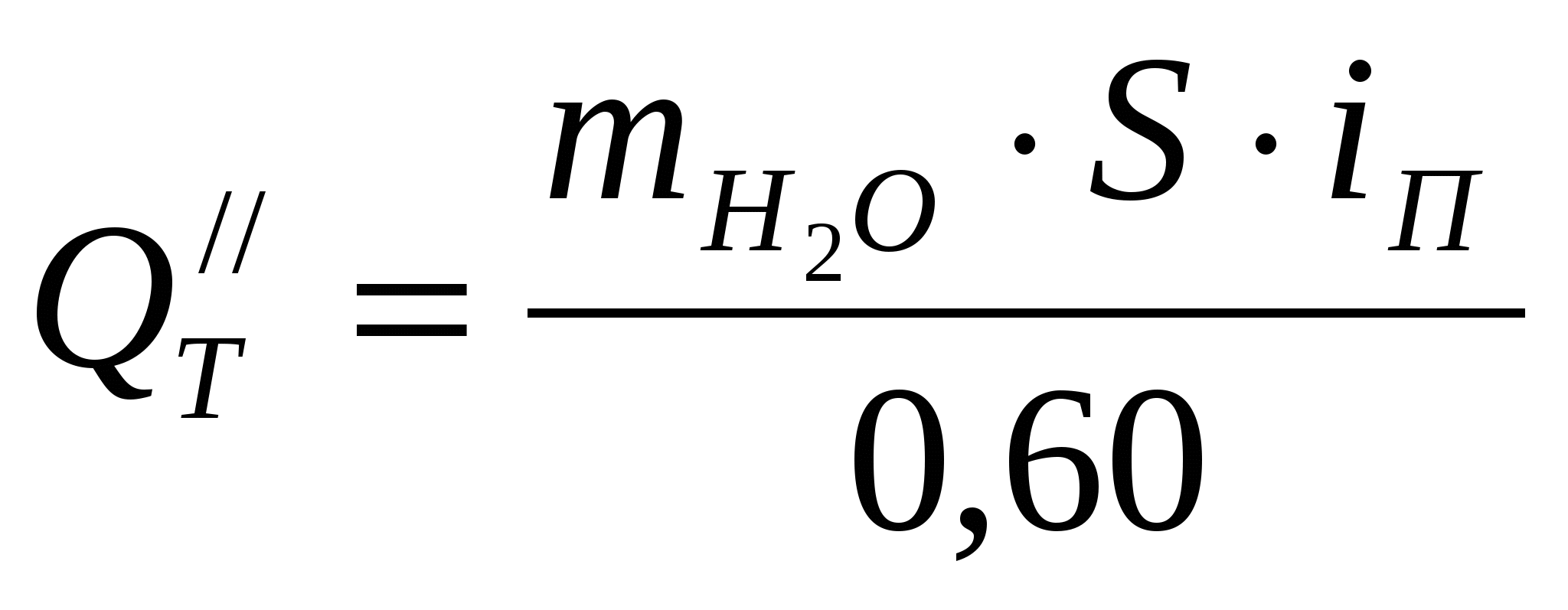
 ккал/час ккал/час
-
Потери тепла из ванны компенсируются джоулевым теплом и повышенной температурой электролита, поступающего в ванну при циркуляции. Потери тепла, которые необходимо скомпенсировать повышенной температурой подаваемого электролита,
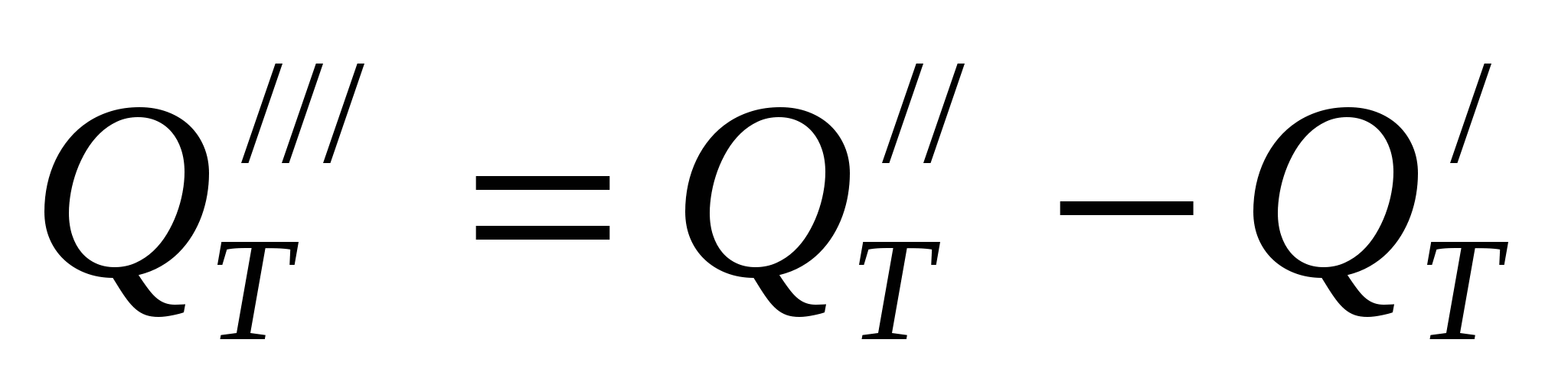
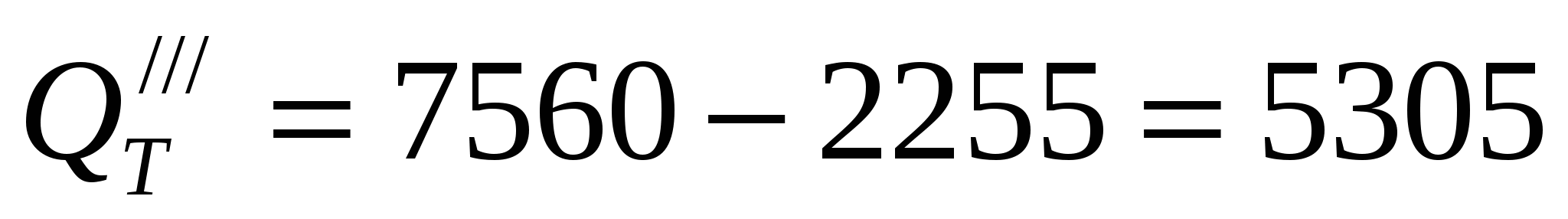 ккал/час ккал/час
-
Количество электролита, поступающего в ванну,
 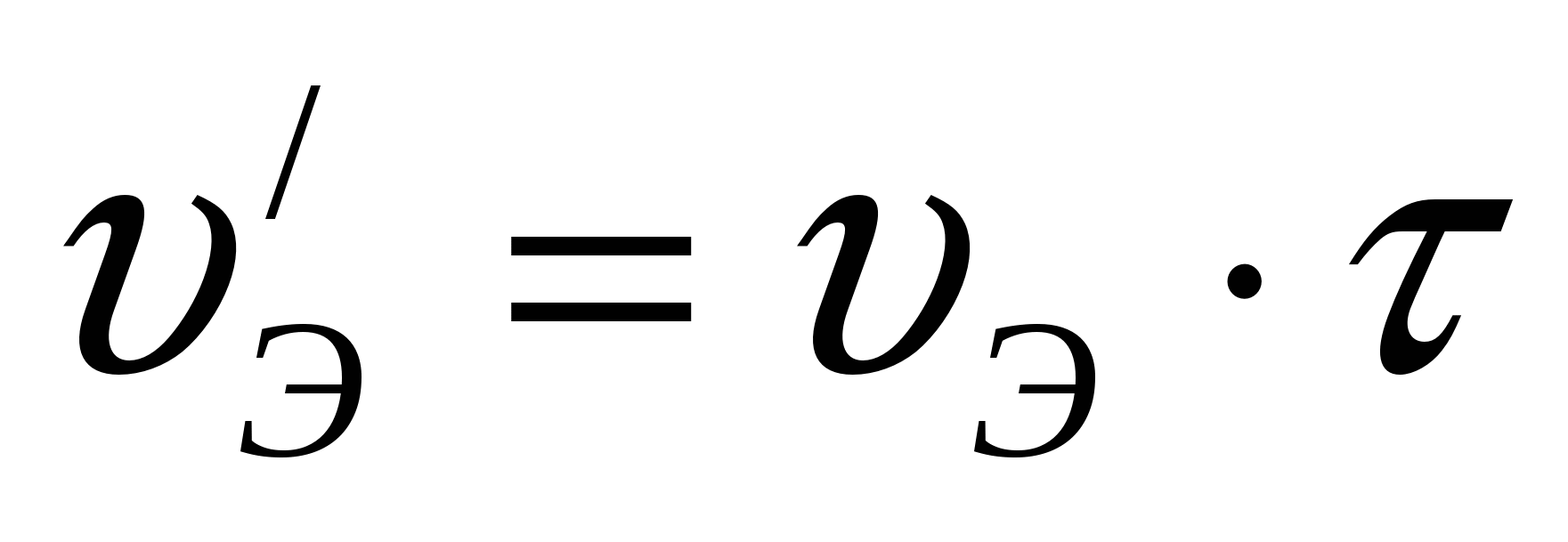
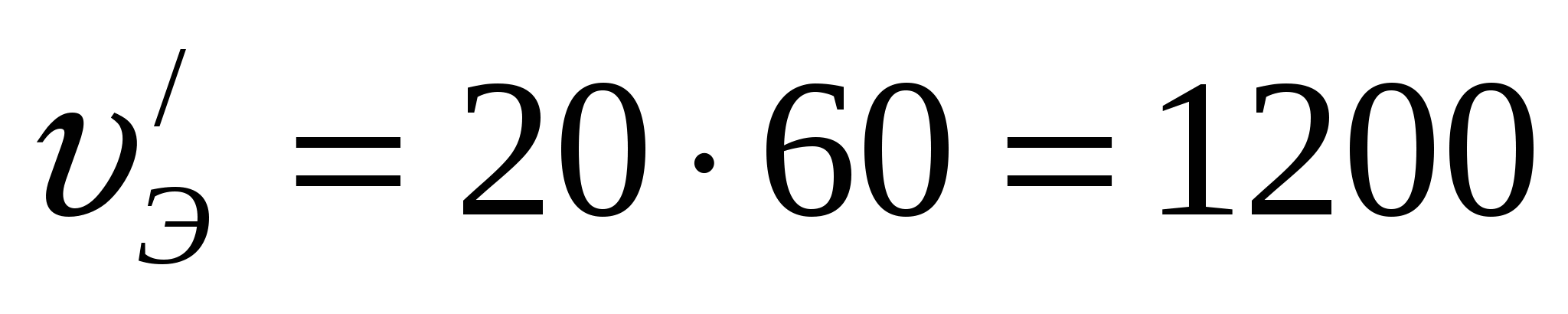 л/час л/час
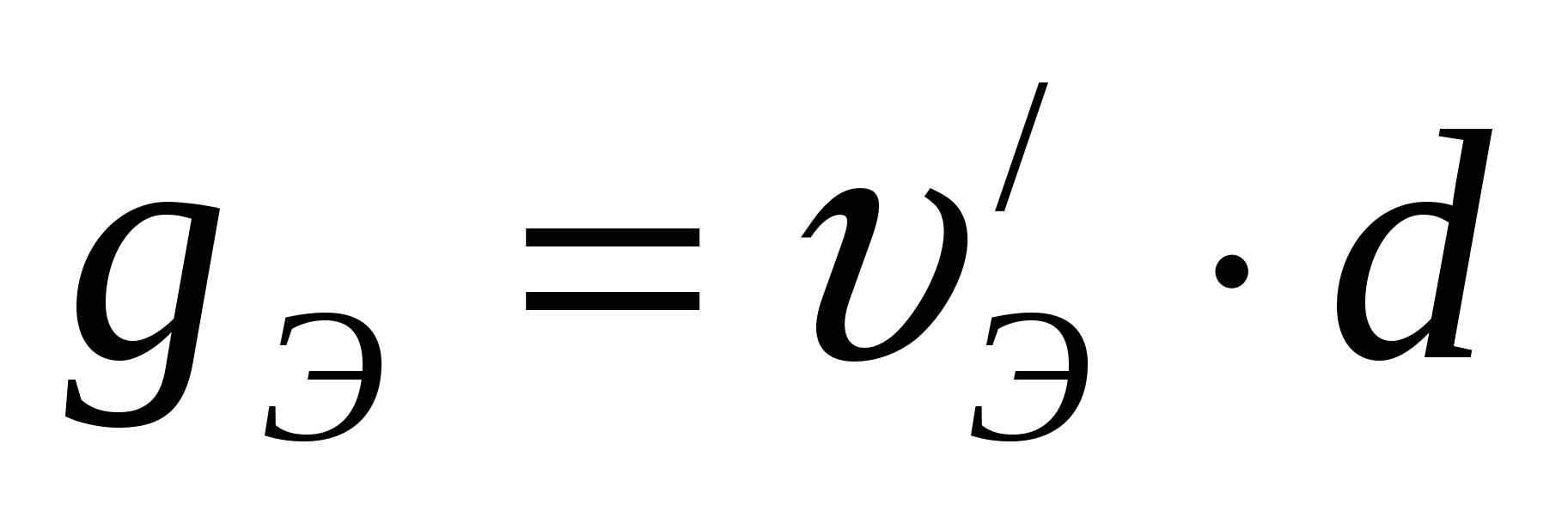
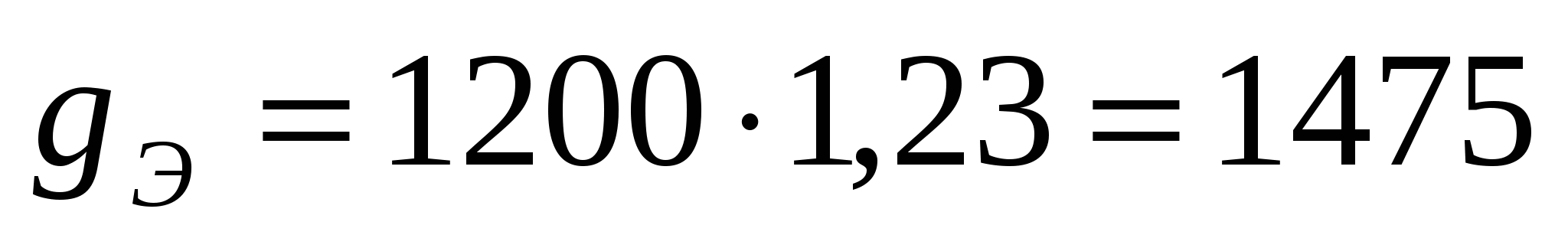 кг/час кг/час
-
Необходимая разница температур между поступающим раствором и электролитом ванны
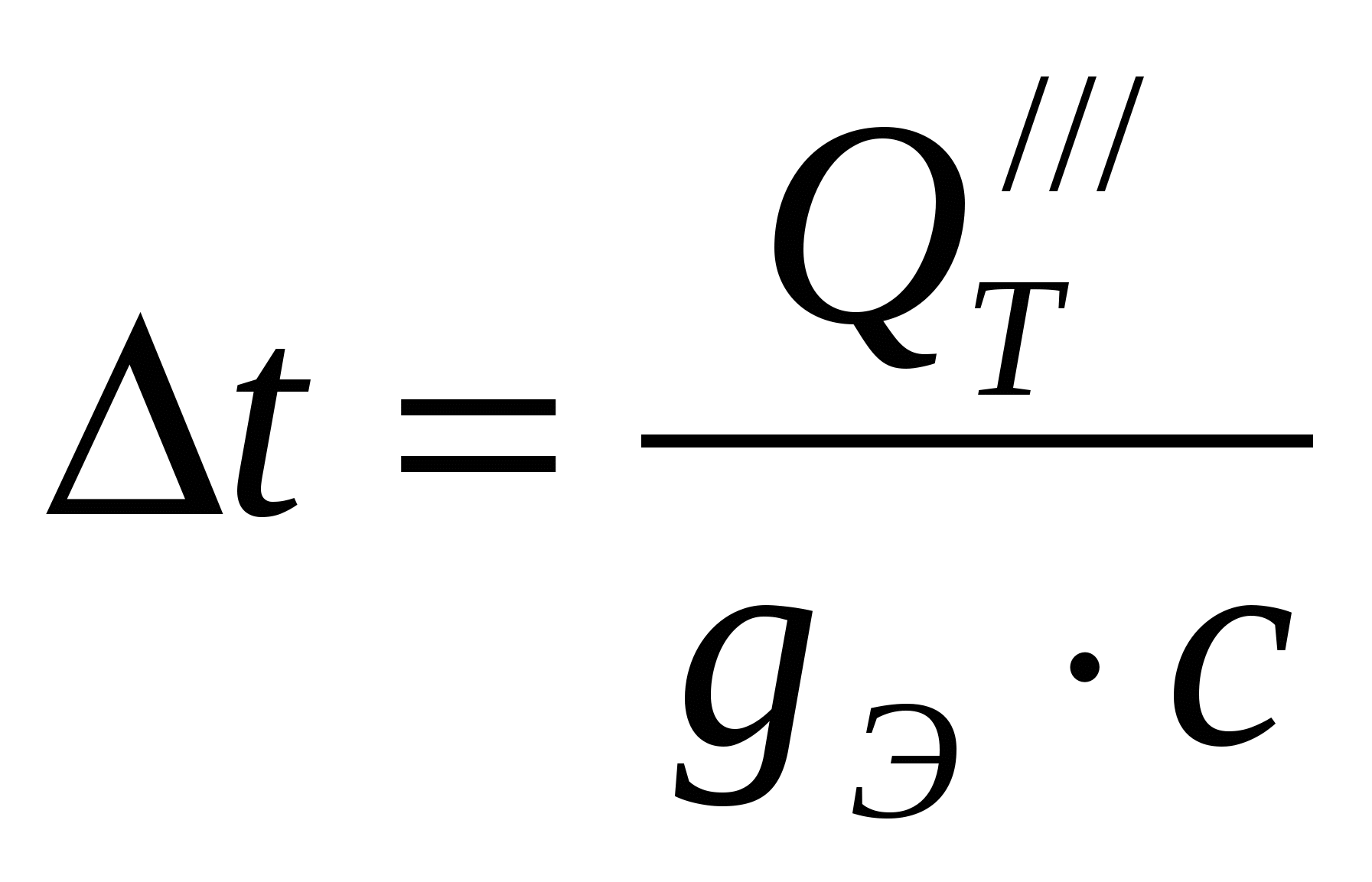
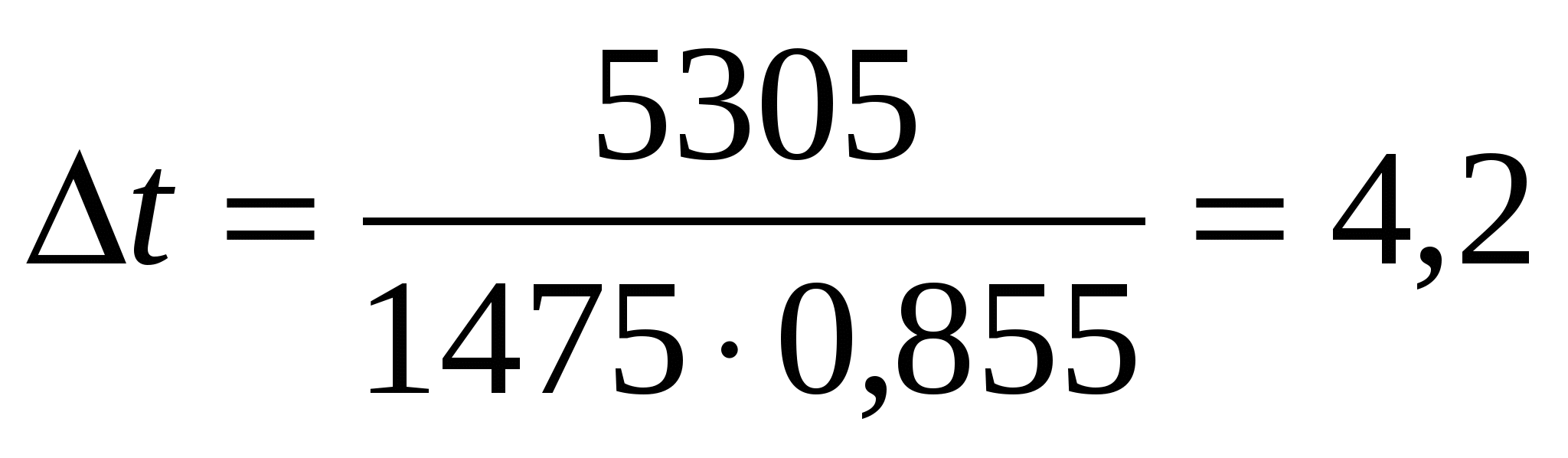 град град
-
Температура поступающего электролита
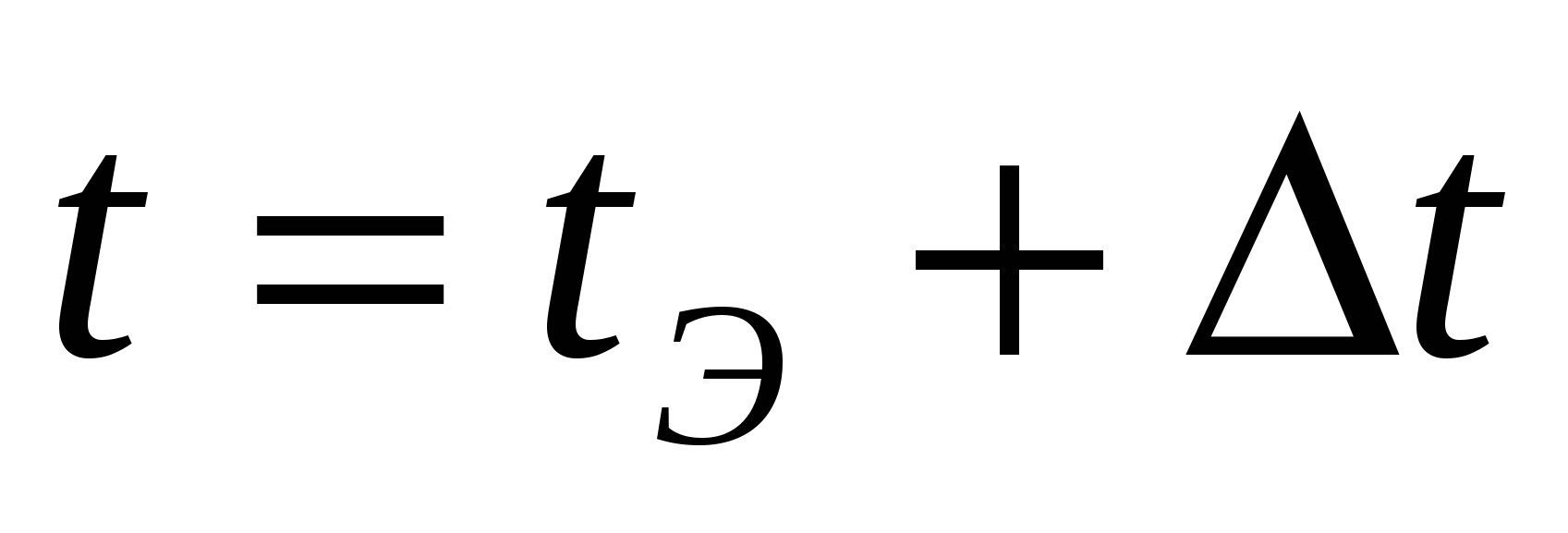
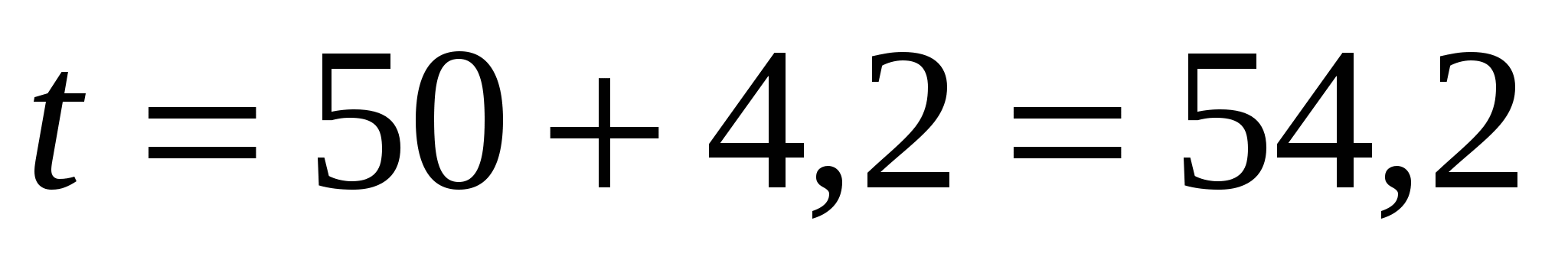 °C °C
-
Расход пара на нагрев электролита
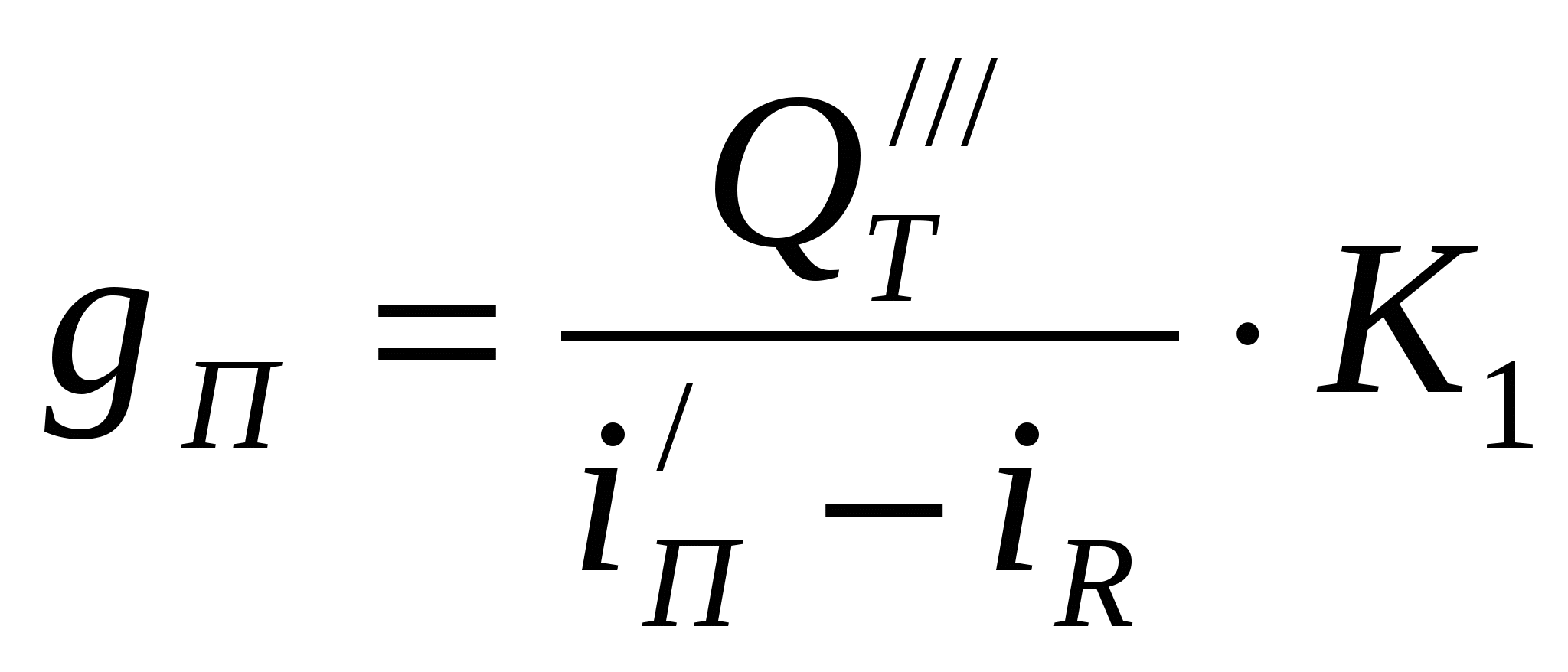
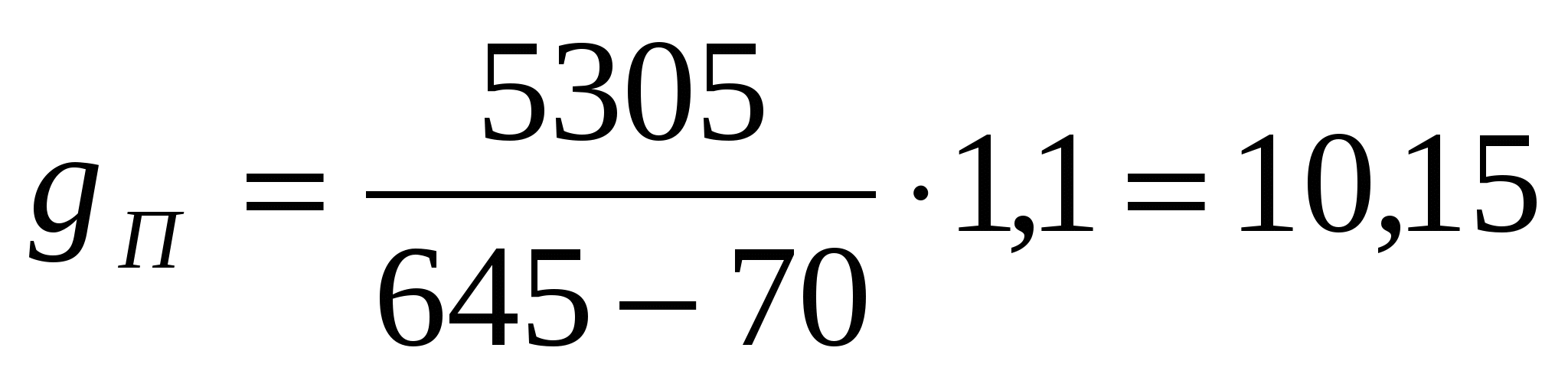 кг/час кг/час
где К1 – коэффициент, учитывающий потери тепла в
циркуляционной системе электролита.
-
Удельный расход пара
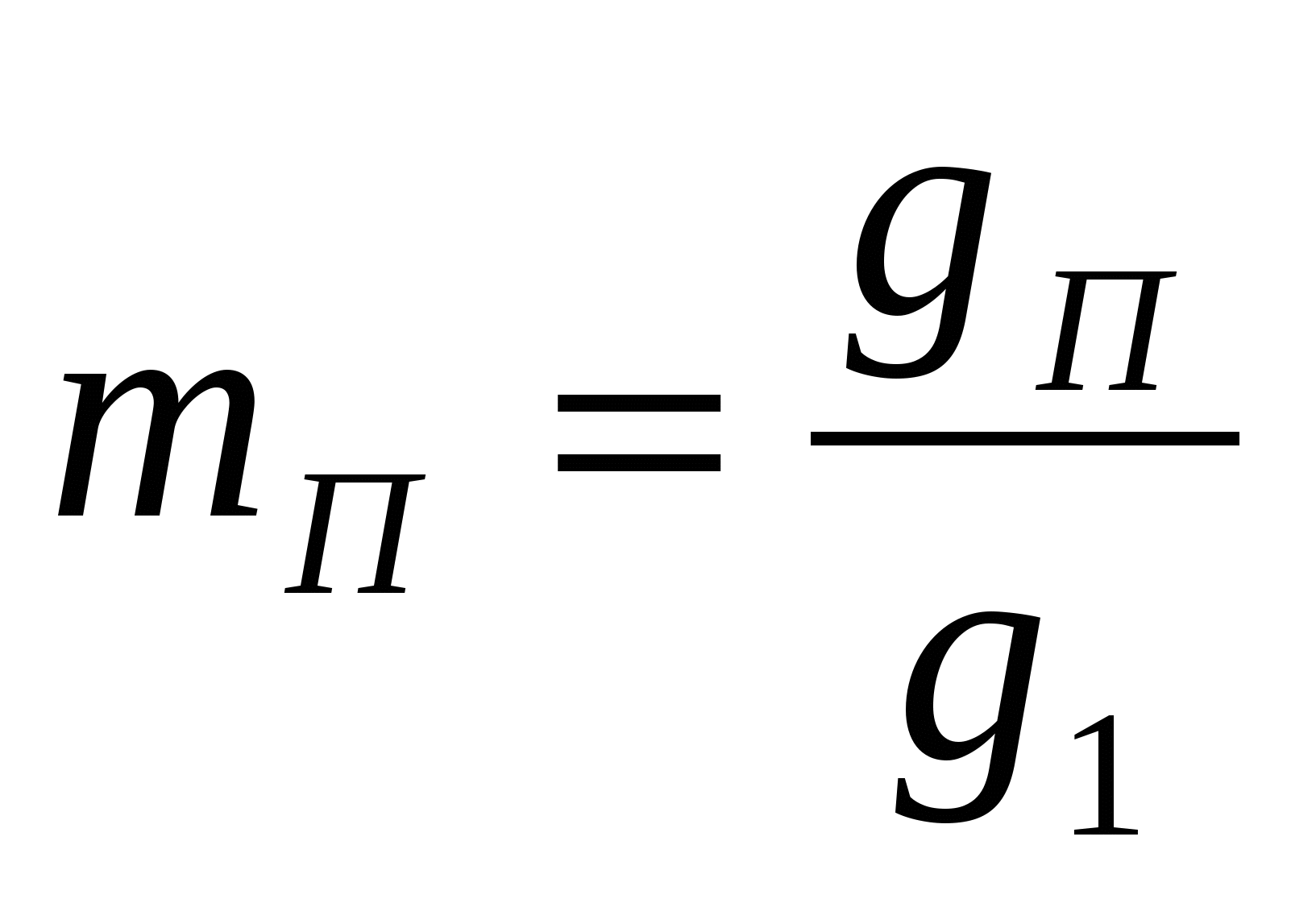
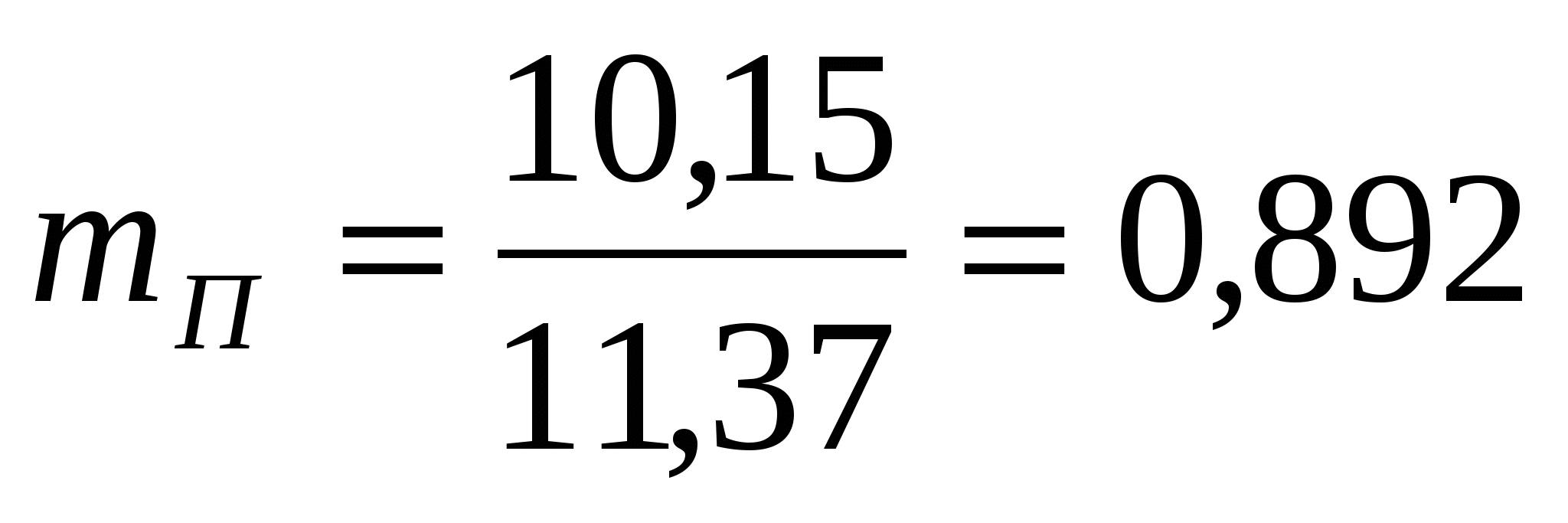 т/т меди т/т меди
Таблица 1 – Варианты заданий к примеру 1
№
|
D,
A/м2
|
В Т ,
%
|
S, м2
|
υЭ,
л/мин
|
l, см
|
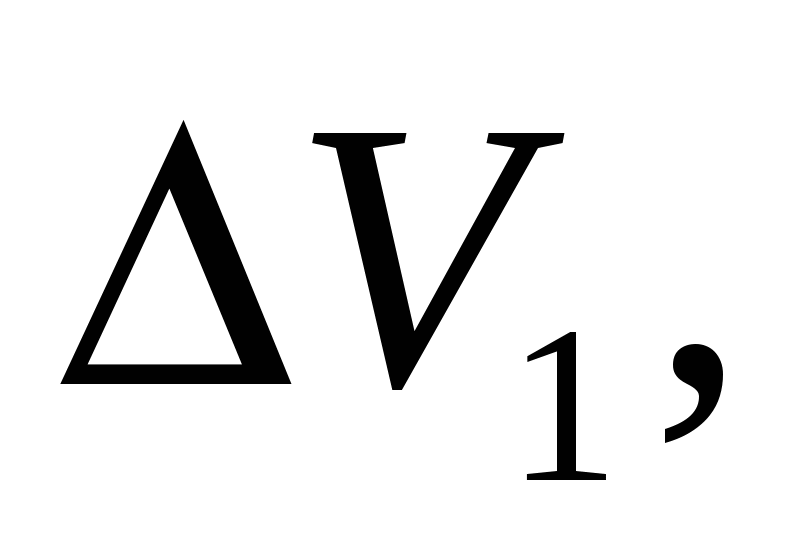 мВ мВ
|
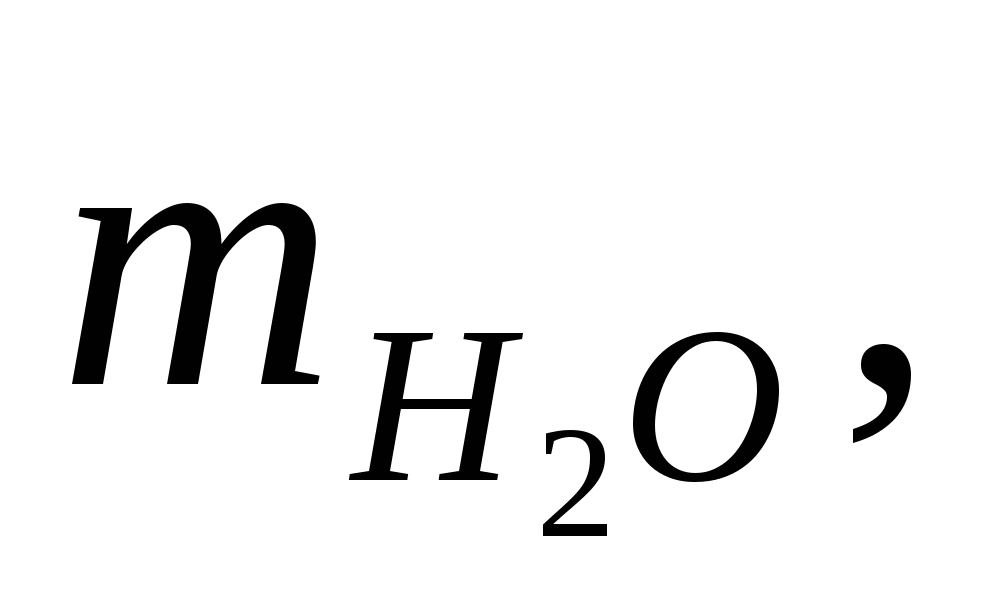
кг/час
|
1
|
210
|
95
|
4,1
|
24
|
5,0
|
85
|
1,85
|
2
|
180
|
98
|
4,0
|
22
|
4,5
|
82
|
1,78
|
3
|
190
|
99
|
3,8
|
21
|
4,8
|
75
|
1,88
|
4
|
185
|
97
|
4,5
|
25
|
5,5
|
78
|
1,96
|
5
|
205
|
91
|
4,8
|
28
|
5,9
|
90
|
1,98
|
6
|
195
|
92
|
5,0
|
19
|
5,8
|
95
|
1,84
|
7
|
215
|
94
|
5,2
|
18
|
5,6
|
93
|
1,77
|
8
|
208
|
88
|
4,3
|
23
|
4,3
|
76
|
1,86
|
9
|
192
|
85
|
5,5
|
17
|
4,7
|
81
|
1,94
|
10
|
220
|
87
|
3,5
|
26
|
4,9
|
97
|
1,90
|
страница 1 страница 2 | страница 3
|