страница 1
ТЕМА №8
Кинетика процессов приводящих к деградации полупроводниковых приборов и ИМС.
Кинетика – это наука, изучающая протекание того или иного физико-химического процесса во времени, или другими словами наука о скоростях, механизмах и факторах, влияющих на физический или химический процесс.
Понятие о химической реакции и ее скорости. Элементарный акт химического превращения можно определить как изменение химического строения одной или нескольких частиц (например, молекул) при определенных внешних условиях. В результате элементарного акта химического превращения может осуществляться: а) химическое превращение одной частицы в другую, б) распад одной частицы на определенное число других самостоятельных частиц, в) химическое взаимодействие двух и более частиц друг с другом.
Если в элементарной химической реакции принимают участие только частицы одного сорта (пусть сорта А), то такую реакцию в химической кинетике называют мономолекулярной. В этом случае реакция схемотехнически записывается в виде
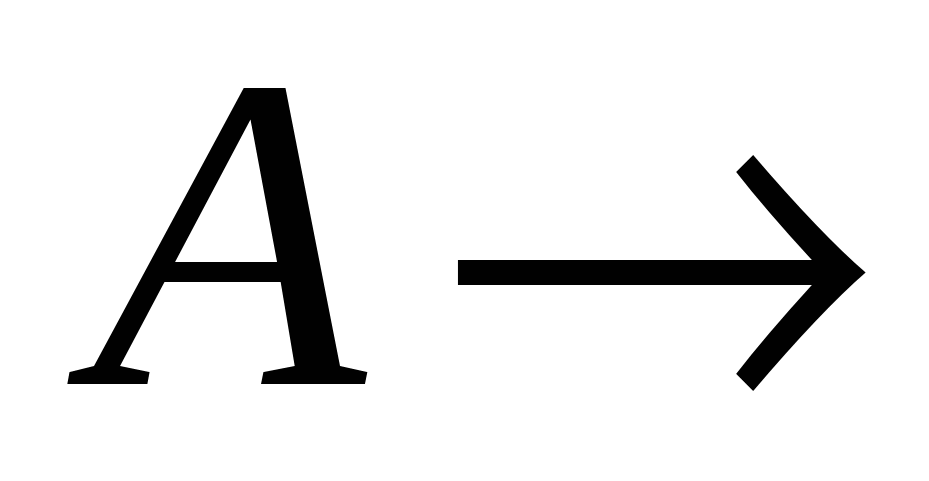 продукты реакции. (8.1) продукты реакции. (8.1)
Система считается закрытой, если концентрация вещества изменяется только в результате реакции и не может быть обмена веществом с внешней средой.
Если в элементарной химической реакции принимают участие частицы двух (А и В) или трех (А,В,С,) сортов, то такие реакции называются, соответственно, бимолекулярными и тримолекулярными. Схемотехнически они могут быть записаны в виде:
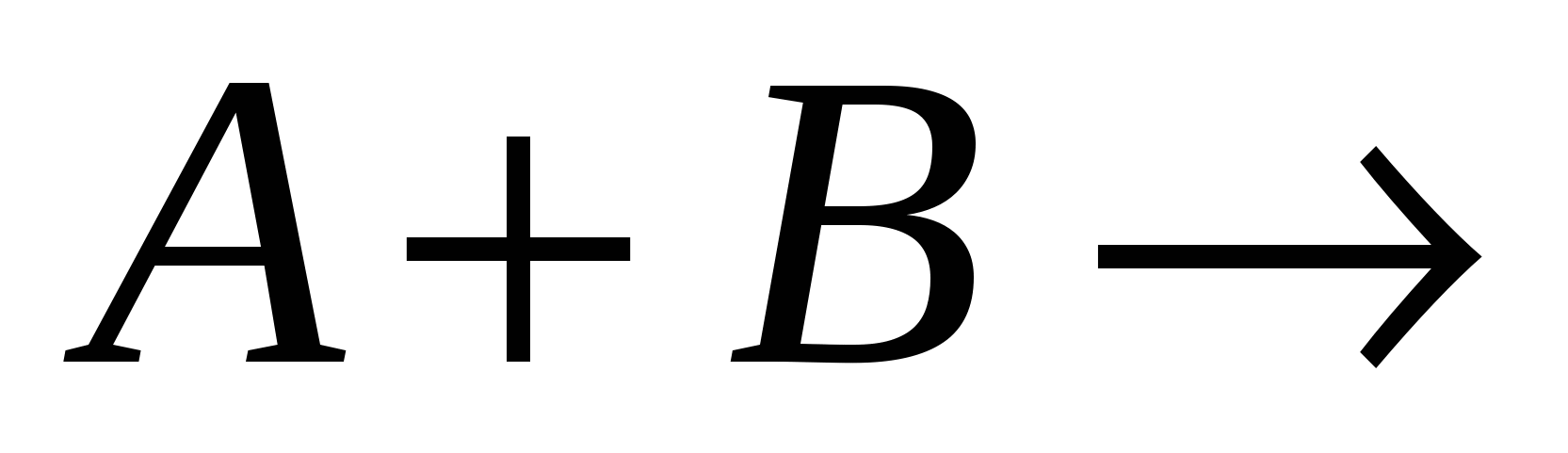 продукты реакции, (8.2) продукты реакции, (8.2)
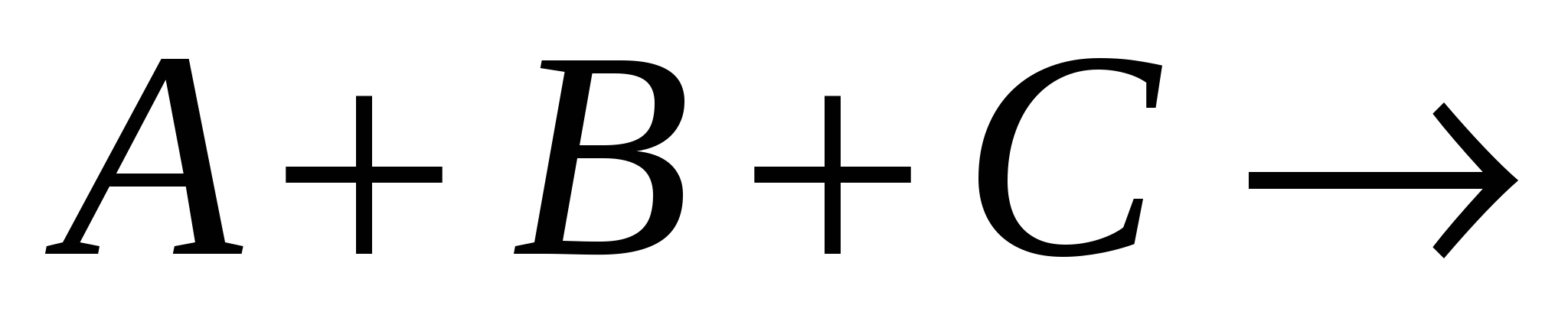 продукты реакции. (8.3) продукты реакции. (8.3)
Необходимо подчеркнуть, что вероятность одновременного взаимодействия трех и более частиц в конкретном элементарном акте обычно очень мала.
Важнейшим, фундаментальным понятием в химической кинетике является скорость химической реакции. Именно оно лежит в основе современной физической теории надежности и ускоренных испытаний полупроводниковых приборов и ИМС. Скорость химической реакции 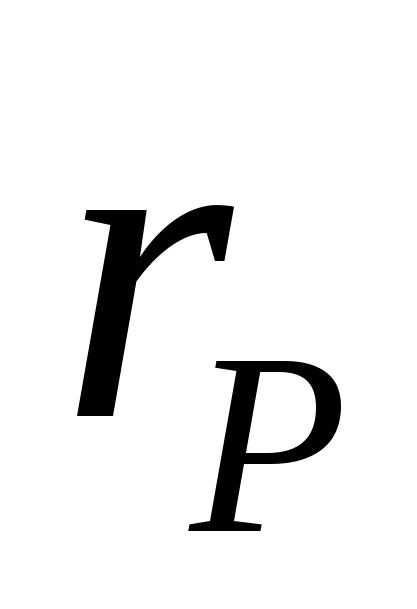 в замкнутой системе может быть определена как изменение числа актов реакций в единицу времени в единице объема. Если обозначить концентрацию участвующих в реакции компонентов в замкнутой системе может быть определена как изменение числа актов реакций в единицу времени в единице объема. Если обозначить концентрацию участвующих в реакции компонентов 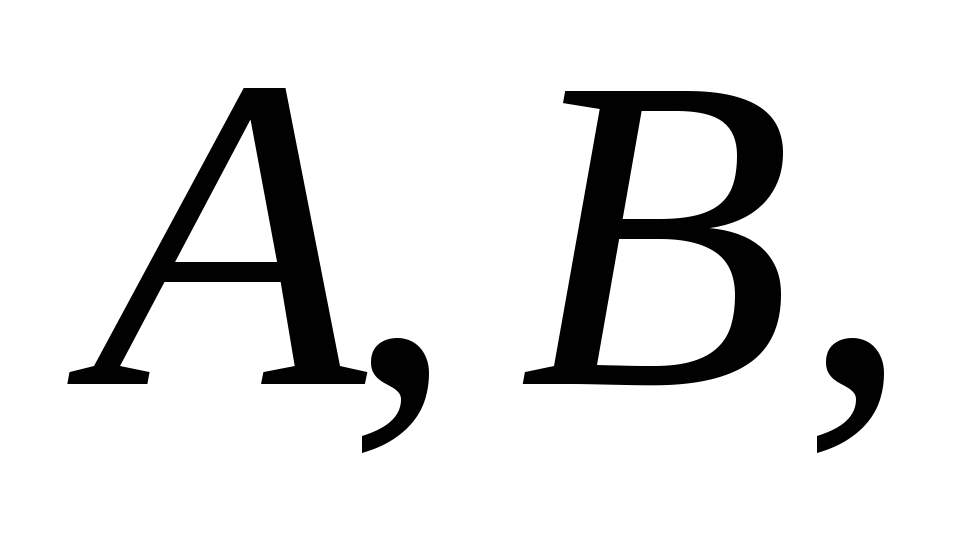 и и 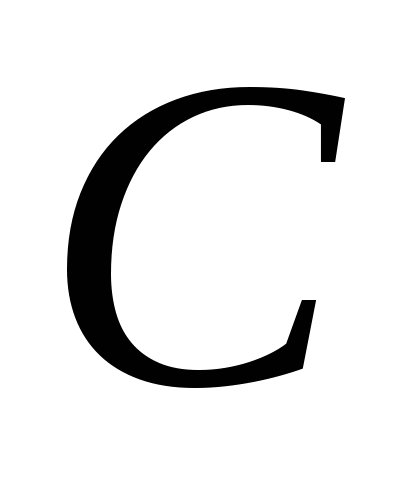 , соответственно, через , соответственно, через  , , 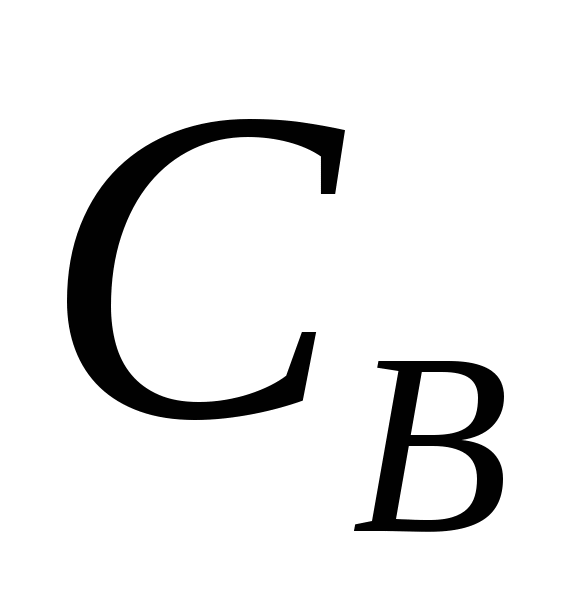 и и 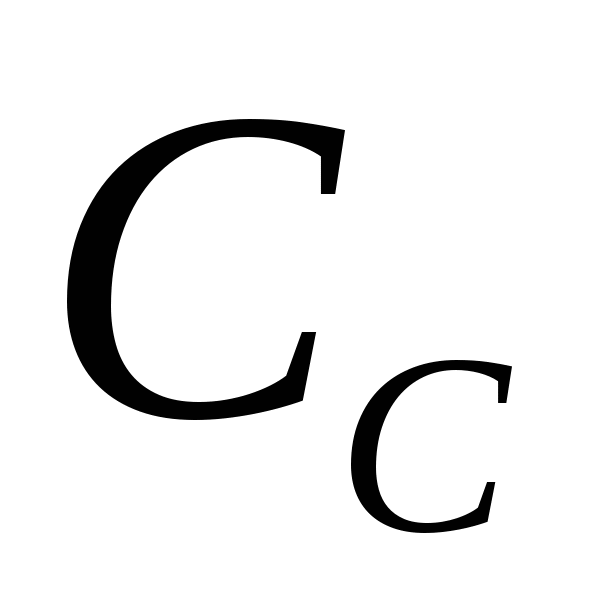 , то для скорости моно-, би- и тримолекулярных реакций первого порядка справедливы следующие выражения: , то для скорости моно-, би- и тримолекулярных реакций первого порядка справедливы следующие выражения:
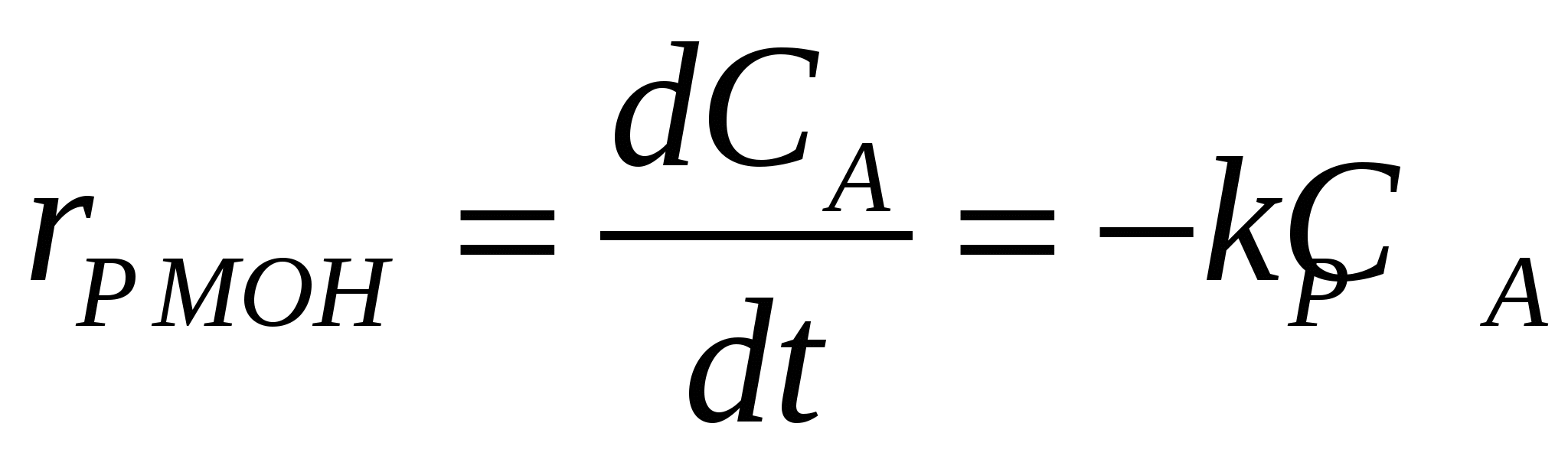 , (8.4) , (8.4)
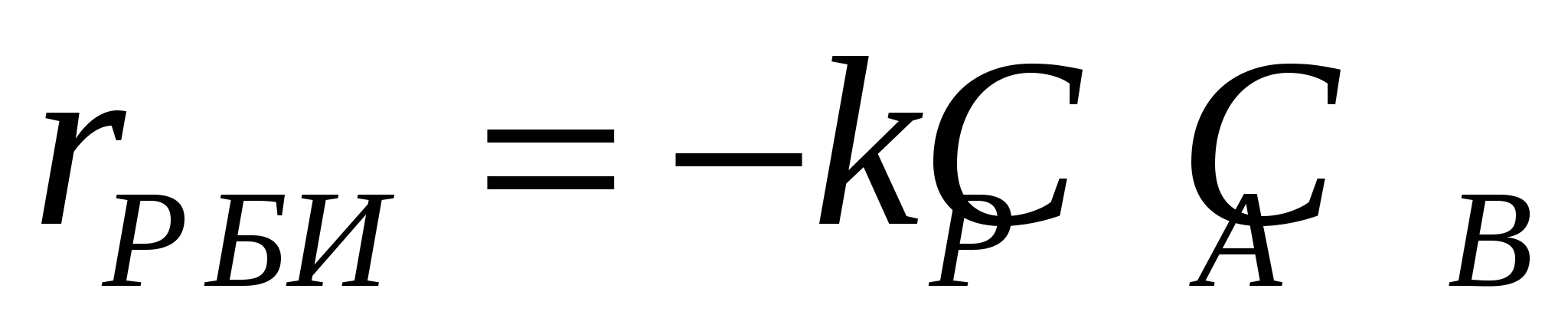 , (8.5) , (8.5)
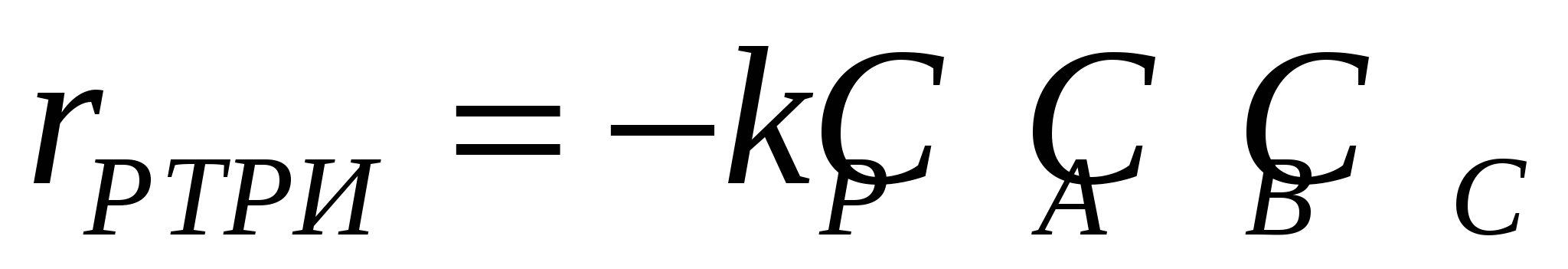 , (8.6) , (8.6)
где 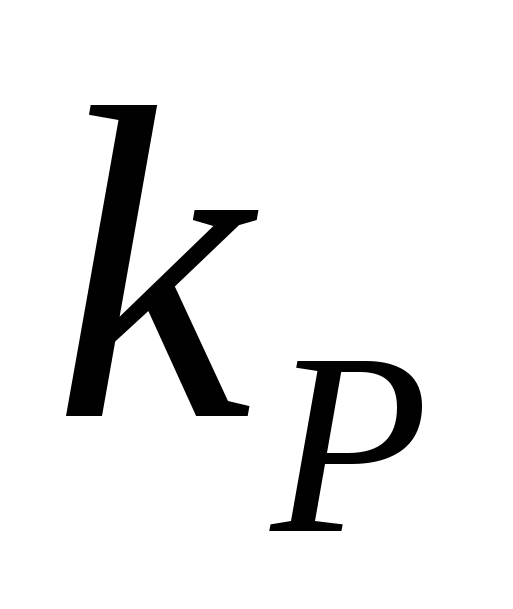 - константа скорости реакции. - константа скорости реакции.
Соотношения (8.4) (8.6) принято называть законом действия масс. В более общем виде, данный закон записывается (8.6) принято называть законом действия масс. В более общем виде, данный закон записывается
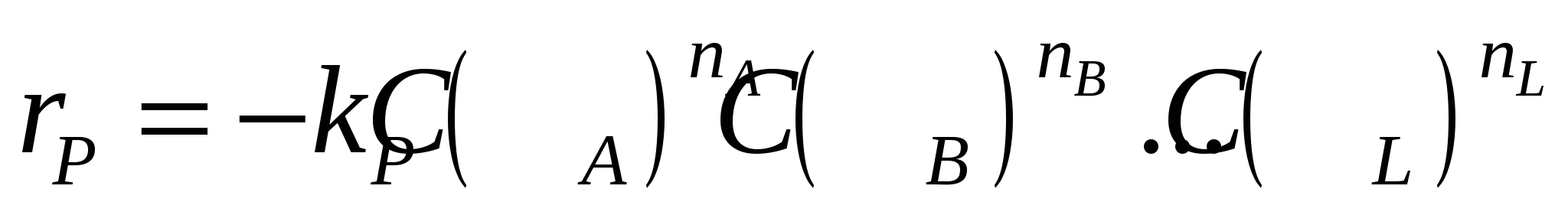 , (8.7) , (8.7)
где 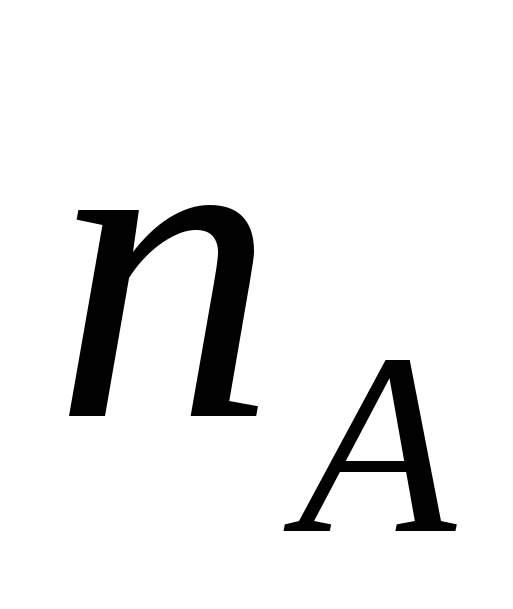 , , 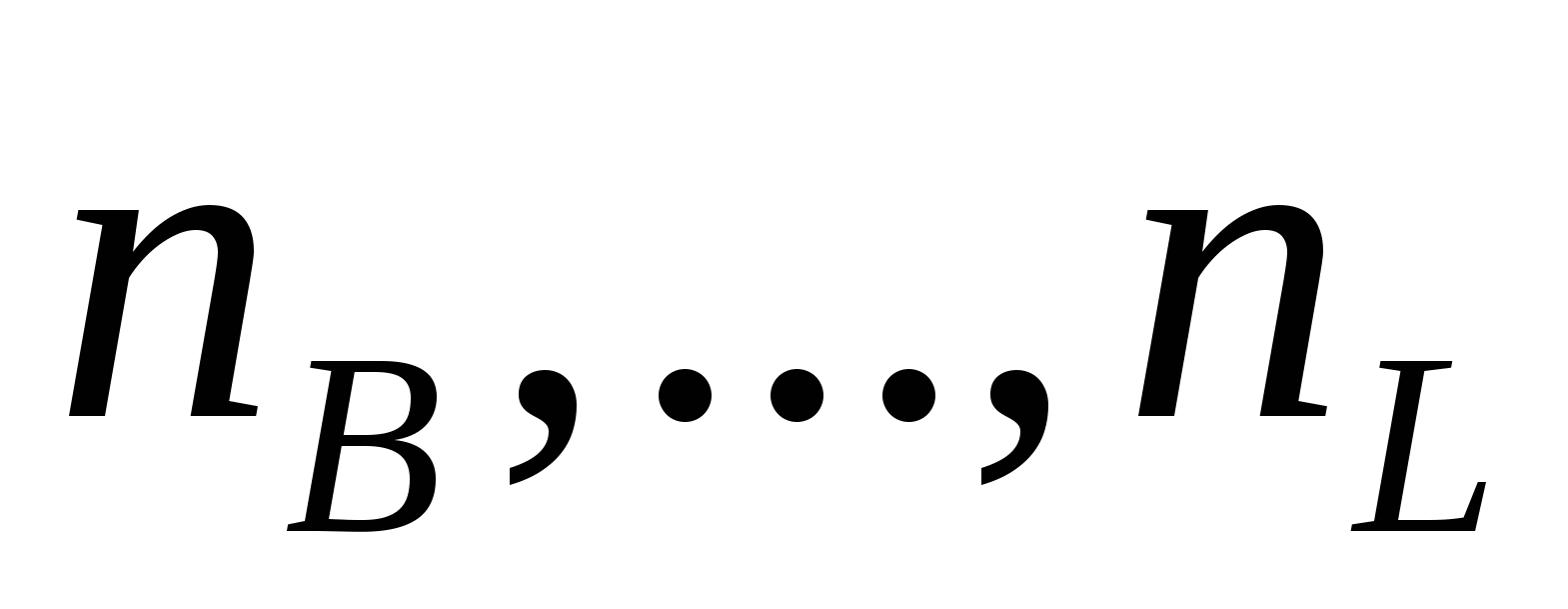 - порядок реакции по веществам. - порядок реакции по веществам.
На константу скорости химической реакции сильное влияние оказывает температура: как правило, она увеличивается с ростом температуры. Существует эмпирическое правило Вант-Гоффа, согласно которому возрастание температуры на 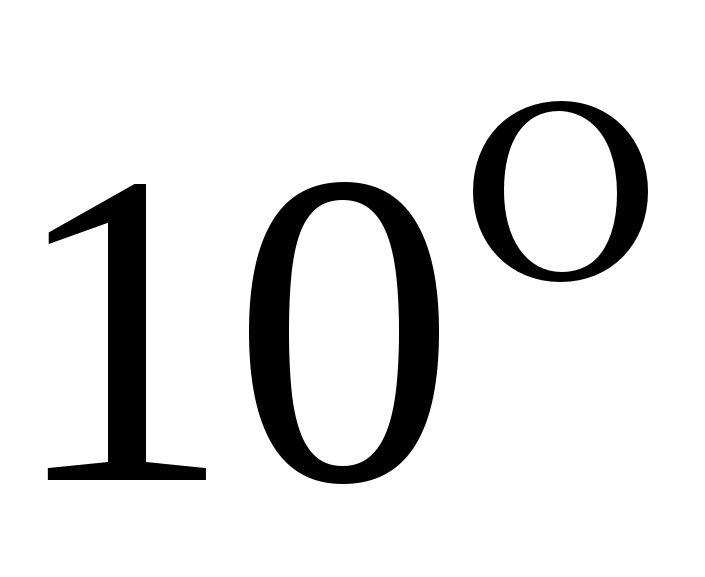 вызывает увеличение константы скорости в вызывает увеличение константы скорости в 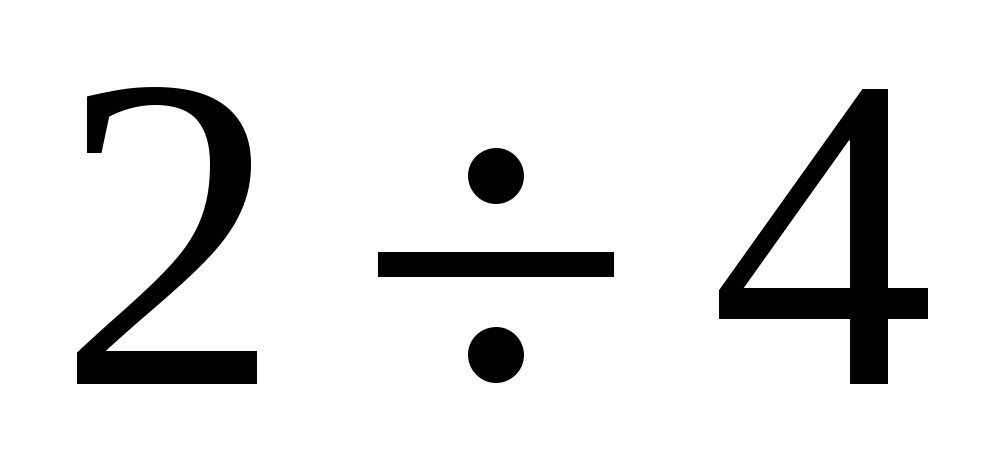 раза. раза.
При постоянной скорости реакции 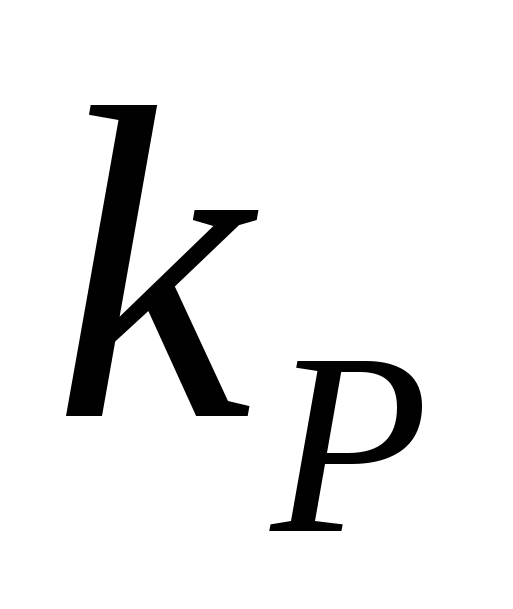 справедливо соотношение Аррениуса: справедливо соотношение Аррениуса:
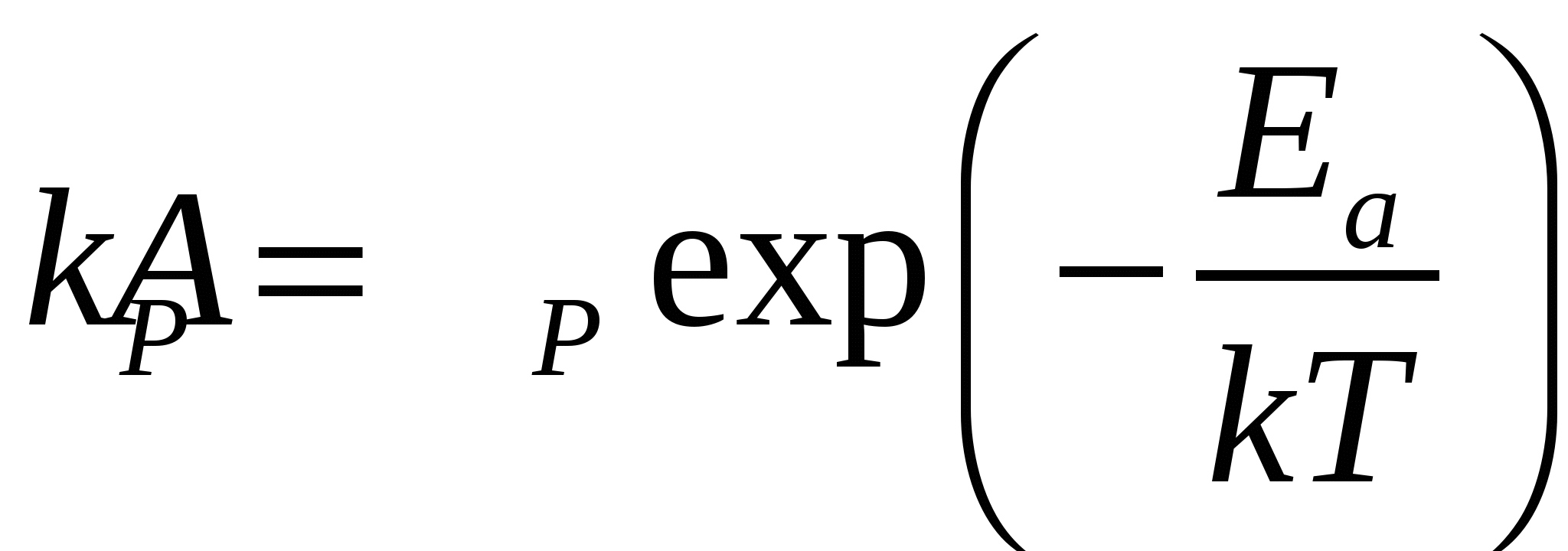 , (8.8) , (8.8)
где  - постоянная величина. - постоянная величина.
Поскольку концентрация реагирующих веществ в замкнутой системе практически не зависит от температуры, то аналогичное выражение можно записать и для скорости химической реакции
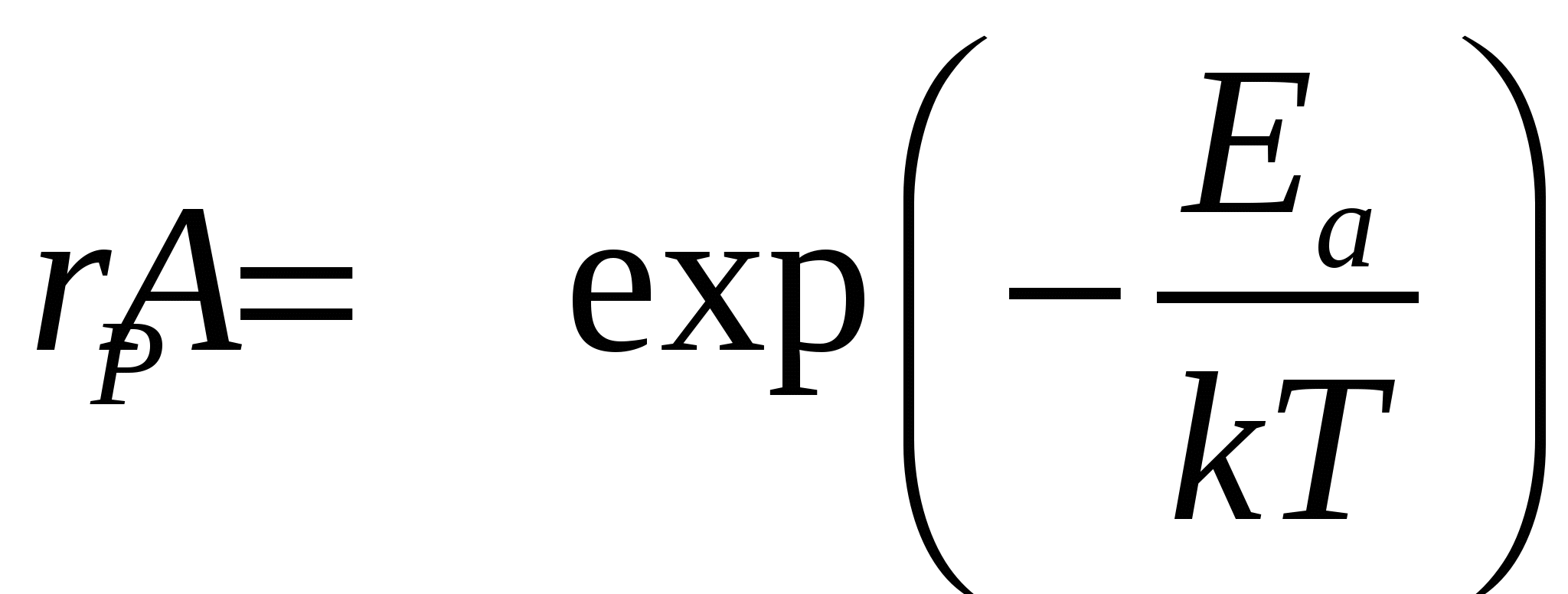 , (8.9) , (8.9)
где  - некоторая постоянная величина. - некоторая постоянная величина.
Выражения (8.8) и (8.9) имеют важнейшее значение в теории и практике физики надежности полупроводниковых приборов и ИМС.
Контрольные вопросы -
Какие превращения возможны в результате элементарного химического акта?
-
Что такое скорость химической реакции?
-
Какие реакции называются моно-, би- и тримолекулярными?
-
Какие соотношения принято называть законом действия масс?
страница 1
|