страница 1 страница 2 страница 3 | страница 4
Лабораторное занятие 1
Морфология и ультраструктура вирусов
Цель занятия: освоить бактериоскопический метод выявления вирусов в материалах и изучить особенности морфологии и ультраструктуры вирусов с использованием метода электронной микроскопии.
Материалы и оборудование: 1) электронные микрофотографии и демонстрационные рисунки: а) простых и сложных вирусов, б) вирусов с разными типами симметрии, в) вирусов с оболочками разной архитектуры; 2) световой микроскоп; 3) флюоресцентный микроскоп; 4) музейные препараты с вирусными включениями в клетках пораженных тканей растений и животных; 5) препарат или фотография флюоресцентной микроскопии препарата вирусоинфицированных клеток.
Задание 1: проведите вирусоскопическое исследование демонст-рационных препаратов клеток, пораженных вирусами.
Ход работы
1 Прочтите приведенное ниже краткое описание микроскопических методов, используемых для выявления вирусов в материалах (вирусоскопия в иммерсионном и люминесцентном микроскопах).
Вирусоскопия. В иммерсионном световом микроскопе обнаруживаются самые крупные элементарные тельца. Так, при натуральной оспе в жидкости кожных пузырьков находят вирионы Пашена, а в таких же везикулах при ветряной оспе – вирионы Арагана.
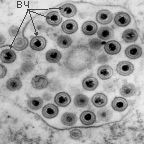
Легче при вирусных инфекциях выявить внутриклеточные включения (рисунок 8).

Рисунок 8 – Вирусные включения:
1 – тельца Гуарниери в клетке, зараженной вирусом оспы; 2 – включения в цилиндрическом эпителии, зараженном вирусом гриппа; 3 – включения в эпителии, зараженном реовирусом; 4 – тельца Бабеша-Негри в нейроцитах; 5,6 – внутриядерные включения в эпителии, зараженном герпес- и аденовирусом; 7 – внутриядерные и цитоплазматические включения в эпителии, зараженном вирусом кори
В основном они представлены скоплениями вирионов вперемешку с реактивными клеточными продуктами и в зависимости от места репликации вирионов находятся в цитоплазме или ядре клеток-хозяев. В частности, цитоплазматическими включениями являются тельца Гуарниери в эпителиальных клетках, скопления реовирусов и вирусов гриппа в них, тельца Бабеша-Негри – в нейроцитах. Ядерные адено-, папова- и герпесвирусные включения состоят из клеточного материала. Изредка в одной и той же клетке вирусы, например, коревой, формируют цитоплазматические и ядерные включения.
По форме, размерам, структуре, отношению к красителям вирусные включения строго специфичны. Например, тельца Гуарниери имеют округлую, серповидную или амебоидную форму диаметром 1–10 мкм, тельца Бабеша-Негри – овальные или эллипсоидные, достигающие 20 мкм, включения реовирусов серповидные, наполовину охватывающие клеточное ядро, коревые включения – в виде почкующихся мелких дрожжей (рисунок 9).
В препаратах, обработанных мечеными антителами под люминесцентным микроскопом обнаруживают вне- и внутриклеточно расположенные вирионы в виде разноцветных точек и конгломератов в зависимости от природы используемого флюорохрома (рисунок 10).
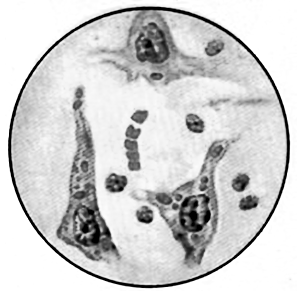
Рисунок 9 – Тельца Бабеша-Негри в нервных клетках головного мозга
На сегодняшний день в ветеринарии применяется единственный информативный и достаточно точный метод диагностики бешенства у животных. Это посмертное исследование срезов аммоновых рогов головного мозга и обнаружение в них специфических включений – телец Бабеша-Негри. Состоят тельца Бабеша-Негри из тонковолокнистого матрикса и вирусного рибонуклеопротеида.
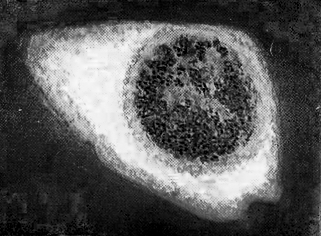
Рисунок 10 ― Вирус гриппа в культуре клеток через 12 ч после инфицирования (иммунофлюоресцентная микроскопия, ˟ 1200). Видны светящиеся комплексы в ядре и на внутренней поверхности плазмалеммы
2 Используя флюоресцентный микроскоп, рассмотрите препарат культуры клеток инфицированных вирусом и обработанных флюорохромом. Сделайте рисунок препарата и укажите светящиеся точки-вирусы.
3 Используя световой микроскоп, рассмотрите фиксированный препарат нейтроцитов с включениями рабдовирусов (тельца Бабеша-Негри). Сделайте рисунок препарата и укажите тельца Бабеша-Негри.
Задание 2: изучите особенности электронной микроскопии и ее возможности при изучении морфологии и ультраструктуры вирусов.
Ход работы
1 Ознакомьтесь с приведенной ниже общей характеристикой метода электронной микроскопии.
Электронная микроскопия. Теоретически разрешение просвечивающего электронного микроскопа составляет 0,002 нм; реальное разрешение современных микроскопов приближается к 0,1 нм. На практике разрешение для биологических объектов достигает 2 нм.
В электронном микроскопе вирусы идентифицируют по тонким деталям их ультраструктуры. С этой целью получают микрофотографии. При этом содержащий вирусы материал суспендируют в хорошо испаряющейся среде и наносят на сетку с подложкой, представляющей собой пленку из коллодия или из чистого углерода, слабо поглощающую электроны. Улучшение электронно-микроскопического изображения вирусов достигается увеличением их электронной плотности путем воздействия на них паров четырехокиси осмия. Широко используются также методы напыления на вируссодержащие материалы тяжелых металлов (золото, палладий, уран), хорошо оттеняющих форму и объем вирусных частиц, и негативного контрастирования вирионов нейтральными растворами фосфовольфрамата или уранилацетата, глубоко проникающими в их «извилины и зазоры». Наконец, конфигурация вирионов отчетливо отпечатывается на матрицах-репликах высохших пленок пластмассы, раствором которых они заливаются. Симметрию и распределение белковых субъединиц в блоке-ансамбле вирусных кристаллов изучают с помощью рентгеноструктурного анализа.
Просвечивающий электронный микроскоп (рисунок 11) состоит из колонны, через которую в вакууме проходят электроны, излучаемые катодной нитью. Пучок электронов, фокусируемый кольцевыми магнитами, проходит через подготовленный образец. Характер рассеивания электронов зависит от плотности образца. Проходящие через образец электроны наблюдают на флюоресцирующем экране и регистрируют при помощи фотопластинки.
Сканирующий (растровый) электронный микроскоп РЭМ применяют для получения трёхмерного изображения поверхности исследуемого объекта. В РЭМ применяются электронные линзы для фокусировки электронного пучка в пятно очень малых размеров. Это пятно непрерывно обегает некоторый участок образца аналогично лучу, обегающему экран телевизионной трубки. Электрический сигнал, возникающий при бомбардировке объекта электронами пучка, используется для формирования изображения на экране телевизионного кинескопа или электронно-лучевой трубки. Увеличение (отношение размера изображения на экране к размеру области, обегаемой пучком на образце) составляет от 10 до 10 млн.


Рисунок 11 – Внешний вид и схема электронного микроскопа
2 Рассмотрите электронные микрофотографии вирусов (рисунки 12-15, демонстрационный материал).


Рисунок 12 – Аденовирусы Рисунок 13 – Вирусы гепатита А
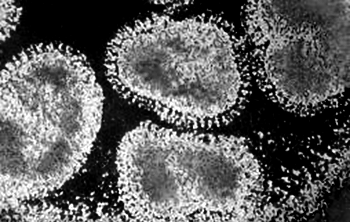
Рисунок 14 – Вирусы гриппа
3 В протоколе занятия кратко опишите технологию электронной микроскопии.
Задание 3: изучите структуру вируса натуральной оспы.
Ход работы
1 Рассмотрите электронную микрофотографию вириона оспы (рисунок 16).
2 Изучите схему строения вируса натуральной оспы (рисунок 17) и найдите соответствия структурных элементов на схеме и фотографии.
3 Укажите на соответствующем рисунке протокола занятия сердцевину, капсид, суперкапсид вириона оспы и захваченные им фрагменты цитоплазматической мембраны.
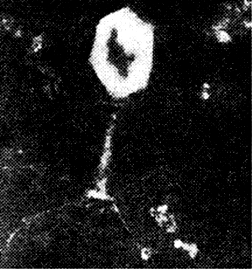
Рисунок 15 – Электронная микрофотография фага эшерихии коли
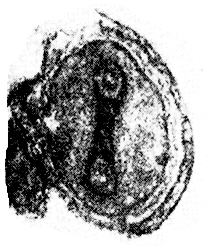
Рисунок 16 – Вирион натуральной оспы ( электронная микроскопия, ˟ 230 000 )

Рисунок 17 – Схема строения вириона оспы:
1 – фрагмент цитоплазматической оболочки, захваченной вирионом при выходе из клетки; 2 – пространство между этой оболочкой и поверхностью вириона; 3 – внешняя осмиофильная мембрана оболочки вириона; 4 – средняя осмиофильная мембрана оболочки вириона; 5 – внутренняя мембрана оболочки вириона; 6 – боковое (латеральное) тело; 7 – фрагмент клеточной оболочки; 8 – внутривирусная гранула; 9 – локальное втяжение оболочки; 10 – тяж, связывающий компонент нуклеоида с оболочкой; 11 – вирусоплазма; 12 – внешняя осмиофильная мембрана оболочки нуклеоида; 13 – средняя осмиофобная мембрана оболочки нуклеоида; 14 – внутренняя осмиофильная мембрана оболочки нуклеоида; 15 – нуклеоидоплазма; 16 – осмиофобный компонент S-образной структуры; 17 – кольцо – срез спиральной укладки ДНК (гипотеза); 18 – центр этого кольца; 19 – внутренний компонент S-образной структуры нуклеоида; 20 – центральный компонент S-образной структуры нуклеоида.
Тема 2 Принципы классификации вирусов животных, человека и растений
2.1 Основные семейства
2.2 Фитовирусы
2.3 Методы выделения, культивирования и идентификации вирусов
2.1 Основные семейства
Вирусы отнесены к царству Vira. По типу нуклеиновой кислоты выделяют рибовирусы (РНК-вирусы) и дезоксирибовирусы (ДНК-вирусы). Для вирусов предложены следующие таксономические категории (по восходящей): Вид (Species) → Род (Genus) → Подсемейство (Subfamilia) → Семейство (Familia). Категории подсемейств и родов разработаны не для всех вирусов.
Название всех вирусных родов оканчивается словом «virus», для названия семейств используется суффикс «-idae», а подсемейств − «-inae».
Из более чем 55 семейств вирусов, признанных Международным комитетом по таксономии вирусов, следующие 19 включают вирусы человека и животных: поксвирусы, иридовирусы, вирусы герпеса, аденовирусы, паповавирусы, вирусы гепатита В, парвовирусы, реовирусы, тогавирусы, коронавирусы, парамиксовирусы, рабдовирусы, филовирусы, ортомиксовирусы, буньявирусы, аренавирусы, ретровирусы, пикорнавирусы, калицивирусы.
К числу семейств вирусов исключительно позвоночных относятся Herpesviridae, Adenoviridae, Papovaviridae, Paramyxoviridae, Orthomyxoviridae, Arenaviridae, Coronaviridae.
Размножаться в двух типах хозяев – позвоночных и беспозвоночных (клещи, комары, москиты) способны вирусы семейства Bunyaviridae, роды Alphavirus и Flavivirus семейства Togaviridae, вирусы родов Vesiculovirus и Lyssavirus семейства Rhabdoviridae, род Orbivirus семейства Reoviridae, вирус африканской лихорадки свиней семейства Iridoviridae. Такие вирусы составляют экологическую группу арбовирусов, т. е. вирусов позвоночных, передающихся членистоногими.
П
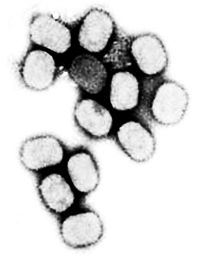
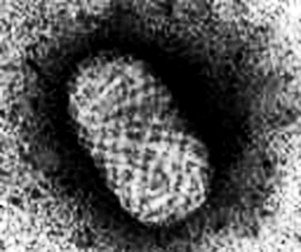
оксвирусы. Семейство Poxviridae включает вирусы, патогенные для насекомых, птиц и млекопитающих. Вирионы кирпичеобразной формы (рисунок 18 А), их размеры составляют 250–390˟200–260 нм.
А Б
Рисунок 18 – Поксвирусы:
А – кирпичеобразная форма вириона; Б – вирус контагиозного моллюска
Вирион включает сердцевину, окруженную гладкой мембраной и слоем равномерно расположенных цилиндрических структур. Снаружи располагаются овальные структуры (белковые тела), окруженные оболочкой с характерной бороздчатой структурой. Геном – двухнитевая молекула ДНК.
Семейство включает вирусы осповакцины и натуральной оспы (род Orthopoxvirus), вирусы узелков доярок – псевдооспы крупного рогатого скота (род Parapoxvirus), вирус контагиозного моллюска (род Molluscipoxvirus) (рисунок 18 Б), вирусы оспы Тана и Яба – оспы обезьян (род Yatapoxvirus).
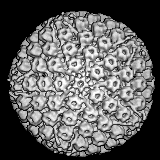
Вирусы герпеса. Герпесвирусы Herpesviridae [от греч. herpes, ползучее поражение кожи] – группа сравнительно крупных вирусов диаметром 150–200 нм (рисунок 19 А, Б) и кубическим типом симметрии. Геном представлен двухнитевой молекулой ДНК, содержащей короткий (18 %) и длинный (82 %) компоненты.

А Б
Рисунок 19 – Герпесвирусы:
А – нуклеокапсид вирусной частицы и отходящая на различное от него расстояние оболочка формируют характерную картину «жарящегося яйца»; Б – модель вирусной частицы
Суперкапсиды герпесвирусов образованы фрагментами ядерных мембран (созревание дочерних популяций происходит на внутренней мембране ядер зараженной клетки – рисунок 20) и пронизан гликопротеиновыми шипами. Между нуклеокапсидом и суперкапсидом расположен покровный слой – тегумент.
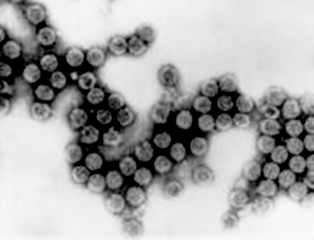
Аденовирусы. Патогенные для человека вирусы включены в состав рода Mastadenovirus (аденовирусы млекопитающих) семейства Adenoviridae. Аденовирусы организованы по принципу кубической симметрии и не имеют суперкапсида. Геном представлен линейной молекулой двухнитевой ДНК. Средний диаметр вириона равен 60–90 нм. Капсид состоит из 252 капсомеров, 240 из них (гексоны) образуют его грани, 12 (пентоны) – полигональные основания и прикреплённые к нему нити (рисунок 21).
Р
исунок 20 – Вирусные частицы (ВЧ) простого герпеса, покидающие ядро инфицированной клетки. Электронная микроскопия, ˟ 40 000


Рисунок 21 – Вид аденовируса при электронной микроскопии (А) (˟ 600000 раз) и его модель (Б)
Паповавирусы. Название вирусов указывает на способность вызывать опухолевые трансформации клеток [па(пиллома) + по(лиома) + ва(куолизирующие) вирусы]. Семейство Papovaviridae включает роды Papillomavirus и Polyomavirus (рисунок 22 А, Б), последние приводят к развитию папиллом и полиом у своих хозяев – различных млекопитающих (в том числе и человека). Геном образует кольцевая ДНК; капсид организован по типу кубической симметрии. Средний размер вирионов 45–50 нм.
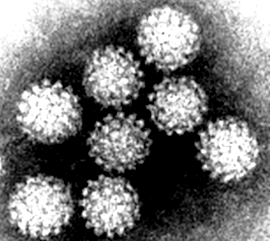
А Б
Рисунок 22 – Папилломавирус (А) и полиомавирус (Б) (электронная микроскопия)
Вирусы гепатита В. Вирус гепатита В включён в состав рода Orthohepadnavirus семейства Hepadnaviridae. Вирионы вируса гепатита В сферической формы 42 нм в диаметре имеют суперкапсид. Геном образует неполная (одна нить короче, рисунок 23) двухнитевая кольцевая молекула ДНК. В состав сердцевины также входит ДНК-зависимая ДНК-полимераза. В динамике процесса репродукции вирусная ДНК интегрирует в ДНК клетки. В крови больных гепатитом В циркулируют частицы трёх морфологических типов. Наиболее часто обнаруживают сферические частицы около 22 нм в диаметре; реже − нитевидной формы около 22 нм в диаметре и 50–230 нм в длину. Вирусные частицы этих типов не проявляют инфекционных свойств. Лишь 7 % частиц представлены комплексными двухслойными сферическими образованиями с полной структурой – частицы Дейна (рисунок 24), проявляющие выраженную инфекционность. Их оболочку на 70 % поверхности образуют белки.
Парвовирусы. Parvoviridae – семейство мелких вирусов, содержащих однонитевую ДНК. Репликация и сборка вирионов происходит в клеточном ядре. Выделяют 3 рода: Parvovirus (типичный вид – вирус крыс Килхэма), Densovirus и род, включающий ассоциирующиеся с тканями миндалин сателлитные вирусы.
Реовирусы. Семейство Reoviridae объединяет 9 родов, включающих виды, патогенные для человека, позвоночных, насекомых и растений. Вирионы сферической формы (диаметр 60–80 нм), обладающие двумя капсидными оболочками, суперкапсид отсутствует. На поверхности наружного капсида находится гемагглютинин. Геном образован сегментированной двухнитевой молекулой -РНК. Нуклеокапсид образован по типу кубической симметрии. Капсид кольцевой формы включает многочисленные белковые шипы, придающие вирусам «пушистый» вид.
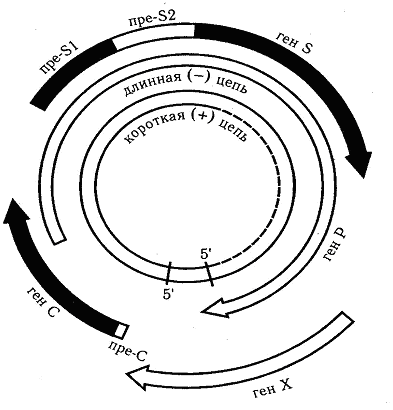
Рисунок 23 – Схема строения генома вируса гепатита В
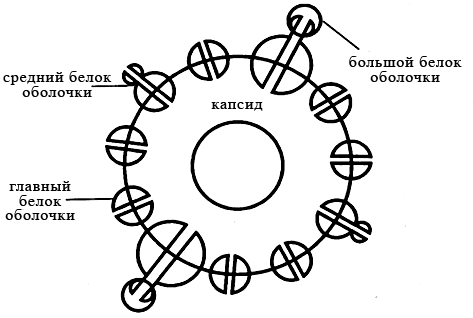
Рисунок 24 – Схема строения частицы Дейна
Тогавирусы. Краснуха – острая инфекция, проявляющаяся кратковременной лихорадкой, мелкопятнистым покраснением кожи, увеличением лимфатических узлов и поражением плода у беременных. Вирус краснухи включён в род Rubivirus семейства Togaviridae и является единственным тогавирусом, эпидемиология которого не связана с членистоногими-переносчиками. Зрелые вирионы имеют сферическую форму и диаметр 50–60 нм. Геном образован несегментированной молекулой +РНК. Липидная оболочка суперкапсида содержит гликопротеины, имеющие форму шипов.
Коронавирусы. Семейство Coronaviridae включает один род – Coronavirus, объединяющий вирионы округлой или овальной формы диаметром 50–220 нм. Зрелые частицы окружены суперкапсидом, включающим редко расположенные гликопротеиновые шипы, состоящие из тонкой шейки и массивной шаровидной овальной или грушевидной головки, что придаёт им сходство с солнечной короной (рисунок 25).
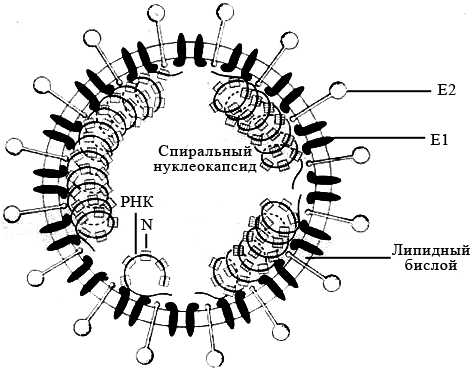
Рисунок 25 – Модель коронавируса
Вирусный нуклеокапсид представляет собой протяженную, несегментированную, гибкую спираль, содержащую геномную +РНК и большое число молекул фосфорилированного нуклеокапсидного белка N. Вирусная оболочка состоит из липидного бислоя, образующегося из внутриклеточной мембраны клетки-хозяина, и двух вирусных гликопротеинов БД и Е2. Матриксный гликопротеин Е1 пронизывает липидный бислой и взаимодействует с нуклеокапсидом внутри вирусной частицы.
У человека коронавирусы вызывают поражения воздухоносных путей (рисунок 26) и желудочно-кишечного тракта.
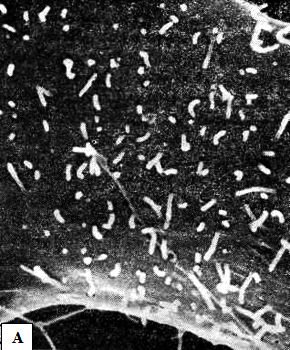 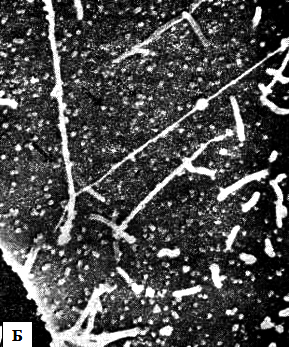
Рисунок 26 – Микрофотографии поверхностей незараженной клетки и клетки, зараженной коронавирусом. Контрольная клетка (А) имеет гладкую плазматическую мембрану, покрытую многочисленными цилиндрическими микроворсинками. В зараженной клетке (Б) с плазматической мембраной и микроворсинками» связано большое число сферических вирионов коронавируса
Парамиксовирусы. Все четыре рода семейства Paramyxoviridae включают возбудителей инфекций у человека: род Paramyxovirus – вирусы парагриппа 1- и 3-го типов; род Rubulavirus – вирусы эпидемического паротита и парагриппа 2- и 4-го типов; род Morbillivirus – вирусы кори и подострого склерозирующего панэнцефалита. Род Pneumovirus – PC-вирус человека. Парамиксовирусы – сферические «одетые» вирусы; средний размер вириона – 100–800 нм. Геном образует линейная, несегментированная молекула -РНК. С ней связаны белок NP и полимеразные белки Р и L, образующие нуклеокапсид со спиральной симметрией. Нуклеокапсид окружён матриксным М-белком. Суперкапсид образован двухслойной липидной мембраной, пронизываемой гликопротеиновыми «шипами» HN и F (ответственны за слияние с клеточной мембраной, образование симпластов и проявляющие гемолитическую и цитотоксическую активность). Репликация вирусов полностью реализуется в цитоплазме клеток хозяина.
Рабдовирусы. Рабдовирусы включают возбудителя бешенства (род Lyssavirus семейства Rhabdoviridae). Зрелые вирионы имеют пулевидную форму и размер 75˟180 нм; один конец закруглён, другой плоский. Геном образует однонитевая несегментированная молекула -РНК. Сердцевина вириона симметрично закручена внутри оболочки по продольной оси частицы. Нуклеокапсид дополняют молекулы сердцевинного белка (NP) и вирусной транскриптазы. Нуклеокапсид покрывает суперкапсид, включающий поверхностные гликопротеиновые «шипы». Репродукция вируса реализуется в цитоплазме клетки.
Филовирусы. Род Filovirus семейства Filoviridae объединяет палочковидные или нитевидные, ветвящиеся вирусы (лат. filum, нить). Средние размеры вирионов 14˟80 нм. Геном образован молекулой РНК. Нуклеокапсид организован по типу спиральной симметрии и образует тяж, покрытый суперкапсидом с гликопротеиновыми шипами длиной 7–10 нм. Для человека патогенны вирусы геморрагических лихорадок Мáрбург и Эбóла. Заболевание регистрируется в экваториальных и субэкваториальных районах Африки.
Ортомиксовирусы. В состав семейства Orthomyxoviridae включены вирусы гриппа человека (род Influenzavirus А, В и род Influenzavirus С.). Вирусы гриппа ― овальные «одетые» вирусы; вирионы часто имеют неправильную форму; их средний размер составляет 80–120 нм. Геном образован однонитевой молекулой -РНК, состоящей из 8 отдельных сегментов. Нуклеокапсид организован по типу спиральной симметрии. Суперкапсид образован липидным бислоем, который пронизывают гликопротеиновые шипы (спикулы) (рисунок 27).
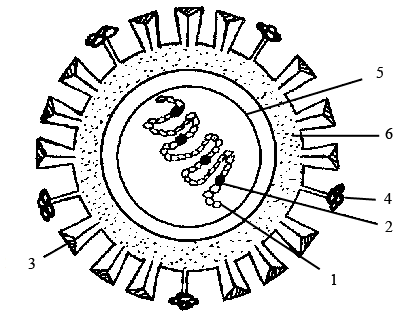
Рисунок 27 – Схема строения вируса гриппа:
1 – спираль рNP; 2 – белки pV1, pV2, pA; 3 – гемагглютинин (500–600 шипов); 4 – нейраминидаза (100–160 шипов); 5 – матриксный белок; 6 – липидный бислой
Репликация ортомиксовирусов первично реализуется в цитоплазме инфицированной клетки; синтез вирусной РНК происходит в ядре.
Наибольшую эпидемическую опасность представляют вирусы гриппа А, вирус гриппа В вызывает локальные вспышки и эпидемии, вирус гриппа С − спорадические случаи гриппа.
Буньявирусы. Семейство Bunyaviridae считается крупнейшим по количеству входящих в него вирусов (около 250). Вирионы буньявирусов имеют сферическую форму и диаметр 90–100 нм. Геном образован молекулой -РНК, состоящей из трех сегментов. Нуклеокапсид организован по типу спиральной симметрии. Снаружи нуклеокапсид покрыт двухслойным липидным суперкапсидом, на котором располагаются белковые структуры с гемагглютинирующей активностью, объединенные в форме поверхностной решетки.
В род Bunyavirus входят возбудители энцефалитов. Вирусы рода Phlebovirus вызывают различные москитные лихорадки. Род Nairovirus включает вирус Конго-крымской геморрагической лихорадки, вызывающей заболевания в России, Молдавии, Украине, на Балканах и в Африке.
Аренавирусы. Характерный морфологический признак представителей семейства Arenaviridae – наличие внутри вирусных частиц электронно-плотных зернистых структур, напоминающих песчаные вкрапления (лат. аrenа, песок). Семейство включает один род Arenavirus, представленный округлыми вирионами диаметром 110–130 нм. Геном образует однонитевая молекула -РНК, содержащая пять сегментов. Вирионы содержат транскриптазу, ответственную за синтез комплементарной нити +РНК, исполняющей роль матрицы. Нуклеокапсид окружен суперкапсидом, на котором расположены многочисленные гликопротеиновые булавовидные шипы. Все аренавирусы относятся к экологической группе робовирусов, и все виды патогенны для человека. Наиболее типичны тяжелые геморрагические лихорадки с высокой летальностью, гриппоподобные поражения, реже серозные минингиты.
Ретровирусы. В состав подсемейства Lentivirinae семейства Retro-viridae входит вирус иммунодефицита человека (ВИЧ). Характерные особенности ретровирусов – уникальное строение генома и наличие обратной транскриптазы (РНК-зависимая ДНК-полимераза). Обратная транскриптаза (или ревертаза) обеспечивает обратную направленность потока генетической информации – не от ДНК к РНК, а наоборот, от РНК к ДНК, в связи с чем семейство и получило своё название (англ., retro, обратно).
Зрелые вирионы ВИЧ имеют сферическую форму, их размеры не превышают 100–120 нм в диаметре. Геном образуют две нити +РНК; их связывают белки р6 и р7 (цифра соответствует молекулярному весу в кД). Капсид образует белок р24. Сердцевина вириона имеет цилиндрическую или конусовидную формы; её формируют белки р18 и р24. В сердцевине располагаются РНК, внутренние белки (р7 и р9), обратная транскриптаза и эндонуклеаза. Матричный белок р17 формирует прослойку между сердцевиной вириона и внешней оболочкой. Суперкапсид образован двойным липидным слоем, который пронизывают гликопротеиновые шипы. Каждый шип состоит из белков gp41 и gpl20 (рисунок 28).
Гликопротеины gp120 локализованы в выступающей части шипа и взаимодействуют с молекулами CD4 на мембранах клеток. Гликопротеины gp41 (белки слияния) располагаются внутри оболочки и обеспечивают её слияние с клеточной мембраной.
Пикорнавирусы. Семейство Picornaviridae [англ. pico, маленький и RNA – РНК] включает 4 рода: Enterovirus, Rhinovirus, Cardiovirus, Aphthovirus. Все представители этого семейства относятся к +РНК-содержащим вирусам. Молекула РНК нефрагментированная, заключена в икосаэдри-ческий капсид, построенный из 60 субъединиц и содержащий 4 уникальных полипептида. Характерной чертой является трансляция вирионой РНК в зараженной клетке с образованием единой полипептидной нити, «нарезаемой» в дальнейшем протеазами с образованием вирусоспецифических белков. Размножаются пикорнавирусы в эпителии желудочно-кишечного тракта и могут поражать эпителиальные клетки дыхательных путей.

Рисунок 28 – Схема строения вируса иммунодефицита человека
Калицивирусы. Род Calicivirus семейства Caliciviridae объединяет вирусы с «голым» кубическим капсидом диаметром 37–40 нм. Геном образован молекулой +РНК. При негативно-контрастной микроскопии на поверхности вирионов обнаруживают 32 чашечковидных вдавления, в связи с чем вирусы и получили свое название (греч. kalyx, чаша). Патогенные для человека виды вызывают гастроэнтериты и гепатиты.
Иридовирусы. Иридовирусы относятся к одноимённому семейству Iridoviridae и роду Iridovirus. В последний включены вирусы радужности насекомых. К семейству Iridoviridae, но к другому предполагаемому роду принадлежит ДНК-содержащий вирус африканской чумы свиней.
Вирусом африканской чумы свиней в природе инфицируются только свиньи (домашние и дикие виды) и мягкие клещи рода Ornithdoros (O. moubata – на юге Сахары в Африке, O. erraticus – в Португалии и Испании). Вирус передается среди клещей трансстадийно, трансовариально и половым путем. Свиньи инфицируются при укусах инфицированными клещами. Болезнь проявляется у домашних и диких европейских свиней.
Иридовирусы пойкилотерных животных выделены только от животных, имеющих водную стадию в цикле своего развития. Большинство иридовирусов насекомых предают синий или бирюзовый цвет инфицированным личинкам.
Вирион икосаэдральной симметрии. Вирусы животных имеют оболочку. Все иридовирусы содержат внутренние липидные мембрано-подобные структуры. Некоторые иридовирусы имеют многочисленные фибры, проходящие через икосаэдрон. Диаметр вирионов 130–170 нм. Это ДНК-геномные вирусы. Молекула ДНК линейная, двуспиральная. Геном иридовирусов позвоночных сильно метилирован.
Собственно вирусы беспозвоночных представлены семейством Baculoviridae, подсемейством Entomopoxvirinae (семейство Poxviridae) и родами Densovirus (семейство Parvoviridae), Iridovirus (семейство Iridoviridae), вирусами насекомых семейства Rhabdoviridae, группой вирусов цитоплазменного полиэдроза (семейство Reoviridae) и группой энтеро-вирусов беспозвоночных семейства Picornaviridae.
2.2 Фитовирусы
Фитовирусы широко распространены в природе. В разных регионах Земли они поражают самые разнообразные виды растений: дикорастущие и возделываемые, одно- и многолетние, овощные и плодовые культуры, травянистые, кустарники и деревья. Больше всего фитопатогенных вирусов выделено из цветковых растений, из папоротников и голосеменных – в редких (единичных) случаях. Размножаясь, фитопатогенные вирусы вызывают закукливание (рисунок 29 А), цветовую пестролистность, мозаику (рисунок 29 Б), скручивание (рисунок 30), бугристость и другие деформации листьев; локальный и диффузный их некроз; обезображивание плодов; задержку роста растений.
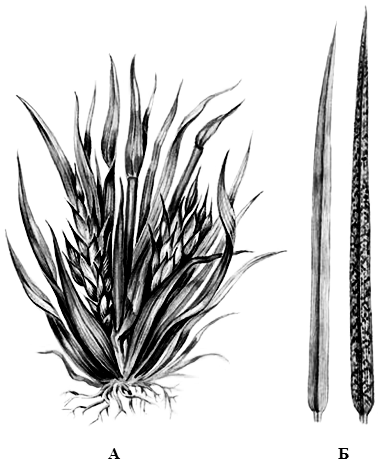
Рисунок 29 – Скручивание листьев хлопчатника (А) и мозаика пшеницы (Б)

Рисунок 30 – Скручивание листьев хлопчатника
Окончательная таксономия фитопатогенных вирусов далека от завершения, что во многом связано с трудностью их выращивания in vitro в протопластах клеток растений и однослойных культурах клеток насекомых-переносчиков, в которых не происходит полный цикл их развития.
Лучше всего изучены вирусы экономически важных культур. Среди них выделяют две группы фитопатогенных вирусов: обычные классифицированные вирусы и вироиды [греч.-eides, подобные], или вирусоподобные агенты. Подавляющее большинство классифицированных вирусов растений – РНК-вирусы семейств рабдо- и реовирусов. Исключение составляют изометрические вирусы (50 нм) мозаики цветной капусты и мозаики георгины, содержащие обычную двухцепочечную ДНК и дефектные сателлиты вируса некроза табака и кольцевой пятнистости табака с неполноценным геномом, репликация и созревание которых происходят только в присутствии родительского вируса-помощника.
Группа РНК-вирусов с полноценным геномом насчитывает около сотни видов. Большинство из них вирионы с одноцепочечной линейной цельной РНК. По морфологии их подразделяют на три подгруппы: а) бациллярные (около 10 видов), отличающиеся таким же поперечником, как и у рабдовируса желтой карликовости картофеля, имеющего размеры 380˟75 нм; б) палочковидные (более 30 видов), поперечник которых не превышает 18 нм, а длина варьирует от 300 нм, как у вируса табачной мозаики (ВТМ) и близких ему вирусов зеленой крапчатости мозаики огурца, кольцевой пятнистой орхидеи, мозаики подорожника и гороха, до 1250 нм, как у вирусов желтой свеклы и пятнистого некроза гвоздики; в) изометрические (более 30 видов), в диаметре не превышающие 30 нм, типичными представителями которых являются вирусы мозаики костра, крапчатости коровьего гороха, мозаики огурца, некротической кольцевой пятнистости сливы, кольцевой пятнистости табака, желтухи ячменя, кустистой карликовости томата, желтой мозаики турнепса.
К вирусам с двухцепочечной сегментированной РНК относят вирус раневой опухоли, геном которого состоит из 11 фрагментов, сходные с ним вирусы карликовости кукурузы и риса, сахарного тростника островов Фиджи и измельченности початков кукурузы.
Классификация вирусов растений не поднялась пока выше создания родов. Кроме вирусов растений, вошедших в семейство Reoviridae (роды Phytoreovirus и Fijivirus), и рабдовирусов растений, насчитывается свыше 20 групп (родов) вирусов, поражающих высшие растения. Отличительной особенностью многих вирусов растений является разобщенный геном, фрагменты которого находятся в различных вирионах. Для репликации таких вирусов необходимо, чтобы в клетке присутствовали вирионы, несущие в сумме полный набор генома.
Фитовирусы, содержащие геномные РНК: Carlavirus – группа вируса латентной мозаики гвоздики, Comovirus – группа вируса мозаики коровьего гороха, Cucumovirus – группа вируса огуречной мозаики, Nepovirus – группа вируса кольцевой пятнистости табака, Potexvirus – группа ХВК (вирус Х картофеля), Tobamovirus – группа вируса табачной мозаики, Tobravirus – группа вируса погремковости табака, Tombusvirus – группа вируса кустистой карликовости томатов, Tymovirus – группа вирусов желтой мозаики турнепса, Closterovirus – группа вируса желтухи свеклы, Hordeivirus – группа вируса штриховатой мозаики ячменя, Luteovirus – группа вируса желтой карликовости ячменя, Ilarvirus – группа изометрических лабильных вирусов концевых пятнистостей.
Фитовирусы, содержащие ДНК: Caulimovirus – группа вируса мозаики цветной капусты.
2.3 Методы выделения, культивирования и идентификации вирусов
Лабораторные исследования при проведении идентификации вирусов и диагностике вирусных инфекций включают следующие этапы: выделение, культивирование, индикация (выявление) и идентификация вирусов.
2.3.1 Культивирование вирусов
Вирусы не растут на искусственных питательных средах, а размножаются только внутриклеточно. Крупным достижением было предложение Р. Гудпасчура в 1932 г. использовать для культивирования вирусов куриные эмбрионы. Окончательное решение проблемы культивирования вирусов оказалось возможным лишь после того, как были разработаны основные способы культивирования клеток вне организма.
Использование куриных эмбрионов. Куриные эмбрионы – практически идеальные модели для культивирования некоторых вирусов (например, гриппа и кори). Замкнутая полость эмбриона препятствует проникновению микроорганизмов извне, а также развитию спонтанных вирусных инфекций. Эмбрионы применяют для первичного выделения вирусов из патологического материала; для пассирования и сохранения их, а также для получения необходимых количеств вируса. Некоторые возбудители (например, герпесвирусы) вызывают характерные изменения (по ним можно распознавать заболевание).
Для заражения обычно используют куриные эмбрионы 7–12-дневного возраста. Перед заражением определяют жизнеспособность эмбриона путем овоскопирования (просматривают в проходящем свете). Живые эмбрионы при овоскопировании проявляют двигательную активность, хорошо виден сосудистый рисунок. Простым карандашом очерчивают границы воздушной камеры.
Куриные эмбрионы заражают вируссодержащим материалом в асептических условиях стерильными инструментами, предварительно обработав скорлупу над воздушным пространством йодом и спиртом. Заражение проводят на хорион-аллантоисную оболочку, в амниотическую или аллантоисную полость, либо в желточный мешок (рисунок 29). Выбор метода заражения зависит от биологических свойств вируса.
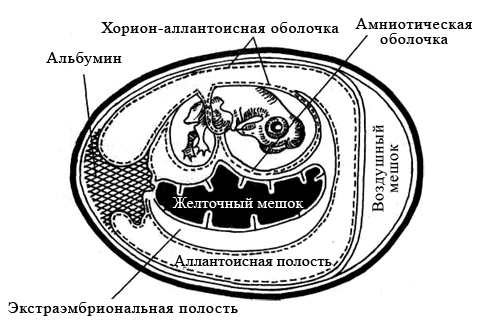
Рисунок 29 – Схематическое изображение развивающегося куриного эмбриона
Культура клеток. Вначале был использован метод переживающих тканей. Он заключался в том, что в колбу, содержащую питательную среду, вносили кусочек ткани. Клетки некоторых тканей в таких условиях могут переживать (но не размножаться) до 30 дней, а в них могут размножаться вирусы. Однако этот способ давал очень небольшой выход вирусов. Необходимо было разработать условия, при которых клетки ткани могли бы свободно размножаться.
Для получения культур клеток необходимо было решить четыре главных задачи:
-
получить в необходимом количестве свободные (т. е. изолированные друг от друга) клетки;
-
создать такие питательные среды и условия, в которых клетки могли бы активно размножаться;
-
обеспечить условия, при которых в культурах клеток не могли бы размножаться бактерии;
-
определить методы, с помощью которых можно было бы распознавать рост вируса в культуре клеток и идентифицировать его.
Для выделения изолированных (разобщенных), но жизнеспособных клеток из разрушенных тканей, стали использовать обработку их слабым раствором трипсина, разрушающего межклеточные мостики. Для культивирования клеток были предложены различные среды, содержащие все необходимые для размножения клеток питательные вещества (аминокислоты, основания, витамины и другие), минеральные соли, имеющие оптимальную рН и т. д. К питательным средам добавляли индикатор, по изменению цвета которого можно было судить о метаболизме клеток и их размножении. Было установлено, что в качестве основы, на которой клетки размножаются и образуют монослой, может быть использовано хорошо обработанное стекло пробирок и колб. Для подавления возможного роста бактерий вируссодержащий материал перед посевом его в культуры клеток стали обрабатывать антибиотиками.
В 1949 г. Дж. Эндерс, Т. Веллер и Ф. Роббинс показали, что вирус полиомиелита хорошо размножается в первично-трипсинизированных культурах клеток, полученных из почек обезьян. Основной недостаток первично-трипсинизированных клеток заключается в том, что после нескольких пересевов они перестают размножаться. Поэтому предпочтением стали пользоваться культуры таких клеток, которые способны размножаться in vitro бесконечно долго. Такие перевиваемые культуры клеток (клеточные линии характеризуются бессмертием и гетероплоидным кариотипом) получают из опухолевых тканей (HeLa получена из карциномы шейки матки, НЕр-2 – из карциномы гортани; Детройт-6 – из метастаза рака легкого в костный мозг; RН – из опухоли почки человека) или из мутантных клеток с полиплоидным набором хромосом. Однако опухолевые клетки нельзя применять для получения вакцин. Для этих целей используют только культуры таких клеток, которые не содержат никаких контаминантных вирусов и не обладают злокачественностью. Лучше всего этим требованиям отвечают культуры диплоидных клеток.
Полуперевиваемые (диплоидные) культуры клеток – клетки одного генотипа, способные in vitro выдерживать 50–100 пассажей, сохраняя при этом свой исходный диплоидный набор хромосом. Диплоидные линии фибробластов эмбриона человека используются как для диагностики вирусных инфекций, так и при производстве вирусных вакцин. Как оказалось, вирусы могут размножаться не только в культурах клеток, образующих монослой на стекле пробирок, но и в суспензиях живых клеток.
Для обеспечения жизнедеятельности культивируемых клеток необходимы питательные среды. По назначению они делятся на ростовые и поддерживающие. В ростовых питательных средах должно содержаться больше питательных веществ, обеспечивающих активное размножение клеток и формирование монослоя. Поддерживающие среды обеспечивают переживание клеток в уже сформированном монослое в период размножения в них вирусов.
2.3.2 Выделение вирусов
Выделение вирусов в культурах клеток. При выделении вирусов из различных инфекционных материалов (кровь, моча, слизистые отделяемые, смывы из органов) применяют культуры клеток, обладающих наибольшей чувствительностью к предполагаемому вирусу. Для заражения используют культуры в пробирках с хорошо развитым монослоем клеток. Перед заражением клеток питательную среду удаляют и в каждую пробирку вносят по 0,1–0,2 мл взвеси исследуемого материала, предварительно обработанного антибиотиками для уничтожения бактерий и грибов. После 30-60 мин контакта вируса с монослоем клеток удаляют избыток материала, в культуру вносят поддерживающую среду и пробы оставляют в термостате до выявления признаков размножения вируса.
Выделение вирусов на лабораторных животных. При невозможности выделить и идентифицировать вирус стандартными методами in vitro инфекционный материал вводят чувствительным к возбудителю животным, и после развития типичного инфекционного процесса проводят повторное заражение чувствительных клеточных культур. Наиболее часто используют мышей, кроликов и обезьян; для выделения некоторых вирусов (например, вирусов Коксаки) заражают мышат-сосунков. Вследствие дороговизны и сложности содержания лабораторных животных, практически повсеместно их вытеснили клеточные культуры. Тем не менее животные модели активно используют для изучения особенностей патогенеза и формирования иммунных реакций при вирусных инфекциях.
Таким образом, для выделения чистых культур вирусов в лабораторных условиях в настоящее время используются следующие живые объекты (биологические модели): 1) культура клеток (тканей, органов); 2) куриные эмбрионы; 3) лабораторные животные.
2.3.3 Индикация вирусов
Индикация вируса в курином эмбрионе. Индикация вируса в курином эмбрионе производится по гибели эмбриона, положительной реакции гемагглютинации на стекле с аллантоисной или амниотической жидкостью, по образованию фокусных поражений («бляшек») на хорион-аллантоисной оболочке.
Индикация вирусов в культурах клеток. Индикатором наличия вируса в зараженных культурах клеток может служить:
1) развитие специфической дегенерации клеток – цитопатическое действие вируса (ЦПД), имеющее три основных типа: крупно- или мелкоклеточная дегенерация; образование многоядерных гигантских клеток (симпластов); развитие очагов клеточной пролиферации, состоящих из нескольких слоев клеток (гроздевидная дегенерация клеток).
Различают два механизма гибели клеток, вызываемой вирусами, – некроз и апоптоз. Некроз происходит из-за необратимых нарушений целостности клеточных мембран, апоптоз – вследствие фрагментации ядерной ДНК под действием клеточной эндонуклеазы.
Цитопатические эффекты оценивают при микроскопии клеточных культур. По степени поражения клеток выделяют вирусы с высокой или умеренной цитопатогенностью:
2) обнаружение внутриклеточных включений, располагающихся в цитоплазме и/или в ядрах пораженных клеток;
3) положительная реакция гемагглютинации (РГА) или гемадсорбции (РГАдс). Некоторые вирусы, в частности, вирус гриппа, обладают особыми рецепторами (гемагглютининами), с помощью которых они адсорбируются на эритроцитах и вызывают их склеивание (гемагглютинацию). Такие вирусы легко обнаруживаются с помощью реакции гемагглютинации или гемадсорбции (эритроциты адсорбируются на инфицированных вирусами клетках культуры тканей);
4) феномен бляшкообразования. Широкое распространение получил предложенный в 1952 г. Р. Дюльбекко метод бляшек (негативных колоний), позволяющий производить количественное определение вирусов. Для выделения вирусов монослой клеток после удаления питательной среды заражают вируссодержащим материалом и покрывают слоем агара, содержащего индикатор нейтральный красный. Чашки (флаконы) инкубируют при 37 °С. Через 48–96 ч выявляются пятна – бляшки. Они имеют диаметр 1–3 мм и выглядят неокрашенными на розовом фоне. Пятна возникают за счет цитопатического действия вируса;
5) цветная реакция Солка. О росте вирусов в клетках можно судить с помощью индикатора, добавляемого к питательной среде. Если клетки активно осуществляют метаболизм, рН среды сдвигается в кислую сторону, и среда окрашивается в желтый цвет. В случае размножения вируса клетки погибают, рН среды мало меняется, и она сохраняет первоначальный (малиновый) цвет или (при нейтральной рН) приобретает оранжевый;
6) реакция интерференции (используется при отсутствии ЦПД, гемагглютинации и гемадсорбции): исследуемая культура повторно заражается вирусом, вызывающим ЦПД. В положительном случае ЦПД будет отсутствовать (реакция интерференции положительна). Если в исследуемом материале вируса не было, наблюдается ЦПД.
Кроме того, для обнаружения вируса в культурах клеток могут быть использованы различные серологические реакции.
Индикация вирусов на лабораторных животных. Индикация вируса основана на обнаружении у животных признаков инфекционного заболевания, регистрации их гибели, изучении характера патоморфологических и патогистологических изменений в тканях и органах, выявлении положительной реакции гемагглютинации.
2.3.4 Методы идентификации вирусов
Определение типа вируса (его идентификация) основано на нейтрализации биологической активности вируса с помощью типоспецифических сывороток. Конечный результат ее может быть установлен на основании следующих признаков:
-
нейтрализация цитопатического действия: в культуральную среду, содержащую изучаемый вирус, вносят коммерческую сыворотку (например, к вирусу краснухи при подозрении на неё), инкубируют и заражают вторую культуру; через 1–2 дня в неё вносят известный цитопатогенный вирус. При наличии цитопатогенного эффекта делают вывод о том, что первая культура была заражена вирусом, соответствовавшим антителам примененной сыворотки;
-
нейтрализация реакции гемадсорбции;
-
изменение проявления цветной пробы;
-
задержка (торможение) реакции гемагглютинации: смешивают культуральную среду, содержащую возбудитель, с известной коммерческой антисывороткой и вносят в культуру клеток. После инкубации определяют способность культуры к гемагглютинации и при её отсутствии делают заключение о несоответствии вируса антисыворотке.
-
нейтрализация в опытах на животных.
Таким образом РН (реакция нейтрализации) основана на подавлении соответствующей реакции, феномена, развития инфекционного процесса после внесения в культуру или введения в организм животного смеси вируса со специфичными AT, содержащимися в диагностической сыворотке.
Вопросы для самоконтроля
-
Назовите основные принципы классификации вирусов.
-
Приведите русские и латинские названия основных семейств вирусов человека и животных.
-
Назовите типовых представителей основных семейств вирусов и заболевания, вызываемые ими.
-
Каковы особенности морфологии и ультраструктуры вирусов человека и животных (основных семейств)?
-
Назовите РНК-геномные и ДНК-геномные фитовирусы.
-
Какие этапы включают в себя лабораторные исследования при идентификации вирусов и диагностике вирусных инфекций?
-
Какие биологические модели используются для выделения и культивирования вирусов человека и животных?
-
Как происходит заражение куриных эмбрионов в лабораторных условиях?
-
Какие методы получения культуры клеток вы знаете?
-
Как проводят идентификацию вирусов в курином эмбрионе и на лабораторных животных?
-
Какие существуют методы индикации вирусов на культуре клеток?
-
В чем заключается назначение и сущность реакций нейтрализации вирусов?
-
Назовите способы постановки реакций нейтрализации вирусов.
страница 1 страница 2 страница 3 | страница 4
|