страница 1

|
Урок химии в 11классе по теме «Классификация химических реакций»
С. В. Анищик,
учитель химии первой квалификационной категории
|
Тема: Классификация химических реакций.
Цель:
Организовать деятельность учащихся по обобщению и систематизации знаний по теме классификация химических реакций;
создавать на уроке условия для самоопределения каждого учащегося для проявления им своей индивидуальности и эмоционального восприятия материала урока; содействовать развитию у учащихся умений классифицировать химические реакции, а так же на основе анализа учебного материала делать выводы;
содействовать воспитанию интереса к предмету.
Планируемые результаты урока.
-
Учащиеся должны уметь называть типы химических реакций.
-
Определять тип химической реакции по уравнению.
-
Различать типы химических реакций по уравнениях
-
Составлять уравнения химических реакций
Тип урока: построения новых знаний.
Формы работы: индивидуальная, фронтальная, работа в парах
Оборудование и материалы урока: карточки для опроса учащихся; карточки с химическими реакциями, ПС химических элементов, учебники, сборники Хвалюк В.В..
Ход урока
-
Организационный момент.
-
Мотивация и целеполагание. Учащимся предлагается уравнение реакции они должны её классифицировать 2Н2(г) + О2(г) = 2Н2О(ж) + 572кДж на основании классификации определяются цели и тема урока.
-
Изучение нового материала. На доске нарисованы схемы. При помощи презентации учащиеся знакомятся с основными характеристиками классификации химических реакций (Слайд №1)
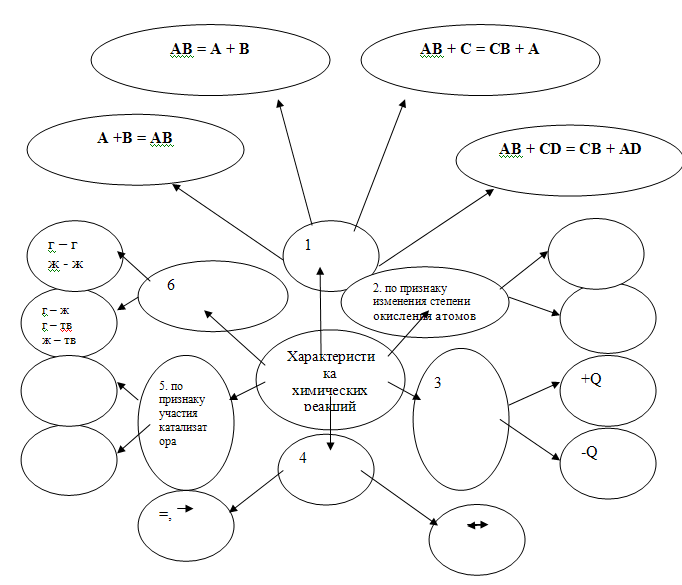
Каждая химическая реакция имеет свои характеристики. Её можно рассматривать выделяя отдельные признаки. Рассмотрим некоторые из них.
Классификация химических реакций.
Учащимся демонстрируется (слайд №2) на котором рассмотрены реакции соединения, разложения, замещения, обмена.
-
По признаку соотношения числа исходных веществ и продуктов реакции можно разделить на реакции:
-
соединения
-
разложения
-
замещения
-
обмена
После рассмотрения первого признака учащимся раздаются карточки с уравнениями химических реакций . Нужно определить какая это реакция (соединения, замещения, разложения, обмена)
Определите тип реакций.
P + Cl2 = PCl5
CH4 = C + H2
Na + S = Na2S
HCl + Mg = MgCl2 + H2
ZnSO4 + KOH = K2SO4 + Zn(OH)2
BaCl2 + Na2SO4 = BaSO4 + NaCl
AlCl3 + NaOH = NaCl + Al(OH)3
Fe(OH)3 = Fe2O3 + H2O
H2SO4 + Al = Al2(SO4)3 + H2
P2O5 + Na2O = Na3PO4
Al2(SO4)3 + Ba(NO3)2 = Al(NO3)3 + BaSO4
Далее учащимся демонстрируется (слайд № 3), где учащимся предлагается рассмотреть характеристику химических реакций по признаку изменение степени окисления атомов, входящих в состав реагирующих веществ.
2.По признаку изменения степени окисления атомов, входящих в состав реагирующих веществ реакции делят на:
1.окислительно-восстановительные
2. реакции протекающие без изменения степени окисления.
После этого учащиеся снова возвращаются к ранее полученным карточкам, где определяют тип реакции по второму признаку. После рассмотрения этого признака учащимся демонстрируется (слайд № 4), где учащиеся знакомятся с новым признаком выделение и поглощение тепловой энергии
3 По признаку выделения и поглощения тепловой энергии в ходе химических превращений реакции делят на:
1.экзотермические
-
эндотермические
Закрепление этого признака проходит во время работы по сборникам Выполняется упражнение № 342 (устно)
4.Физкульт минутка.
Учащимся предлагается рассмотреть (слайд № 5), где они знакомятся с новым признаком классификации реакции
-
По признаку направления протекания химической реакции реакции делятся на:
-
Обратимые
-
Необратимые
После рассмотрения слайда учащимся предлагается выполнить упражнение № 343 (устно) по сборникам. Нужно указать тип реакции обратимая или необратимая. Далее рассматривается следующий признак.
-
По признаку участия катализатора реакции делятся на:
-
Каталитические
-
Некаталитические
Затем учащиеся рассматривают последнюю характеристику химических реакций(слайд № 6)
-
По агрегатному состоянию реагирующих веществ реакции разделяются на:
-
Гомогенные
-
Гетерогенные
Закрепляем характеристику выполняя упражнение № 344 по сборнику.
5. Закрепление. Таким образом каждую химическую реакцию можно классифицировать по различным признакам. Вам предлагается разбиться на группы и охарактеризовать химическую реакцию. Учащиеся разбиваются на пары и дают полную характеристику полученному уравнению химической реакции.
С(ТВ) + 2Н2(г)CH4 + Q
2NH3(г) + N2(г) + 3H2(г) + Q
2H2(г) + O2(г) 2H2O (г) +Q
H2(г) + I2(г) 2HI(г) - Q
N2(г) + О2(г) 2NO (г) - Q
H2O(ж) + CO2 (г) H2CO3(ж) + Q
Рефлексия и подведение итогов. Проводится в ходе беседы по вопросам. Можно предложить учащимся сделать рассказ по теме используя опорные схемы.
7. Выставление отметок
8. Задание на дом.
страница 1
|