страница 1 страница 2
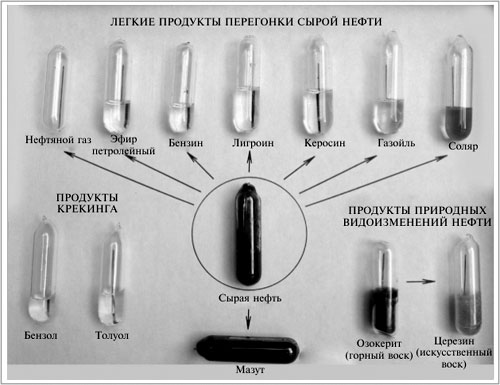
Бензин – это основное топливо для легковых автомобилей. Трактора и грузовики используют в качестве такового другой нефтепродукт – дизельное топливо (солярку). Топливом для современных самолетов является главным образом керосин. На этом небольшом примере вы можете понять, насколько важен в современной жизни такой процесс, как перегонка нефти.
|
Рис. 74. Нефть и нефтепродукты
|
Фракционная перегонка жидкого воздуха
Вы уже знаете, что любые газы смешиваются в любых соотношениях. А можно ли из смеси газов выделить отдельные компоненты? Задача не из простых. Но химики предложили очень эффективное решение. Смесь газов можно превратить в жидкий раствор и подвергнуть его дистилляции. Например, воздух при сильном охлаждении и сжатии сжижают, а затем позволяют один за другим выкипать отдельным компонентам (фракциям), поскольку они имеют различные температуры кипения. Первым из жидкого воздуха испаряется азот (рис. 75), у него самая низкая температура кипения (–196 °С). Затем из жидкой смеси кислорода и аргона можно удалить аргон (–186 °С). Остается практически чистый кислород, который вполне годится для технических целей: газовой сварки, химического производства. А вот для медицинских целей его нужно очищать дополнительно.

|
Рис. 75. Сжиженный азот хранят в специальных термосах
|
Азот, полученный таким способом, используют для производства аммиака, который в свою очередь идет на получение азотных удобрений, лекарственных и взрывчатых веществ, азотной кислоты и т.д.
Благородный газ аргон используют в особом виде сварки, которая так и называется – аргоновая.
Рассказы о веществах
Золото. Ни один металл на Земле не окутан таким ореолом таинственности и противоречивости, как золото. С незапамятных времен золото было символом власти, богатства, благополучия. Эпитетом «золотой» люди наделяли нечто очень красивое, желанное, дорогое, а сам металл нередко именовали «презренным». В то же время золото ассоциируется порой с алчностью и стяжательством, жадностью и коварством. Ради обладания этим металлом велись кровопролитные войны, совершались измены и предательства.
Алхимики всегда считали золото «царем металлов», и это не лишено оснований. Подчеркивая его совершенство, они обозначали золото знаком Солнца. Действительно, у золота красивый цвет и блеск, оно устойчиво к действию подавляющего большинства химических веществ. Недаром золото называют благородным металлом.

|
Рис. 101.Золотой самородок
|
Из-за своей химической инертности золото встречается в природе в чистом виде: в самородках (рис. 101) или в виде вкраплений в твердые породы. На россыпи золота, благодаря привлекательному внешнему виду, обратили внимание древние скотоводы, и уже в VI тысячелетии до н.э. научились обрабатывать металл кустарным способом. Благодаря мягкости (даже ноготь оставляет на нем царапину) и удивительной красоте золото стало излюбленным материалом ювелиров и художников (рис. 102).

|
Рис. 102.Возраст этой золотой маски более 3500 лет
|
Легкодоступное золото, лежащее на поверхности, вскоре было собрано, и в развитых странах древнего мира стали добывать крупинки металла, вкрапленные в кварцевые породы. Содержание металла в них не превышало нескольких граммов на тонну пустой породы. Кварц измельчали и на специальных наклонных лотках промывали водой. Благодаря очень большой плотности золотые песчинки оставались на лотке, а пустая порода уносилась потоком воды. Так же «мыли» золото артели старателей. При разрушении горных пород золото вместе с песком и глиной уносится водой в русла рек, где и образуются золотые россыпи. Только один Амур выносит в Тихий океан ежегодно 8,5 т золота. Золото – один из самых тяжелых металлов. Слиток размером с кулак весит более 3 кг! Известен рассказ древнегреческого писателя Плутарха о том, как сиракузский царь Гиерон II поручил Архимеду узнать, действительно ли из чистого золота корона, изготовленная по заказу царя. Пользуясь открытым им законом, ученый взвесил корону, а затем, погружая ее в воду, определил объем и вычислил плотность. Она оказалась меньше, чем у чистого золота. Так был разоблачен корыстный ювелир, заменивший часть золота для изготовления короны серебром. Первую в России золотую россыпь обнаружил в 1724 г. крестьянин Ерофей Марков в районе Екатеринбурга. В начале XIX в. были открыты новые месторождения золота в Сибири. С 1821 по 1850 г. в России было добыто 3293 т золота, почти в 4 раза больше, чем во всех остальных странах мира.
За 1500 лет до н. э. золото стали использовать в качестве денег. Сначала это были небольшие слитки величиной с горошину. Но нечистые на руку торговцы часто спиливали с них небольшие крупинки, отчего «горошина» становилась все легче и легче. Тогда на всю поверхность металла стали наносить клеймо, чтобы любое спиливание стало сразу заметным. При нанесении клейма «горошина» расплющивалась и превращалась в более привычную для нас плоскую монету (рис. 103).

|
Рис. 103. Золотая монета
|
Первые монеты появились в VII в. до н. э. в Малой Азии в государстве Лидия. На монетах был изображен лев – геральдический символ этого государства. С тех пор каждое вновь возникающее государство придумывало свою монетную систему, и богатство страны определялось ее золотым запасом (рис. 104).

|
Рис. 104. Изготовление золотого слитка
|
Золото – необыкновенно пластичный металл (рис. 105). Кусочек золота величиной со спичечную головку можно расплющить в просвечивающую голубовато-зеленым цветом фольгу тоньше человеческого волоса площадью 50 м2. Из золотой горошины массой 1 г можно протянуть проволоку длиной 2 км. Необычайная ковкость и тягучесть дают возможность делать из золота самые различные вещи: чаши и кубки, броши и серьги, кольца и цепи.

|
Рис. 105. Золотая фольга
|
Однако золото – достаточно дорогой металл. Поэтому в целях экономии крупинки золота прокатывали в тончайшие листочки, которыми покрывали поверхность других материалов: дерева, камня, менее ценного металла. Так золотили купола церквей (рис. 106), деревянную резьбу, украшавшую дворцы, художественные произведения (рис. 107). Позолоченные архитектурные детали и мебель органически вошли в пышное убранство дворцов далекого прошлого.

|
Рис. 106. Золотые купола христианской церкви
|
Чистое золото легко истирается. Например, золотая монета при обращении теряет каждое столетие пятую часть своего веса. Поэтому в ювелирных и технических изделиях применяют не чистое золото, а его сплавы, чаще всего с медью и серебром. Проба, стоящая на золотых изделиях отечественного производства, означает содержание золота в сплаве из расчета на тысячу его весовых частей. В России установлены следующие пробы для золота: 375, 500, 583, 750, 958. Например, проба 583 означает, что в сплаве содержится 58,3% золота, или 583 г в 1000 г сплава. Остальная масса приходится на медь.

|
Рис. 107. Позолоченные скульптуры фонтанов под Санкт-Петербургом
|
Золото очень хорошо проводит электрический ток, поэтому современная электронная техника невозможна без этого металла. В сплаве с платиной и другими металлами золото идет на изготовление химически стойкой аппаратуры. Отражательная способность и устойчивость золота позволяет использовать его для золочения некоторых поверхностей: зеркал, фотоэлементов, космических аппаратов, скафандров космонавтов.
Водород.Издавна было известно, что при взаимодействии металлов с кислотами выделяется горючий газ. Эта реакция была подробно описана М.В.Ломоносовым. Английский химик Г.Кавендиш в 1766 г. изучил свойства выделяющегося газа, определил его плотность, но был уверен, что получил горючее начало всех веществ – так называемый флогистон. Спустя несколько лет уже знакомый вам французский химик А.Л.Лавуазье определил, что этот горючий газ образован новым химическим элементом. Он установил, что при горении газа образуются пары воды, поэтому дал элементу название hidrogenium (гидрогениум) – рождающий воду, а по-русски – водород.
Молекулы водорода настолько малы, что легко проникают через различные материалы. Обычный воздушный шарик, наполненный водородом, за сутки «похудеет» раза в три. Кстати, если отпустить такой шарик, он не упадет, а полетит вверх. Неудивительно, ведь водород в 14 раз легче воздуха. Используя это свойство, водородом наполняли аэростаты для метеорологических наблюдений и гигантские дирижабли. Но такие летательные аппараты опасны: водород – горючий газ, а в смеси с воздухом образует взрывоопасные смеси. Гораздо безопаснее использовать вместо водорода гелий. Этот газ легче воздуха только в 7 раз, зато к пламени совершенно равнодушен.
Взрыв гремучего газа (так называют смесь водорода с кислородом или воздухом) – страшная разрушительная сила, однако человек давно научился извлекать пользу из самых опасных явлений. Горение водорода можно «укротить», регулируя доступ кислорода, необходимого для горения. Температура водородного пламени достигает 3000 °С: с его помощью можно резать или сваривать металлы (рис. 108).

|
Рис. 108.Пламенем водородной горелки можно резать и сваривать металлы
|
Понятно, что при горении водорода выделяется огромное количество энергии, гораздо больше, чем при сгорании бензина. Какой вывод напрашивается из этого факта? Конечно, ученые делают ставку на водород как топливо будущего. Его легко перекачивать по трубам, как природный газ. Водород можно сжигать для производства тепла, при этом в качестве продукта горения образуется обыкновенная вода. Конструкторы совместно с химиками работают над созданием водородного двигателя внутреннего сгорания для автомобилей, разрабатывают специальные источники тока, позволяющие вырабатывать электричество за счет реакции водорода с кислородом. Водородная экономика – задача очень перспективная, но одновременно и достаточно сложная. Ее решение может вполне стать делом вашей жизни, если вы решите связать ее с замечательной наукой химией.
Водород очень широко используется в химической отрасли промышленности. Это сырье для получения аммиака, некоторых кислот, с его помощью восстанавливают из руд ценные металлы. И даже в пищевой отрасли промышленности водород нашел свое применение: он превращает жидкие растительные масла в твердые жиры – основу маргаринового производства.
Несмотря на множество «земных профессий», водород без преувеличения можно назвать космическим элементом.
Трудно поверить в то, что наше Солнце – это мир раскаленного водорода. При невероятно высоких температурах и давлении на Солнце протекают реакции, называемые ядерными. Протекание ядерных реакций сопровождается выделением гигантского количества энергии. Отсюда и фантастические температуры на Солнце, и яркое свечение, и поток невидимых глазом лучей, в том числе ультрафиолетовых, «виновников» золотистого летнего загара.
Самая большая планета солнечной системы – Юпитер – также почти полностью состоит из водорода (рис. 109). Как же такое может быть, ведь водород – это газ? Конечно, газ, но только в привычных для нас условиях. Юпитер – это мир страшного холода и гигантских давлений, поэтому водород на планете находится в твердом состоянии.

|
Рис. 109. Юпитер
|
Вода. Вода – одно из самых распространенных веществ на поверхности нашей планеты, ведь почти 71% поверхности Земли занят морями и океанами. Недаром ее называют голубой планетой. Водная оболочка Земли – гидросфера. Водой в твердом состоянии – снегом и льдом – покрыто около 20% суши. В связанном виде вода находится и в земной коре – литосфере. Ученые считают, что в недрах Земли может находиться воды в десять раз больше, чем в гидросфере. Вода играет важную роль в геологической истории Земли, в ее тепловом режиме, климате, погоде, круговороте веществ.
Вода необходима каждому живому организму. Роль воды в живой клетке велика и многогранна. Она определяет не только объем и упругость клетки, это среда, в которой протекают многочисленные биохимические процессы. Вода сама участвует в сотнях химических реакций в живых клетках, например в знакомом вам процессе фотосинтеза.
Организм взрослого человека на 3/4 состоит из воды, причем ее содержание в различных органах неодинаково. Больше всего воды в глазном яблоке. Мозг человека содержит 80% воды, печень – 70%, мышцы – около 60%. И даже в костях есть вода – до 30%. Самая «безводная» часть нашего организма – эмаль зубов.
В сутки человек должен потреблять около 3 литров воды. Но это не значит, что нужно обязательно выпить 15 стаканов жидкости. Вода содержится во всех продуктах питания. В хлебе ее 40%, в мясе – 75%, в рыбе – 80%, а в овощах – более 90%. Представляете, обыкновенный огурец – это на 98% вода!
Вода необходима не только человеку и животным. Самые заправские «водохлебы» – растения. Подсолнуху для роста необходим литр воды в день, а взрослая береза высасывает из земли 60 л воды за сутки!
Почему же неприметное на первый взгляд вещество играет такую исключительную роль в природе?
Во многом это связано с необычными свойствами воды. Почти все они – исключение из общих правил. Это обстоятельство и делает воду самым удивительным веществом на планете.
В жидкой воде молекулы сцеплены между собой особыми связями, которые называют водородными. Для того чтобы «оторвать» одну молекулу воды от другой, требуется затратить довольно много энергии. Если бы водородных связей не было, вода закипала бы при температуре –80 °С, а замерзала при –100 °С. Будь вода «послушным» веществом, наша Земля превратилась бы в безжизненную пустыню: все реки, моря и океаны выкипели бы, на небе не было бы ни облачка, ни тучки.
Плотность воды тоже аномальна. Молекулы воды во льду «упакованы» так, что между ними остается довольно много «пустого места». Поэтому плотность льда меньше, чем плотность воды: лед плавает. Другого такого вещества нет! Благодаря этому аномальному свойству водоемы не промерзают до дна, и даже при самых сильных морозах температура воды подо льдом не опускается ниже +4 °С, именно при этой температуре плотность воды самая большая. В то же время вода, превращаясь в лед, приобретает огромную разрушительную силу: она способна разрушать крепчайшие горные породы, приводить в движение грозные лавины и вызывать оползни.
Если стальную иголку осторожно положить на поверхность воды, налитой в блюдце, то иголка не тонет, хотя плотность металла значительно больше плотности воды. Это явление можно объяснить большими силами поверхностного натяжения воды. Поэтому вода в свободном состоянии принимает шарообразную форму, например, капля дождя, мыльный пузырь и т.д. (рис. 110). Благодаря поверхностному натяжению по поверхности воды легко передвигаются некоторые насекомые, например клопы-водомерки (рис. 111).

|

|
Рис. 110.Капли росы стремятся принять форму шара
|
Рис. 111. Клоп-водомерка на поверхности воды
|
Вода и водные растворы находят широкое применение в промышленности и сельском хозяйстве. На получение 1 т стали расходуется 150 т воды, 1 т бумаги – 250 т, 1 т синтетических волокон – 4000 т, 1 т пшеницы – 1500 т, 1 т хлопчатника – 10 000 т воды. Вода используется как сырье в химической отрасли промышленности для получения самых различных неорганических и органических веществ.
Казалось бы, воды на нашей планете много, но следует помнить, что ресурсы чистой пресной воды, пригодной для использования, ограничены. Поэтому каждый человек должен рационально использовать и беречь от загрязнения запасы пресной воды.
Азот. Азот открыл шотландский ученый Д.Резерфорд в 1772 г. Он проводил эксперименты по сжиганию под стеклянным колпаком . древесного угля, серы и фосфора. Продукты горения поглощались раствором щелочи. Резерфорд установил, что остающаяся после этого часть воздуха – это газ, в котором свеча не горит, а мышь гибнет (рис. 93). Это и был азот, основная составная часть атмосферы нашей планеты.

|
Рис. 93. Азот не поддерживает горение
|
Название «азот» (т.е. безжизненный: от греч.а – отрицательная приставка и 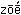 – жизнь) предложил французский химик А.Л.Лавуазье. Такое название, по мнению Лавуазье, должно было подчеркнуть свойства газообразного азота, который непригоден для дыхания и не поддерживает горение. Однако быстро выяснилось, что «безжизненный» азот – один из главных элементов жизни. Без участия соединений азота невозможно существование ни растений, ни животных. В живых организмах азот входит в состав таких важнейших органических веществ, как белки и нуклеиновые кислоты. В свою очередь белки – это те вещества, из которых построено все живое на Земле, а нуклеиновые кислоты – это соединения, которые определяют наследственные признаки. – жизнь) предложил французский химик А.Л.Лавуазье. Такое название, по мнению Лавуазье, должно было подчеркнуть свойства газообразного азота, который непригоден для дыхания и не поддерживает горение. Однако быстро выяснилось, что «безжизненный» азот – один из главных элементов жизни. Без участия соединений азота невозможно существование ни растений, ни животных. В живых организмах азот входит в состав таких важнейших органических веществ, как белки и нуклеиновые кислоты. В свою очередь белки – это те вещества, из которых построено все живое на Земле, а нуклеиновые кислоты – это соединения, которые определяют наследственные признаки.
Соотечественник Лавуазье, химик Ж.А.К.Шапталь в 1790 г. предложил переименовать азот в «нитроген» (образующий селитру). Это название используется во многих европейских странах, в частности в Англии и Франции. От этого слова произошли названия многих соединений азота. В России ни один элемент не имел в XVIII–XIX вв. столь многочисленных названий, как азот: нечистый гас, удушливый гас, огорюченный воздух, селитрород, гнилотвор, смертельный гас, нитроген и т.д. Однако именно название «азот» закрепилось в российской химической литературе.
Низкая химическая активность азота как простого вещества объясняется строением его молекулы. Она состоит из двух атомов и очень прочна. Азот вступает в химические реакции только тогда, когда разрушается его молекула. Однако даже при 3300 °С только одна молекула азота из тысячи распадается на атомы. Поэтому свободный азот так инертен в обычных условиях.
Химическая инертность азота доставляла и доставляет много хлопот химикам и технологам. Но нетрудно представить себе, как изменилась бы природа, не будь атмосферный азот столь инертен: Землю залили бы потоки азотной кислоты, в воздухе не осталось бы кислорода. Если бы кислород воздуха не был разбавлен инертным азотом, все живое было бы обречено на гибель: длительное вдыхание чистого кислорода при атмосферном давлении не менее губительно, чем его отсутствие.
В круговороте азота в природе решающую роль играют живые организмы. Особые бактерии, живущие на корнях бобовых растений (клевер (рис. 94), люпин (рис. 95), горох и др.), связывают атмосферный азот, превращая его в минеральные соли. Эти соли усваиваются растительными организмами. Современное сельское хозяйство невозможно без азотных удобрений.

|

|
Рис. 94. Клевер
|
Рис. 95. Люпин
|
Огромные количества азота в промышленности получают разделением воздуха. Более 75% чистого азота используют для синтеза аммиака, который служит исходным веществом в производстве удобрений, азотной кислоты, красителей, лекарственных препаратов, взрывчатых веществ. Газообразный азот применяется для создания инертной атмосферы при получении синтетических волокон, чистых металлов и сплавов. Жидкий азот нужен для создания низких температур.
Выдающиеся произведения живописи хранят в герметичных футлярах, заполненных азотом, чтобы предохранить краски от влаги и химически активных компонентов воздуха.
Алюминий. Впервые алюминий был получен в 1825 г. датским физиком Х.К.Эрстедом из природного глинозема с помощью электрического тока. Название металла происходит от латинского слова alumen, что означает квасцы. Квасцы – это очень важные соли серной кислоты, которые содержат в своем составе несколько металлов, в том числе алюминий.
Алюминий сразу после его открытия привлек химиков своей красотой и легкостью. Внешне походит на серебро, примерно в три раза легче железа и меди. Алюминий очень пластичен: его можно прокатать в тонкую фольгу, сделать тончайшие украшения, придать нужную форму. Вот только прочность чистого алюминия невелика, но в виде сплавов с другими металлами он заметно «крепчает». Уже созданы сплавы алюминия с прочностью в 10 раз выше, чем у стали.
Первоначально алюминий из-за несовершенного способа получения был необычайно дорог – почти в 10 раз дороже золота. Первые алюминиевые украшения и изделия были доступны только очень богатым людям. Император Наполеон III заменил серебряную посуду в своем дворце на более дорогую и редкостную – алюминиевую. Так, не ведая того, французский император заглянул в XX в., когда алюминиевая посуда стала обычной в любом доме. В знак признания выдающихся заслуг Д.И.Менделеева в Великобритании ему был преподнесен подарок – весы, одна чаша которых была сделана из золота, а другая – из алюминия.
На балах знатные дамы во времена Наполеона III нередко щеголяли ювелирными украшениями, изготовленными из алюминия.
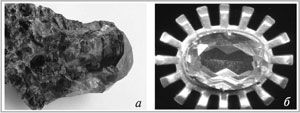
Однако химикам уже в то время было известно, что алюминий – третий по распространению в земной коре элемент (после кислорода и кремния) и самый распространенный металл. Многочисленные минералы и горные породы в своем составе содержат алюминий. Это глины, полевые шпаты, многие полудрагоценные и драгоценные камни: гранаты, рубины, сапфиры, александриты (рис. 96). Корону Российской империи украшает драгоценная шпинель, в состав которой также входит алюминий. Вот только в природных соединениях алюминий прочно связан с другими элементами. Поэтому получение алюминия требует больших затрат электроэнергии. Большая часть этой энергии расходуется на расплавление глинозема – основного природного сырья для получения алюминия.
|
Рис. 96. Природный гранат (а) и обработанный александрит (б) – полудрагоценные камни, содержащие алюминий
|
Однажды американский студент-химик Ч.М.Холл услышал от своего учителя, с какими трудностями сопряжено получение алюминия и как, должно быть, разбогатеет и прославится тот, кто предложит более дешевый способ получения этого металла. Молодой человек оборудовал небольшую лабораторию и довольно скоро обнаружил, что глинозем можно не расплавлять, а растворять в расплавленном минерале криолите. Температура плавления криолита в два раза меньше, чем глинозема, что и привело к значительному удешевлению получения алюминия.
Удивительно, что в том же 1885 г. французский металлург П.Л.Т.Эру разработал тот же самый способ получения алюминия. Более того, Эру был ровесником Холла, и оба они ушли из жизни в один и тот же год.
С открытием метода Холла–Эру производство алюминия стремительно возросло, цена металла стала падать. За последние 10 лет XIX в. его выплавка составила 28 000 т, а в 1930 г. мировое производство алюминия составило 300 000 т. Сейчас ежегодно в мире получают более 10 млн т этого металла.
Алюминий используется для изготовления проводов линий электрических передач, алюминиевых труб для нефтяной отрасли промышленности. Если поверхность алюминия отполировать, он становится очень блестящим. Это свойство металла используется для производства зеркал, прожекторов, мощных отражателей.
Пластичность и нетоксичность алюминия лежит в основе его использования в производстве различных упаковочных материалов для пищевых продуктов. Вспомните хотя бы алюминиевую фольгу для обертки шоколада или приготовления пищи, алюминиевые банки для прохладительных напитков, крышки пластиковых баночек с йогуртом.
Большая часть производимого алюминия идет на получение сплавов. Благодаря легкости и прочности они широко используются в авиационной и космической отраслях промышленности
(рис. 97). Недаром алюминий называют крылатым металлом.

|
Рис. 97. Алюминиевые сплавы – основа авиационной техники
|
Способность порошка алюминия гореть ослепительным пламенем используется в пиротехнике – производстве бенгальских огней, салютов, фейерверков (рис. 98).

|
Рис. 98.Порошок алюминия используется в пиротехнике
|
Железо. Как часто мы употребляем словосочетания: железная воля, железный характер, железные нервы. Это комплименты не только воле, характеру или нервам, это – комплимент железу, самому главному металлу современной техники.
Название «железо» скорее всего связано с санскритским корнем «жель», что означает «блестеть, пылать» и полностью соответствует внешнему облику железа: это блестящий, серебристо-белый металл.
Трудно найти другой такой металл, с которым была бы так неразрывно связана история человечества. Железо было одним из первых металлов, знакомых человеку еще в каменном веке. «Железным веком» называют период в развитии человечества, наступивший в начале I тысячелетия до н. э., когда многие народы и племена Европы и Азии научились выплавлять железо из руд. Если эпохи в жизни человечества называть по главному материалу, из которого изготавливают орудия труда, то железный век продолжается до сих пор.
В Древнем Египте железо называли «небесным металлом». Существует легенда, согласно которой царь Соломон после строительства Иерусалимского храма устроил пир в честь строителей, каждый из которых – каменщик, плотник, землекоп и другие – считал, что именно его труд в сооружении храма наиболее значимый. Мудрый Соломон разрешил этот спор так: поскольку все орудия строительства были сделаны из железа кузнецом, то главным строителем храма является именно кузнец.
Было время, когда железо, как и алюминий, ценилось дороже золота. Богачи заказывали себе украшения из железа, причем нередко в золотой оправе. Как свидетельствует в «Илиаде» Гомер, победителя игр, устроенных Ахиллом, награждали куском золота и куском железа.
Самородное железо на Земле – редкость. Чаще всего это остатки железных метеоритов. Самородное железо найдено в образцах лунного грунта, доставленного на Землю. В основном это также остатки метеоритов, которые беспрепятственно достигают поверхности Луны.
Железо входит в состав многочисленных руд и минералов. Наиболее известны красный железняк (гематит), бурый железняк (лимонит), магнитный железняк (магнетит).
Железо – металл войны. Недаром алхимики обозначали его знаком бога войны Марса: изображали щит и копье. Большинство видов оружия изготавливалось и изготавливается из сплавов железа. Вероятно, некоторые из вас слышали или читали о дамасской стали, или булате, из которой ковались уникальные сабли. Лезвие булатного клинка можно было заточить до исключительной остроты. Не уступают по качеству клинки, изготовленные отечественными мастерами из Златоуста. Не только холодное, но и огнестрельное оружие сделано из сплавов на основе железа.
Но железо – это и важнейший металл мирной техники. Это основа всех наземных и морских транспортных средств: автомобилей, железнодорожного транспорта (рис. 99), судов. Железо – это станки и оборудование, сельхозмашины и трубопроводы, строительные конструкции и техника, предметы быта и садовый инвентарь. Этот список можно продолжать бесконечно.

|
Рис. 99. Сотни тысяч километров таких путей по России так и называются: железная дорога
|
Примерно 9/10 всех используемых человеком металлов и сплавов – это сплавы на основе железа. Этого металла в мире выплавляется больше, чем всех остальных вместе взятых. К числу неоспоримых достоинств железа относится его дешевизна, доступность, ковкость, способность намагничиваться, возможность придать сплаву требуемые свойства путем введения различных добавок (легирование стали).
И все же железо не лишено недостатков. Как дамоклов меч висит над железными изделиями страшная беда – ржавчина. О процессе коррозии железа мы уже вели разговор на страницах нашего учебника.
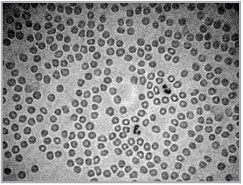
Железо – жизненно важный элемент. Он входит в состав гемоглобина крови – красного пигмента эритроцитов (рис. 100). Гемоглобин переносит кислород к каждой клеточке нашего тела. Именно железу кровь обязана своим красным цветом. При недостатке железа в организме развивается заболевание – анемия (малокровие).
|
Рис. 100. Красные кровяные тельца (эритроциты) под микроскопом
|
страница 1 страница 2
|