страница 1 страница 2



Приложение к уроку №1
Самостоятельная работа
Вариант I
1. Выпишите из приведенного перечня физических тел (предметов) и веществ названия веществ: кирпич, поваренная соль, мел, железная кнопка, вода, сахар, проволока, свеча, химический стакан, стеклянная воронка.
2. В химической посуде без этикеток находятся медь, алюминий, мрамор, уксусная кислота и поваренная соль. По каким свойствам можно распознать эти вещества? Выпишите названия веществ и наиболее характерный для их распознавания признак.
Вариант II
1. В химическом кабинете используется оборудование, сделанное из разных веществ. Например: а) стеклянные пробирки, колбы, мерные цилиндры, воронки, химические стаканы; б) железные штативы, держалки для пробирок, ложечки и тигли для прокаливания веществ; в) фарфоровые ступки, пестики, шпатели. Приведите примеры предметов, используемых в быту и изготовленных из этих же веществ.
2. Приведите пример предмета, сделанного из разных веществ.
Вариант III
1. Приведите примеры двух тел, состоящих из одного вещества, и одного тела, состоящего из разных веществ.
2. Сравните свойства: а) поваренной соли и сахара; б) меди и алюминия; в) серы и угля. Какие свойства каждой пары веществ позволяют отличить их друг от друга?
Вариант IА
1. Установите соответствие между лабораторным оборудованием и его назначением.
-
фарфоровая чашка
-
шпатель
-
мензурка
-
тигель
|
А. сосуд для измерения объема жидкости или сыпучих веществ
Б. приспособление для перемешивания смеси
В. сосуд для прокаливания веществ
Г. ложечка для взятия порции вещества
Д. посуда для выпаривания растворов
|
2. Основное назначение ступки с пестиком — это
1) длительное хранение растворов или сыпучих веществ
2)растворение веществ
3) измельчение твердых веществ
4) выпаривание растворов
3. Тонкостенная химическая посуда с круглым дном (пробирки, колбы) служит
1) для нагревания или кипячения растворов веществ
2) для длительного прокаливания веществ
3) для сохранения легко испаряющихся жидкостей
4) для смешивания твердых веществ
Вариант IIВ
1. Установите соответствие между прибором и его назначением.
-
спиртовка
-
ареометр
-
Шпатель
-
пипетка
|
А. прибор для осушения веществ
Б. прибор для взятия сыпучих веществ
В. прибор для получения газа
Г. прибор для нагревания веществ
Д. прибор для взятия определенного объема жидкости
Е. прибор для определения плотности жидкого вещества или раствора
|
2. Фарфоровая чашка служит
1) для длительного хранения растворов или сыпучих веществ
2) для перемешивания и растворения веществ
3) для измельчения твердых веществ
4) для нагревания или выпаривания растворов
3. В химических опытах при нагревании пробирки с исходными веществами ее закрепляют в держателе не посередине, а у горлышка, чтобы
1) удобно было прогреть содержимое пробирки
2) легко вынуть пробирку после окончания опыта
3) легко нагреть пробирку по всей ее поверхности
4) пробирка не растрескалась при нагревании
Приложение к уроку №1
Выращивание кристаллов соли
(домашний эксперимент)
Перед тем как приступить к выполнению работы, внимательно прочитайте ее описание до конца.
Прежде всего выберите подходящую для эксперимента соль. Для выращивания кристаллов подойдет любая хорошо растворимая в воде соль (медный или железный купорос, квасцы и т.д.). Подойдет и поваренная соль – хлорид натрия.
Из оборудования вам понадобятся:
• литровая банка или небольшая кастрюлька, в ней вы будете готовить раствор соли;
• деревянная ложка или палочка для перемешивания;
• воронка с ватой для фильтрования раствора;
• термос с широким горлышком вместимостью 1 л (он нужен для того, чтобы раствор остывал медленно, тогда будут расти крупные кристаллы).
Если нет воронки или нужного термоса, их можно сделать самому.
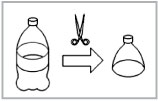
Чтобы сделать воронку, возьмите пластиковую бутылку из-под напитка и ножницами аккуратно отрежьте ей горлышко, как это показано на рис. 76.
|
Рис. 76.
Изготовление воронки
из пластиковой бутылки
|
Вместо термоса подойдет обыкновенная стеклянная литровая банка. Поставьте ее в картонную или пенопластовую коробку. Большую коробку брать не нужно, главное, чтобы в нее полностью входила банка. Щели между коробкой и банкой плотно заложите кусочками тряпки или ватой. Чтобы плотно закрыть банку, понадобится пластиковая крышка.
Приготовьте горячий насыщенный раствор соли. Для этого заполните банку наполовину горячей водой (кипяток брать не нужно, чтобы не обжечься). Порциями добавляйте соль и перемешивайте. Когда соль перестанет растворяться, оставьте раствор на одну-две минуты, чтобы нерастворившиеся кристаллы успели осесть. Отфильтруйте горячий раствор через воронку с ватой в чистый термос. Закройте термос крышкой и оставьте раствор медленно остывать два-три часа.
Раствор немного остыл. Теперь внесите в него затравку – кристаллик соли, подвешенный на нитке. После того как ввели затравку, прикройте сосуд крышкой и оставьте на продолжительное время. Чтобы вырос крупный кристалл, потребуется несколько дней или даже недель.
Обычно на нитке вырастает несколько кристаллов. Нужно периодически удалять лишние, чтобы рос один большой кристалл.
Важно записывать условия проведения эксперимента и его результат, в нашем случае это характеристики полученного кристалла. Если получилось несколько кристаллов, то приводят описание самого большого.
Изучите полученный кристалл и ответьте на вопросы.
• Сколько дней вы выращивали кристалл?
• Какова его форма?
• Какого цвета кристалл?
• Прозрачный он или нет?
• Размеры кристалла: высота, ширина, толщина.
• Масса кристалла.
Зарисуйте или сфотографируйте полученный кристалл.
Приложение к уроку №1
Для любознательных(материал для чтения)
Чистые вещества и смеси
Один из самых любимых материалов скульпторов и архитекторов – мрамор (рис. 59). Окраска этой горной породы удивительно разнообразна: молочно-белая, серая, розоватая. Причудливый узор радует глаз. Мрамор послушен и податлив в руках мастера, он легко обрабатывается и прекрасно полируется до зеркального блеска. Мрамор – это минерал, материал, из которого можно изготовить облицовочную плитку, статую или колонну дворца. Плитка, статуя, колонна – это физические тела, изделия. А вот основу мрамора составляет вещество, которое называется карбонат кальция. То же вещество входит в состав других минералов – мела, известняка.

|
Рис. 59. Мрамор – излюбленный материал скульпторов, художников, архитекторов
|
Проследим логическую цепочку взаимосвязи понятий «физическое тело» – «материал» – «вещество» еще на нескольких примерах. Полезный предмет – линейка – сделан из материала пластмассы. Скорее всего, эта пластмасса – вещество полипропилен. Оконная рама – физическое тело, древесина – материал, целлюлоза – основное вещество древесины. Лезвие ножа – стальное, сталь – это сплав, основной компонент которого – вещество железо.
А теперь давайте подумаем, почему мрамор бывает разного цвета? Почему на его поверхности играет неповторимый узор? Потому, что помимо карбоната кальция в его состав входят примеси, придающие окраску. Аналогично и линейки бывают разного цвета, который зависит от того, какой краситель добавляют в пластмассу. В состав материала резины для изготовления автомобильных покрышек входит 24 компонента, важнейшим из которых является химическое вещество каучук.
Вот и получается, что чистых веществ в природе, в технике, в быту очень немного. Гораздо чаще встречаются смеси – сочетание двух или более веществ. Воздух – это смесь различных газов; нефть – природная смесь органических веществ (углеводородов); любые минералы, горные породы – это тоже твердые смеси различных веществ.
Смеси различаются величиной входящих в их состав частиц веществ. Иногда эти частицы настолько велики, что их можно видеть невооруженным глазом. Если смешать речной песок с сахарным, вы без труда отличите отдельные кристаллики друг от друга, особенно если будете пользоваться для этой цели увеличительным стеклом. К подобным смесям можно отнести, например, стиральный порошок, кулинарные смеси для выпечки блинов или тортов, строительные смеси.
Порой частички компонентов в смесях более мелкие, не различимые глазом. Например, в состав муки входят крупицы крахмала и белка, которые невозможно увидеть невооруженным глазом. Молоко – это тоже водная смесь, в которой содержатся маленькие капельки жира, белок, лактоза и другие вещества. Увидеть капельки жира в молоке можно, если рассматривать каплю молока под микроскопом.
Агрегатное состояние веществ в смеси может быть различным. Зубная паста, например, – это смесь твердых и жидких составляющих (рис. 60).
|
Рис. 60. Зубная паста представляет собой гетерогенную смесь жидких и твердых компонентов
|
Смеси, в которых частички составляющих их веществ видны невооруженным глазом или под микроскопом, называются неоднородными или гетерогенными.
Есть смеси, при образовании которых вещества настолько «проникают друг в друга», что разбиваются на мельчайшие частицы, не различимые даже под микроскопом. Как бы вы ни всматривались в воздух, различить составляющие его газы вам не удастся. Также бесполезно искать «неоднородность» в растворах уксусной кислоты или поваренной соли в воде.
Смесь, в которой даже с помощью увеличительных приборов нельзя увидеть частицы составляющих ее веществ, называется однородной или гомогенной.
Однородные смеси по агрегатному состоянию делятся на газообразные, жидкие и твердые.
Смесь любых газов всегда гомогенна. Например, чистый воздух – это гомогенная смесь азота, кислорода, углекислого и благородных газов, водяных паров. А вот пыльный воздух – это уже гетерогенная смесь тех же газов, только содержащая еще и частицы пыли. Вам наверняка доводилось не раз видеть, как ранним утром через неплотно задернутые шторы в комнату пробиваются солнечные лучи. Пути их нередко бывают отмечены светящимися дорожками: это взвешенные в воздухе частички пыли рассеивают солнечный свет. Смог над городом или над промышленным предприятием – это тоже гетерогенная смесь: воздух, в котором содержатся не только частицы пыли, но также сажа из дыма, капельки различных жидкостей и др. (рис. 61).

|
Рис. 61.
Смог над промышленным предприятием
|
Природный газ, попутный нефтяной газ также представляют собой природные смеси газообразных веществ, основным компонентом которых является метан СН4. Тот же метан поступает в наши квартиры по трубопроводам и горит на кухне веселым голубым пламенем. Но бытовойгаз – это тоже смесь. В ее состав специально вводят резко пахнущие вещества, чтобы можно было по запаху почувствовать малейшую утечку газа. Для чего это необходимо? Дело в том, что и воздух (необходимый для дыхания всего живого), и природный газ (незаменимое топливо и сырье для химической отрасли промышленности) – это великое благо человечества, но их смесь превращается в грозную разрушительную силу из-за чрезвычайной взрывоопасности. Из сообщений средств массовой информации вы, безусловно, знаете о трагедиях, связанных со взрывами метана в угольных шахтах, взрывами бытового газа в результате преступной халатности или несоблюдения элементарных норм безопасности. Почувствовав запах газа в квартире или в подъезде своего дома, вы должны немедленно перекрыть краны и вентили, проветрить помещение, по телефону 04 вызвать специализированную аварийную службу. При этом категорически запрещается пользоваться открытым огнем, включать или выключать электроприборы.
К жидким природным смесям относится нефть. В ее состав входят сотни различных компонентов, главным образом соединения углерода. Нефть называют «кровью Земли», «черным золотом», и вам хорошо известно, насколько значительную роль в экономике нашего государства и многих других стран играют добыча, переработка и экспорт нефти и нефтепродуктов.
Безусловно, самой распространенной жидкой смесью, а точнее раствором, является вода морей и океанов. Вы уже знаете, что в одном литре морской воды в среднем содержится 35 г солей, основная часть из которых приходится на хлорид натрия. В отличие от чистой воды морская имеет горько-соленый вкус, замерзает не при 0 °С, а при –1,9 °С.
С жидкими смесями в повседневной жизни вы сталкиваетесь постоянно. Шампуни и напитки, микстуры и препараты бытовой химии – все это смеси веществ. Даже воду из-под крана нельзя считать чистым веществом: в ней содержатся растворенные соли, мельчайшие нерастворимые примеси, ее обеззараживают хлорированием. Такую воду нельзя пить некипяченой, ее не рекомендуют использовать для приготовления пищи. Специальные бытовые фильтры помогут очистить водопроводную воду не только от твердых частиц, но и от некоторых растворенных примесей. Даже растворы реактивов на водопроводной воде готовить нельзя. Воду для этого очищают методом дистилляции, о чем вы узнаете немного позже.
Широко распространены и твердые смеси. Как мы уже говорили, горные породы представляют собой смеси нескольких веществ. Почва, глина, песок – это тоже смеси. К твердым смесям можно отнести стекло, керамику, сплавы. Каждому знакомы кулинарные смеси или смеси, образующие стиральные порошки.
Скажите, одинаков ли состав воздуха, который мы вдыхаем и выдыхаем? Конечно, нет. В последнем становится меньше кислорода, зато больше углекислого газа. Но «больше-меньше» – понятия относительные. Состав смесей можно выразить количественно, т.е. в цифрах. Как? Об этом речь пойдет на следующих уроках
Способы разделения смесей по размерам частиц, плотности, магнитным свойствам
В лабораторной практике и в повседневной жизни очень часто приходится выделять из смеси веществ отдельные компоненты. Если при этом вашей целью будет получение в чистом виде каждого вещества, такую операцию называют разделением смеси. Если требуется отделить нужное вещество от примесей, процесс чаще называют очисткой вещества.
В любом случае неоднородные смеси разделить проще, чем однородные. Для этого еще во времена алхимии придумано много способов. Одни из них основаны на различии в размерах частиц смеси, другие – на особых свойствах составляющих их веществ.
Представьте, что в муку попал сахарный песок. Какой способ разделения этой смеси вы могли бы предложить? Пожалуй, самый простой – это просеивание. С помощью сита вы без труда отделите мелкие частицы муки от сравнительно крупных кристалликов сахара. В сельском хозяйстве просеивание используется для отделения семян растений от постороннего мусора. В строительстве так отделяют гравий от песка.
С помощью магнита можно легко отделить железные опилки от порошка серы (рис. 63). Такое разделение основано на особом свойстве железа – способности притягиваться к магниту.

|
Рис. 63. Отделение железных опилок от порошка серы с помощью магнита
|
А если сера смешана не с железными опилками, а, например, с песком, который к магниту совершенно равнодушен? И в этом случае можно найти способ разделения смеси.
Демонстрационный эксперимент. Смесь тонко измельченной серы и песка высыпают в стакан с водой. Песок оседает на дно, а сера удерживается на поверхности. Порошок серы можно легко отделить ложкой.
Такое разделение также основано на особом свойстве вещества, на этот раз – серы. Порошок серы плохо смачивается водой и удерживается на ее поверхности, несмотря на то, что сера тяжелее воды и должна в ней тонуть. Таким же свойством обладают и некоторые содержащие серу руды, благодаря чему их отделяют от пустой породы, т. е. обогащают. Для этого руду измельчают, загружают в огромный резервуар с водой и снизу подают воздух. Частички руды прилипают к воздушным пузырькам и в виде пены всплывают на поверхность. Тяжелые частички песка и других примесей остаются на дне.
Подобное явление можно наблюдать и дома (задания 8 и 9 к этому параграфу).
Для выделения из жидкостей нерастворимых веществ используется отстаивание. Если частички твердого вещества достаточно крупные, они быстро оседают на дно, и жидкость становится прозрачной. Ее можно осторожно слить с осадка, и эта нехитрая операция тоже имеет свое название – декантация.
Чем меньше размер твердых частиц в жидкости, тем дольше будет отстаиваться смесь.
Можно отделить друг от друга и две жидкости, которые не смешиваются между собой.
Демонстрационный эксперимент. В плоскодонную колбу наливают равные объемы воды и растительного масла. При интенсивном взбалтывании вода и масло разбиваются на мелкие капельки и перемешиваются, образуется мутная смесь. Очень быстро эта смесь снова расслаивается на более тяжелый водный слой и масло, всплывающее наверх. Отделить полностью верхний слой достаточно сложно. А вот с помощью делительной воронки разделение такой смеси не представляет труда
(рис. 64).

|
Рис. 64. Разделение двух несмешивающихся жидкостейс помощью делительной воронки
|
Если частички неоднородной смеси очень малы, ее невозможно разделить ни отстаиванием, ни фильтрованием. Примерами таких смесей могут служить молоко и взмученная в воде зубная паста. Такие смеси разделяют центрифугированием. Смеси, содержащие такую жидкость, помещают в пробирки и вращают с огромной скоростью в специальных аппаратах – центрифугах (рис. 65). В результате центрифугирования более тяжелые частички «придавливаются» ко дну сосуда, а легкие оказываются сверху.

|
Рис. 65. Центрифуга с пробирками
|
Молоко представляет собой мельчайшие частички жира, распределенные в водном растворе других веществ – сахаров, белков (рис. 66). Для разделения такой смеси применяют специальную центрифугу, называемую сепаратором. При сепарации молока жиры оказываются на поверхности, их легко отделить. Остается вода с растворенными в ней веществами – это обезжиренное молоко.

|
Рис. 66.Молоко – это мельчайшие капельки жира в водном растворе
|
Фильтрование
Очистить мутную жидкость или отделить нерастворимый осадок можно с помощью фильтрования. В лаборатории для этого используется специальная пористая бумага. Ее так и называют – фильтровальная. Частицы твердого вещества не проходят через поры бумаги и остаются на фильтре (рис. 67). Вода же с растворенными в ней веществами свободно просачивается через фильтр. Полученный раствор совершенно прозрачен. Его называют фильтратом.

|
Рис. 67. Фильтрование жидкости с осадком через бумажный фильтр
|
Фильтрование – очень распространенный процесс и в быту, и в технике, и в природе. Заварку многие процеживают через ситечко. Воздух от пыли, попавшей в пылесос, фильтруется через бумажный или тканевый фильтр. Воду для питья и приготовления пищи рекомендуют пропускать через специальные бытовые фильтры. Помимо того, что они задерживают твердые частицы, угольный порошок поглощает из воды некоторые растворенные в ней вредные вещества.
На очистных сооружениях загрязненную воду также фильтруют через слой чистого песка, на котором задерживается ил, примеси нефтепродуктов, частицы почвы и глины. Топливо и масло в двигателе автомобиля обязательно проходят через фильтрующие элементы. Клеточные мембраны, стенки кишечника или желудка – это тоже своеобразные биологические фильтры, поры которых одни вещества пропускают, а другие задерживают.
Фильтровать можно не только жидкие смеси. Не раз вы видели людей в марлевых повязках, да и самим, наверное, приходилось ею пользоваться (рис. 68). Несколько слоев марли с проложенной между ними ватой очищают вдыхаемый воздух от частиц пыли, смога, да и от болезнетворных микробов, которые «застревают» в хитросплетениях волокон. В промышленности для защиты от пыли используют специальные фильтрующие приспособления, называемые респираторами. Воздух, попадающий в двигатель автомобиля, тоже очищают от пыли тканевыми или бумажными фильтрами.

|
Рис. 68.Ватно-марлевая повязка защищает человека от болезнетворных микробов, содержащихся в воздухе
|
Адсорбция
В технике часто возникает задача очистки газов, например воздуха, от нежелательных или вредных компонентов. Многие вещества обладают одним интересным свойством – они могут «прицепиться» к поверхности пористых веществ, как железо к магниту.
Адсорбцией называется способность некоторых твердых веществ поглощать своей поверхностью газообразные или растворенные вещества.
Вещества, способные к адсорбции, называются адсорбентами.
|
Рис. 69. Активированный уголь под увеличением
|
Адсорбенты представляют собой твердые вещества, в которых много внутренних каналов, пустот, пор, т.е. они имеют очень большую общую поглощающую поверхность. Такое строение адсорбента можно рассмотреть с помощью увеличительных приборов (рис. 69). Адсорбентами являются активированный уголь (он наверняка есть в вашей домашней аптечке), силикагель (в коробке с новой обувью можно найти небольшой пакетик с белыми горошинами – это и есть силикагель), фильтровальная бумага. Различные вещества «прицепляются» к поверхности адсорбентов неодинаково: одни удерживаются на поверхности прочно, другие – слабее. На свойстве активированного угля поглощать вредные газы основано действие фильтрующего противогаза
(рис. 70).

|
Рис. 70.Внешний вид фильтрующего противогаза
|
Активированный уголь способен поглощать не только газообразные, но и растворенные в жидкостях вещества. При отравлениях его принимают для того, чтобы на нем адсорбировались ядовитые вещества.
Ученический эксперимент. В колбу с помощью пипетки накапайте 3–5 капель одеколона. Встряхните колбу, понюхайте ее содержимое. Затем добавьте в нее несколько кукурузных палочек, закройте пробкой и встряхните. Через 1–2 мин откройте пробку и понюхайте содержимое колбы. Что можно сказать об интенсивности запаха одеколона в первом и во втором случаях? Объясните результат.
С помощью активированного угля на сахарных заводах обесцвечивают сиропы, чтобы кристаллики сахара получились красивого, чистого белого цвета.
Дистилляция, или перегонка. Получение дистиллированной воды
Вода из-под крана чиста, прозрачна, не имеет запаха… Но чистое ли это вещество с точки зрения химика? Загляните в чайник: в нем легко обнаруживаются накипь и коричневатый налет, которые появляются на спирали и стенках чайника в результате многократного кипячения в нем воды (рис. 71). А известковый налет на кранах? И природная, и водопроводная вода – это однородные смеси, растворы твердых и газообразных веществ. Конечно, их содержание в воде очень мало, но эти примеси могут привести не только к образованию накипи, но и к более серьезным последствиям. Не случайно лекарства для инъекций готовят только с использованием специально очищенной воды, называемой дистиллированной.

|
Рис. 71. Накипь на нагревательном элементе электрочайника
|
Откуда взялось такое название? Воду и другие жидкости очищают от примесей с помощью процесса, называемого дистилляцией, или перегонкой. Сущность дистилляции состоит в том, что смесь нагревают до кипения, образующиеся пары чистого вещества отводят, охлаждают и вновь превращают в жидкость, которая уже не содержит загрязняющих примесей.
Демонстрационный эксперимент. На учительском столе собрана лабораторная установка для перегонки жидкостей (рис. 72).
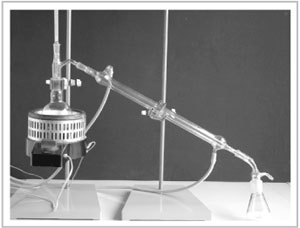
|
Рис. 72. Лабораторная установка для дистилляции жидкостей
|
В перегонную колбу учитель наливает воду, подкрашенную в оранжевый цвет растворимой неорганической солью (дихроматом калия). Так вы воочию убедитесь, что в очищенной воде этого вещества не будет. Для равномерного кипения в колбу бросают 3–4 кусочка пористого фарфора или пемзы (кипелки).
В рубашку холодильника подается вода, а перегонная колба нагревается до кипения содержимого с помощью электронагревателя. Пары воды, попадая в холодильник, конденсируются, и дистиллированная вода стекает в приемник.
Какую температуру показывает термометр? Как вы думаете, через какой отвод в холодильник подается холодная вода, а через какой она сливается?
Дистиллированная вода используется не только для приготовления лекарств, но и для получения растворов, применяемых в химических лабораториях. Даже автомобилисты используют дистиллированную воду, доливая ее в аккумуляторы для поддержания уровня электролита.
А если требуется получить твердое вещество из гомогенного раствора, то используют выпаривание, или кристаллизацию.
Кристаллизация
Один из способов выделения и очистки твердых веществ – кристаллизация. Известно, что при нагревании растворимость вещества в воде увеличивается. Значит, при охлаждении раствора некоторое количество вещества выпадает в виде кристаллов. Проверим это на опыте.
Демонстрационный эксперимент. Помните красивые оранжевые кристаллы дихромата калия, которыми учитель «подкрашивал» воду для дистилляции? Возьмем примерно 30 г этой соли и «загрязним» ее несколькими кристалликами марганцовки. Как очистить основное вещество от внесенной примеси? Смесь растворяют в 50 мл кипящей воды. При охлаждении раствора растворимость дихромата резко понижается, и вещество выделяется в виде кристаллов, которые можно отделить фильтрованием, а затем промыть на фильтре несколькими миллилитрами ледяной воды. Если растворить очищенное вещество в воде, то по цвету раствора можно определить, что марганцовки оно не содержит. Марганцовка осталась в исходном растворе.
Добиться кристаллизации твердого вещества из раствора можно упариванием растворителя. Для этого и предназначены чашки для выпаривания, с которыми вы встречались во время знакомства с химической посудой.
Если испарение жидкости из раствора происходит естественным путем, то для этой цели используют специальные стеклянные толстостенные сосуды, которые так и называются – кристаллизаторы. С ними вы также знакомились в практической работе № 1.
В природе соляные озера – это своеобразные бассейны для кристаллизации. За счет испарения воды на берегах таких озер кристаллизуется гигантское количество соли, которая после очистки попадает к нам на стол.
Перегонка нефти
Дистилляцию используют не только для очистки веществ от примесей, но и для разделения смесей на отдельные порции – фракции, различающиеся температурой кипения. Например, нефть – это природная смесь очень сложного состава. При фракционной перегонке нефти получают жидкие нефтепродукты: бензин, керосин, дизельное топливо, мазут и другие. Процесс этот ведут в специальных аппаратах – ректификационных колоннах (рис. 73). Если в вашем городе есть нефтеперерабатывающий завод, вы могли видеть эти химические аппараты, которые непрерывно разделяют нефть на важные и нужные в жизни современного общества продукты (рис. 74).

|
Рис. 73. Ректификационные колонны нефтеперерабатывающего завода
|
страница 1 страница 2
|