страница 1
УДК 547.298.61; 547.772.1; 547.789.13 На правах рукописи
Исабаева Гулсим Максутовна
Синтез, строение, свойства азот- и
серосодержащих производных некоторых гетероциклических
соединений
02.00.03 – Органическая химия
Автореферат
диссертации на соискание ученой степени
кандидата химических наук
Республика Казахстан
Караганда, 2010
Работа выполнена в лаборатории синтеза биологически активных веществ
ТОО «Институт органического синтеза и углехимии Республики Казахстан»
Научные руководители: академик НАН РК,
доктор химических наук,
профессор Мулдахметов З.М.
кандидат химических наук
Кулаков И.В.
Официальные оппоненты: доктор химических наук,
Искакова Т.К.
кандидат химических наук,
доцент Кокжалова Б.З.
Ведущая организация: Алматинский технологический
университет
Защита состоится « 31 » марта 2010 года в 14.00 часов на заседании диссертационного совета ОД 14.07.01 при Карагандинском государственном университете имени Е.А. Букетова по адресу: 100028, г. Караганда, ул. Университетская, 28, химический факультет, актовый зал.
С диссертацией можно ознакомиться в библиотеке Карагандинского государственного университета имени Е.А. Букетова.
Автореферат разослан «___» февраля 2010 года
У ченый секретарь ченый секретарь
диссертационного совета ОД 14.07.01,
доктор химических наук, профессор Салькеева Л.К.

ВВЕДЕНИЕ
Актуальность исследования. Прогрессирующий рост ряда заболеваний, в том числе и ранее неизвестных (атипичная пневмония, свиной грипп и т.д.), вызванный в значительной степени ухудшением экологической обстановки во многих странах мира, настоятельно требует интенсификации поиска новых высокоэффективных лекарственных средств. Для нашей Республики в то же время продолжает оставаться проблема создания собственной фарминдустрии, способной обеспечить население необходимыми медицинскими препаратами. Актуальность этой проблемы отражена в выступлении Президента РК Н.А. Назарбаева на заседании 12-съезда партии "Нүр Отан", в которой была озвучена программа подъема до конца 2014г. фармацевтической индустрии Казахстана и доведения рынка продукции собственными лекарственными препаратами до 50% от их общего числа.
Для решения этой непростой задачи требуются усилия многих специалистов, в том числе, и в области органической химии, занимающихся поиском, разработкой и созданием новых биологически активных соединений. Одним из самых перспективных и интенсивно развивающихся направлений в создании биологически активных соединений является синтез и модификация синтетических гетероциклических соединений, многие из которых являются аналогами природных нуклеотидов. Особый интерес в этом плане представляют азот- и серосодержащие биологически активные гетероциклические соединения, которые находят широкое применение не только в медицинской практике в качестве эффективных препаратов широкого спектра действия, но и в сельском хозяйстве, ветеринарии и других областях. Среди многочисленных N-, S-содержащих гетероциклов заслуживают особого внимания производные пиразола, тиазола, пиридина, 3,4-дигидропиримидинтиона, многие из которых еще не изучены в плане их полной фармакологической активности и интенсивно начинают исследоваться. В связи с этим синтез и поиск новых биологически активных соединений в ряду азот- и серосодержащих гетероциклических соединений, содержащих, кроме того, в структуре полифункциональные фармакофорные заместители, следует считать весьма актуальным.
Степень разработанности проблемы. Гетероциклические соединения представляют самый обширный и важный в практическом отношении класс органических соединений. Они широко распространены в природе, где играют огромную роль в таких ключевых процессах жизнедеятельности, как передача наследственных признаков, дыхание, фотосинтез, работа ферментативного аппарата. Неудивительно, что интенсивные исследования гетероциклических соединений ведутся во всех промышленно развитых странах, в том числе и с развитой фарминдустрией. Общим вопросам химии гетероциклов посвящены обстоятельные работы и монографии Р.Эльдерфилда, А.Н.Коста, В.И.Иванского, Г.И.Жингиету, Л.Пакетт, Дж.Джоуль, Г.Смит, а также многочисленные работы O.Kappe, А.Ф.Пожарского, Г.А.Толстикова, Б.А.Трофимова, И.П.Белецкой, Л.И.Беленького, А.В.Аксенова, И.П.Скрастиньш, В.Д.Орлова и многих других.
Связь работы с планом государственных программ. Диссертационная работа является частью исследований, проводимых в Институте органического синтеза и углехимии РК по темам: «Создание научных основ получения новых перспективных материалов на базе химически модифицированных продуктов переработки угольного сырья (комплексные удобрения, мелиоранты, деоксиканты и структурообразователи почв, сорбенты для очистки сточных вод, ингибиторы коррозии металлов, лекарственные средства, электронные материалы и высококачественное синтетическое жидкое топливо)» (2006-2008 гг. гос.рег.№ 0106 РК 01031); «Синтез и изучение закономерностей направленной химической модификации новых полифункциональных серо- и галогенсодержащих биоактивных соединений на основе углеводов» (2009-2011 гг. гос. рег. №0109РК00430).
Цель работы заключается в поиске и разработке целенаправленного синтеза новых азот- и серосодержащих гетероциклических производных, сочетающих в своей структуре физиологически активные полифункциональные фармакофорные заместители, в изучении механизма их образования, установлении строения и реакционной способности, а также в проведении скрининговых исследований биологической активности некоторых синтезированных соединений.
Научная новизна работы определяется тем, что впервые:
-
взаимодействием 3,5-диметилзамещенного пиразола с некоторыми изотиоцианатами в мягких условиях получены и охарактеризованы новые тиомочевинные и тиазолиновые производные, установлено пространственное строение продукта циклизации 5-(бромметил)-2-(3,5-диметил-1H-пиразол-1-ил)-4,5-дигидротиазола;
-
изучено нуклеофильное замещение 4-бром-3,5-диметилпиразола 2,6-дибром-, 2,6-дихлор- и 2,6-дийод-4-нитроанилидами 2-бромуксусной кислоты;
-
проведена конденсация (1, 3, 5 -триметил-1-Н-пиразол-4-ил)метанамина с моносахаридами d-глюкоза и d-галактоза;
-
синтезированы новые аминоацильные производные алкалоида цитизин и биогенного амина морфолин, содержащие в своей структуре физиологически активный 5-бромпиридиновый цикл;
-
изучена особенность реакции взаимодействия бензилдитиокарбамата триэтиламина с n-нитрофенилоксираном в циклический 3-бензил-5-(4-нитрофенил)тиазол-2(3H)-тион, установлено, что на процесс ароматизации тиазолидинового кольца в тиазолиновое на конечной стадии реакции существенное влияние оказывает наличие нитрогруппы в исходном реагенте или добавленное извне;
-
осуществлен синтез -N-(метакрилоилкарбамотиоил)изоникотингидразида и изучена его внутримолекулярная гетероциклизация под действием аминов в соответствующее -N-(5-метил-4-оксо-5,6-дигидро-4H-1,3-тиазин-2-ил) производное, строение которого доказано рентгеноструктурным анализом;
-
проведено алкилирование 4-арилзамещенных 3,4-дигидропиримидин(1Н)-2-тионов метиловым эфиром хлоруксусной кислоты, установлено, что в процессе реакции происходит циклизация в бициклические 3,5-дигидро-2H-тиазоло[3,2-a]пиримидины, строение одного из которых доказано РС-анализом;
-
на основе 1,4-дигидропиридинового цикла осуществлен синтез дизамещенного производного алкалоида цитизин;
-
проведены первичные скрининговые испытания соединений на ростстимулирующую и антибактериальную активности.
Практическая значимость работы. Осуществлен синтез и установлено строение 24 новых полифункциональных азот- и серосодержащих гетероциклических производных 3,5-ди- и 1,3,5-триметилзамещенного пиразола, пиридина, тиазолин-2тиона, 1,3-тиазина, тиазоло[3,2-a]пиримидина, представляющих огромный интерес в качестве объектов изучения теоретических и препаративных вопросов органической химии, а также дальнейшего изучения их биологической активности. Разработаны и изучены оптимальные методы их получения, установлены некоторые аспекты и механизмы их образования, биологическая активность, а также пространственное строение трех производных, сведения о которых пополнят базу данных БАВ и Кембриджский Банк структурных данных, что существенно позволит облегчить установление взаимосвязи «структура-биоактивность».
На защиту выносятся следующие основные положения:
- результаты разработки оптимальных условий синтеза, изучение реакционной способности, установления строения новых полифункциональных производных некоторых азот- и серосодержащих гетероциклов;
- результаты обоснования протекающих механизмов внутримолекулярной гетероциклизации и образования новых производных гетероциклов с использованием физико-химических методов исследования (ИК-, ЯМР 1Н-, ЯМР 13С-спектроскопия, масс-спектрометрия и РСА);
- результаты исследования первичной биологической активности полифункциональных производных некоторых N- и S-содержащих гетероциклов.
Апробация работы. Основные результаты диссертационной работы представлены и обсуждены на Международной научно-практической конференции «Современное состояние и перспективы развития науки и высшего образования в Центральном Казахстане» (Караганда, 2008), на Международной конференции по химии и химической технологии «VI Беремжановские чтения» (Караганда, 2008), на XI молодежной конференции по органической химии (Екатеринбург, 2008), на II Международной научной конференции «Инновационное развитие и востребованность науки в современном Казахстане», (Алматы, 2008), на международной научной конференции "Актуальные проблемы химии природных соединений" (Ташкент, 2009) и на Международной научно-практической конференции «Наука и ее роль в современном мире» (Караганда, 2010).
Публикации. По теме диссертационной работы опубликовано 13 печатных работ, из них 7 статей в журналах, входящих в рекомендуемый список ККСОН МОН РК, 3 из них в журнале «Известия НАН РК. Серия химическая», 1 статья в «Химическом Журнале Казахстана», 3 статьи в международном журнале «Химия Гетероциклических Соединений» и 6 материалов и тезисов международных конференций.
Структура и объем диссертации. Диссертационная работа состоит из введения, основной части, в которой представлены данные литературного обзора, результаты обсуждения собственных работ и экспериментальных данных, заключения, списка использованных источников и приложения. Объем диссертации 121 страница, в том числе 22 рисунка и 20 таблиц, список использованной литературы включает 104 наименования. В приложении представлены восемь актов испытаний биологической активности.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
1 Общая характеристика азот- и серосодержащих гетероциклических соединений
В данном разделе приведен литературный обзор по химии и биологической активности выбранных классов N,-S- содержащих гетероциклических производных (пиразола, тиазола, пиридина, 3,4-дигидропиримидинтиона и 1,4-дигидропиридина).
2 Синтез, строение, свойства азот- и серосодержащих производных некоторых гетероциклических соединений 2.1 Синтез тиомочевинных и тиазолиновых производных пиразола
Среди гетероциклических соединений, вследствие препаративной доступности, особое место занимают производные пиразолов. За последние годы это вызвано все большим применением его производных в качестве лекарственных препаратов, красителей, люминесцентных веществ. Среди фармацевтических препаратов с пиразольным гетероциклом особое значение приобрели производные антипирина, амидопирина и анальгина, проявляющие жаропонижающее и болеутоляющее действие. Обнаружена также высокая противодиабетическая активность 1-замещенных производных 3,5-диметилпиразола. В то же время, на основе базового пиразольного фрагмента, соединения, содержащие тиомочевинные или тиоамидные группировки, в литературе практически не описаны.
С этой целью нами на основе 4-бром-3,5-диметилпиразола осуществлено взаимодействие с аллилизотиоцианатом, 2,3-дибромпропилизотиоцианатом, 4-бромбензоилизотиоцианатом и 2-фуранкарбоксоизотиоцианатом. Синтез ацильных изотиоцианатов проводили препаративно удобным методом in situ (без выделения), нагреванием соответствующих хлорангидридов с KSCN в среде ацетона.
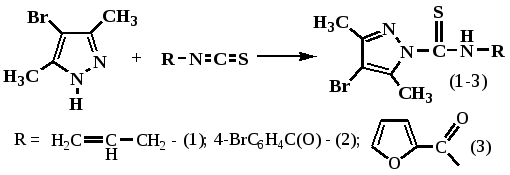
Установлено, что реакция 4-бром-3,5-диметилпиразола с выбранными изотиоцианатами, в отличии от простых и более основных алициклических и ароматических аминов, протекает продолжительнее и требует нагрева реакционной смеси до 50 0С. При использовании в реакции с 4-бром-3,5-диметилпиразолом и 3,5-диметилпиразолом 2,3-дибромпропилизотиоцианата, как и было ранее описано происходит внутримолекулярная гетероциклизация промежуточно образующейся 2,3-дибромпропилзамещенной тиомочевины.
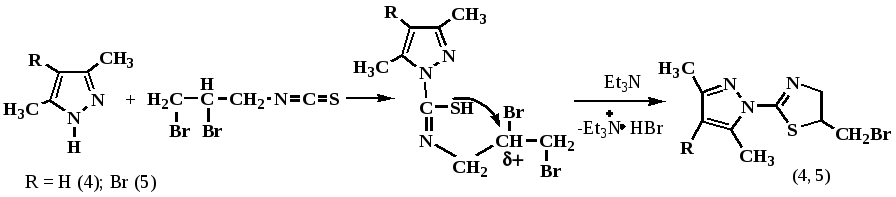
Полученные с выходом 96 и 65% бромметильные тиазолиновые производные 3,5-диметилпиразола (4) и 4-бром-3,5-диметилпиразола (5) представляют собой хорошо кристаллизующиеся белые кристаллические вещества, растворимые во многих органических растворителях.
В ИК-спектрах полученных соединений (1-5) присутствуют полосы поглощения в области 1545-1535см-1 и 1685-1689 см-1, характерные для C=S группы и для амидной группы C(O)NH. В спектре ЯМР 1Н соединения (1) в области 2,08 и 2,15 м.д. присутствуют интенсивные узкие синглеты почти эквивалентных CH3- протонов пиразольного кольца. Аллильные протоны СН2= тиомочевинного фрагмента проявляются четким квартетом дублетов в области 5.10-5.35 м.д. с КССВ J1 = 17,01 и J2 = 10,2 Гц. Метиновый протон при двойной СН= связи проявляется сложным мультиплетом с центром 5,91 м.д. В масс-спектре соединения (1) с m/z и относительной интенсивностью Jотн.(%) помимо двух пиков молекулярного иона 273, 275 [М]+(10,5%) имеются фрагменты распада молекулы по N-C(S) связи с базовым 4-бром-3,5-диметилпиразольным фрагментом: 176, 174 (100%), а также другие осколки: 242, 240 (70%), 95 (39%), 41 (62%), 39 (90%).
|
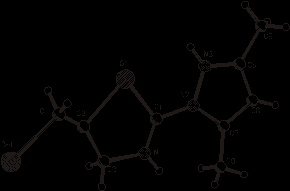
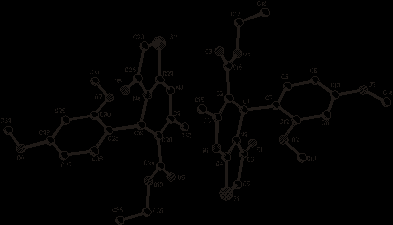
С целью установления пространственного строения молекулы 5-(бромметил)-2-(3,5-диметил-1H-пиразол-1-ил)-4,5-дигидротиазола (4) проведено его рентгеноструктурное исследование. Общий вид молекулы (4) приведен на рисунке 1.
|
Рисунок 1 – Пространственное строение молекулы (4)
| 2.2 Синтез галогензамещенных производных нитроанилидов на основе 4-бром-3,5-диметилпиразола
Комбинация в структуре гетероциклических соединений других, не менее важных физиологически активных группировок, может привести не только к усилению биологической активности, но и к появлению других, новых видов биологической активности. Наличие галоидных заместителей в структуре гетероциклов приводит к усилению терапевтического эффекта за счет повышения липофильности образующихся веществ. Одновременное наличие атомов галогенов и нитрогруппы в составе молекулы приводит к наличию у веществ высокой антигельминтной активности.
В продолжении ранее проведенных исследований, нами осуществлено алкилирование 4-бром-3,5-диметилпиразола 2,6-дигалоид-4-нитробромацетанилидами с образованием искомых продуктов (6-8).
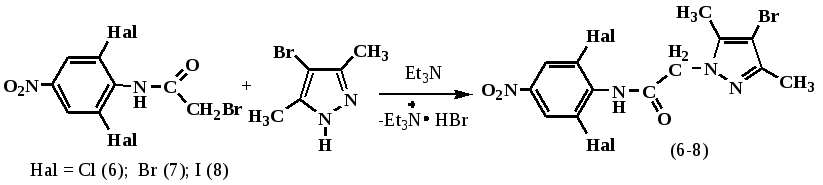
Синтезированные соединения (6-8) представляют собой белые (или чуть желтоватые) кристаллические вещества, хорошо растворимые в ДМФА, ДМСО, трудно в горячих полярных растворителях. В ряду соединений (6)→(7)→(8) увеличивается температура плавления соединений.
Состав и строение полученных соединений (6-8) подтверждены данными ИК-, ЯМР 1Н- спектроскопией и масс-спектрометрией. В ИК-спектрах полученных соединений (6-8) присутствует интенсивная полоса поглощения карбонильной группы в области 1685 см-1, нитрогруппы в области 1520 и 1350 см -1.
2.3 Конденсация моносахаридов D-глюкоза и D-галактоза с (1, 3, 5 –триметил-1-Н-пиразол-4-ил)метанамином
Известно, что введение углеводных остатков в структуру биологически активных соединений приводит к увеличению водной растворимости препаратов и к резкому снижению их токсичности, что позволяет рекомендовать метод гликозилирования физиологически активного соединения по гликозидному центру сахаров как один из возможных путей получения малотоксичных лекарственных средств.
В связи с этим нами на основе моносахаридов D-глюкозы, D-галактозы и аминопроизводного пиразола – (1, 3, 5 -триметил-1-Н-пиразол-4-ил)метанамина (9) были предприняты попытки синтеза соответствующих N-аминогликозидов. Установлено, что конденсация моносахаридов d-глюкозы и d-галактозы с небольшим избытком (9) проходит в довольно мягких условиях при температуре 50-55 0С, в спиртовой среде, в течении 4 часов, без добавления кислотного катализатора, что несомненно связано с достаточной основностью исходного амина.
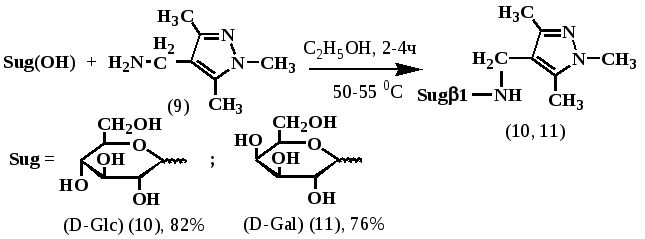
Следует также отметить, что конденсация моносахаридов d-глюкозы и d-галактозы с 3,5-диметилпиразолом и его 4-бромзамещенным производным – 4-бром-3,5-диметилпиразолом не удается получить соответствующие N-аминогликозиды даже при многодневном кипячении и использовании катализаторов.
Полученные на основе (9) N-аминогликозиды хорошо растворяются в воде и являются устойчивыми при нормальных условиях кристаллическими веществами, частично осмоляющихся при длительном нагревании их спиртовых растворов.
При анализе ЯМР 1Н-спектра соединения (10) установлено, что аномерный протон углеводного остатка проявляется триплетом (взаимодействие с соседним протоном пиранозного кольца и N-H протоном аминной функции) при 4,38 м.д. с КССВ J = 5,71 Гц, характерной для -аномера.
2.4 Синтез и реакции замещения бромацетильного производного 2-амино-5-бромпиридина
Производные пиридина широко используются не только в медицинской практике в виде лекарственных препаратов с разнообразным терапевтическим действием, но и в сельском хозяйстве в качестве эффективных фунгицидов, гербицидов и ростстимулирующих веществ.
С целью получения производных алкалоида цитизина и морфолина, содержащих в своей структуре фармакологически активную аминопиридиновую группировку, нами осуществлены следующие превращения. Вначале, ацилированием 2-амино-5-бромпиридина бромангидридом бромуксусной кислоты в среде безводного ДМФА при небольшом охлаждении, получен в виде гидробромида 2-бром-N-(5-бромпиридин-2-ил)ацетамид (12). Далее проводили замещение атома брома в 2-бром-N-(5-бромпиридин-2-ил)ацетамиде (12) на алкалоид цитизин и морфолин, кипячением суспензии искомого гидробромида в абсолютном толуоле (или в диоксане) в присутствии трехкратного избытка триэтиламина.
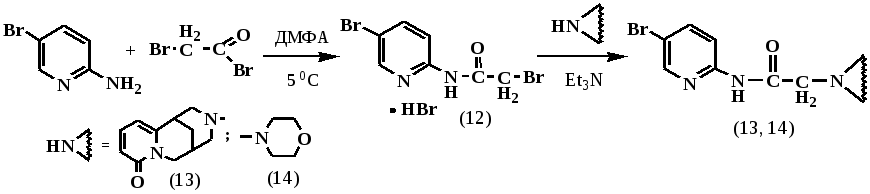
Полученные соединения (13, 14) после двух перекристаллизаций представляют собой белые кристаллические вещества, растворимые в большинстве органических растворителях, кроме предельных углеводородов.
Масс-спектр (13) (ЭУ, 70 эВ), m/z (Iотн %): 402 [M]+ (16), 404 [M]+ (12), 230 (31), 203 (53), 58 (98), 42 (29). В ЯМР 1Н-спектре соединения (13) присутствуют протоны как алкалоидного фрагмента, так и пиридинового остатка.
2.5 Синтез 3-бензил-5-(4-нитрофенил)тиазол-2-(3H)-тиона на основе 4-нитрофенилоксирана, бензиламина и сероуглерода
Ранее сотрудниками нашей лаборатории было показано на единичном примере, что взаимодействие 2-винилоксиэтилдитиокарбамата триэтиламина с n-нитрофенилоксираном приводит к циклизации и ароматизации промежуточного тиазолидинового кольца в тиазолиновое – 3-[2-(винилоксиэтил)]-5-(4-нитрофенил)-1,3-тиазолидин-2-тиону. С целью возможного установления механизма обнаруженной реакции циклизации и ароматизации, нами были проведены реакции на других примерах. Так, осуществлен синтез бензилдитиокарбамата триэтиламина (15). Далее полученным дитиокарбаматом (15) проводили раскрытие оксиранового цикла в 4-нитрофенилоксиране. Реакцию проводили в спиртовой среде при эквимольном соотношении реагентов по схеме:
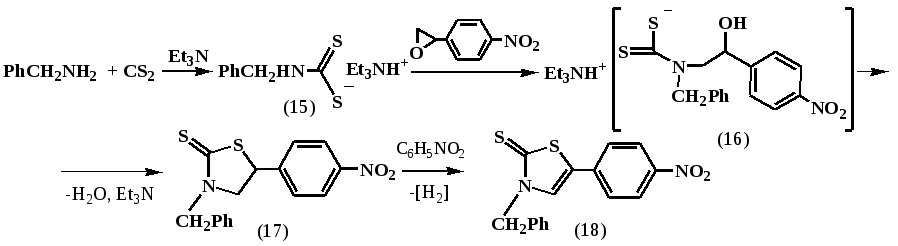
При этом, нами аналогично по вышеописанной схеме из реакционной среды выделен с выходом около 30% продукт циклизации промежуточно образующегося дитиокарбаматного производного аминоэтанола (16) – 3-бензил-5-(4-нитрофенил)тиазол-2(3H)-тион (18). По-видимому, процесс идет через последовательные стадии образования дитиокарбамата (15), нуклеофильного раскрытия им оксирана до промежуточного дитиокарбаматного производного аминоэтанола (16), его спонтанной циклизацией в тиазолидин (17) и, наконец, окислительной ароматизацией с образованием конечного продукта – 3-бензил-5-(4-нитрофенил)тиазол-2-(3H)-тиона (18), представляющего собой кристаллическое вещество ярко-желтого цвета с высокой температурой плавления.
Состав и строение соединения (18) доказаны данными ИК- и ЯМР 1Н, 13С-спектроскопии, масс-спектрометрии. В масс-спектре соединения (18) четко выявлен молекулярный ион 328 [M]+ с Iотн 45%. В спектре ЯМР 1Н соединения (18) в области 5,42 м.д. выписывается синглет метиленовых протонов СН2 бензильного радикала. В области 7,38 м.д. проявляется мультиплет пяти фенильных протонов. В более слабой области спектра при 7,76 и 8,27 с КССВ J = 8,9 Гц выписываются в виде двух дублетов протоны 4-нитрофенильного кольца. Ароматический протон тиазолинового кольца проявляется синглетом в самой слабой области спектра при 8,55 м.д.
Для подтверждения участия нитрогруппы в процессе дегидрирования тиазолидинтиона (17) в тиазолинтион (18) мы провели аналогичную реакцию, на конечной стадии которой прибавили двойной избыток нитробензола. Таким образом, после обработки синтеза методом ГЖХ был обнаружен продукт восстановления нитробензола – анилин. При этом выход (18) удалось повысить почти до 50% за счет добавления окислителя извне и, соответственно, меньшего расхода нитросодержащих молекул реагентов на процесс окисления тиазолидинового кольца.
2.6 Синтез и внутримолекулярная гетероциклизация -N-(метакрилоилкарбамотиоил)изоникотингидразида
Несмотря на наличие огромного количества используемых в клинике туберкулеза лекарственных средств, гидразид изоникотиновой кислоты (ГИНК) и в настоящее время занимает ведущее место в лечении различных форм туберкулеза. На его основе синтезировано множество различных производных с широкой вариацией противотуберкулезной активности и токсичности соединений.
С этой целью, известным изотиоцианатным способом, взаимодействием гидразида изоникотиновой кислоты с метакрилоилизотиоцианатом, полученным in situ, нагреванием метакрилоилхлорида с роданистым калием в среде ацетона, было получено соответствующее тиосемикарбазидное производное (19).
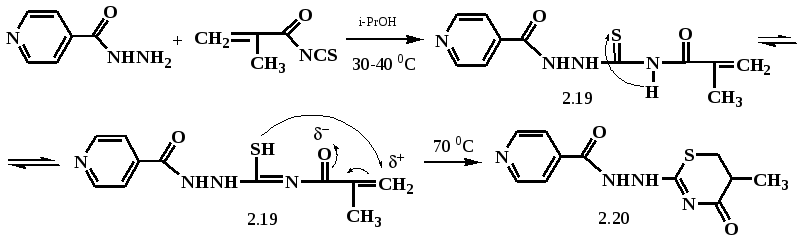
Реакция протекает при температуре 30-40 0С в среде 2-пропанола.
При увеличении продолжительности реакции до 16 ч и повышении температуры реакционной смеси до 70 0С, было замечено, что исходная суспензия тиосемикарбазида (19) растворяется в спиртовой среде и происходит образование другого продукта реакции. В результате чего было сделано предположение, что в результате образуется продукт внутримолекулярной гетероциклизации соединения (19) – -N-(5-метил-4-оксо-5,6-дигидро-4H-1,3-тиазин-2-ил)изоникотингидразид (20). Циклизация соединения (19) в 5,6-дигидро-1,3-тиазин-4-он (20), видимо, происходит посредством внутримолекулярной нуклеофильной атаки атома серы в тиольной форме по электронно-дефицитному атому углерода при ненасыщенной С=С связи. Образование циклического 5,6-дигидро-1,3-тиазин-4-она (20) доказано отсутствием в спектре ЯМР 1Н концевых метиленовых протонов =СН2, проявляющихся для соединения (19) двумя дублетами при 5,73 и 6,02 м.д., а также синглета амидного N-H протона при 12,15 м.д., участвующего в необходимой при циклизации тион-тиольной перегруппировке. Кроме того, в спектре ЯМР 1Н соединения (20) происходит расщепление метильных протонов -СН3 на дублет, свидетельствующее об их взаимодействии с метиновым СН-протоном тиазинового кольца, также свидетельствующих в пользу образования соединения (20) по вышеописанной схеме циклизации.
При эквимольном взаимодействии (19) с циклическими вторичными аминами (морфолин, пиперидин), а также алкалоидами анабазин и цитизин в растворе этанола или 2-пропанола при температуре около 30 0С были выделены не ожидаемые продукты присоединения к атому углерода при активированной двойной С=С связи, а продукт гетероциклизации соединения (19) в 5,6-дигидро-1,3-тиазин-4-он (20). При этом реакция циклизации проходила в течении 1 часа и на ход реакции, выход продукта (20) совершенно не влияла как структура, так и основность исходных аминов и алкалоидов. В данном случае реакция циклизации тиосемикарбазида (19) в (20) значительно ускорялась введением сильных оснований, увеличивающих, вероятно, образование тиольной формы соединения (19).
С целью более полной идентификации, а также изучения возможной N-H таутомерии между гидразидным и тиазиновым фрагментом и установления пространственного строения соединения (20) было проведено его рентгеноструктурное исследование. Структура молекулы (20) приведена на рисунке 2.
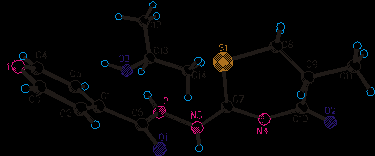
|
Было установлено, что в исходной упаковке снятого кристалла присутствует также молекула используемого при перекристаллизации соединения (20) растворителя (2-пропанола). Образование такого сольвата объясняется наличием сильной водородной связи N2H2a…O3 (x, y, z).
|
Рисунок 2 – Пространственное строение сольвата соединения -N-(5-метил-4-оксо-5,6-дигидро-4H-
1,3-тиазин-2-ил)изоникотингидразида (20)
| 2.7 О реакции алкилирования 4-арилзамещенных 3,4-дигидропиримидин(1Н)-2-тионов метиловым эфиром хлоруксусной кислоты
В последнее время в научной литературе значительно увеличивается число публикаций по химии 3,4-дигидропиримидин-2-тионов, получаемых трехкомпонентной конденсацией по реакции Биджинелли, что связано не только с их препаративной доступностью, но и с проявлением ими широкого спектра фармакологической активности - анальгетической, антибактериальной антигипертензивной.
С целью получения на основе 4-арилзамещенных 3,4-дигидропиримидин(1Н)-2-тионов (21-26) производных 3,5-дигидро-2H-тиазоло[3,2-a]пиримидинов нами был разработан новый препаративно более доступный метод получения, заключающийся в кипячении толуольных растворов 4-арилзамещенных 3,4-дигидропиримидин(1Н)-2-тионов (21-26) с небольшим избытком метилового эфира хлоруксусной кислоты в присутствии триэтиламина.
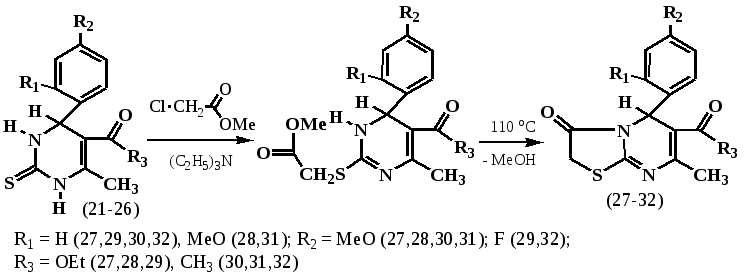
При проведении реакции предполагалось, что реакция остановится на стадии образования одного из промежуточных продуктов S- либо N- алкилирования, образование которых зависит от применяемых растворителей и акцепторов, влияющих, вероятно, на процесс тион-тиольного перехода. Однако, практически с 84-90%-ным выходом были выделены целевые продукты циклизации (27-32), представляющие собой светло-оранжевые и светло-коричневые кристаллические вещества, хорошо растворимые в горячих бензоле, этилацетате, этаноле.
Образование 3,5-дигидро-2H-тиазоло[3,2-a]пиримидинов (27-32) доказано отсутствием в ИК-спектрах полос поглощения валентных колебаний аминогрупп N-H в области 3300 -3100 см-1 по сравнению с исходными 3,4-дигидропиримидин(1Н)-2-тионами (21-26) и появлением колебаний карбонила С=О в циклической тиазольной системе в области 1740-1730 см-1. В спектрах ЯМР 1Н соединений (27-32) отсутствуют сигналы N(3)-H протонов, проявляющихся в исходных соединениях и продуктах их N(1)-моноалкилирования в виде дублетов в области 9.2 м.д. Метиленовые протоны СН2 тиазолового кольца оказываются неэквивалентными и проявляются дублет дублетами с высокой КССВ J = 17.7 Гц.
|
С целью возможного установления пространственного строения бициклических тиазолопиримидинов, нами осуществлено рентгеноструктурное исследование соединения (28). Пространственное строение молекулы (28) представлено на рисунке 3. Установлено, что (28) состоит из двух геометрически независимых молекул (28a) и (28b), расположенных в одной независимой ячейке.
|
Рисунок 3 – Пространственное строение
молекулы (28)
| 2.8 Синтез 1,4-дигидропиридиновых производных алкалоида цитизин
В последнее время в медицинской практике широко начали использовать новый класс гетероциклических соединений с базовой 1,4-дигидропиридиновой основой, обладающих высокой антигипертензивной и ноотропной активностью. Вместе с тем в литературе не описаны производные 1,4-дигидропиридинов, содержащие алкалоидные заместители.
В связи с этим, нами по известной методике, бромированием соответствующих диэтил-4-(4-арил)-2,6-диметил-1,4-дигидропиридино-3,5-дикарбоксилатов двойным избытком бромсукцинимида получили соответствующие дибромметильные производные (35, 36), которые использовали далее в реакциях нуклеофильного замещения. Так, при взаимодействии бензольных растворов (35, 36) с двойным количеством цитизина, в присутствии избытка триэтиламина при комнатной температуре и интенсивном перемешивании в течении суток, нами выделены с выходом около 70% продукты алкилирования (37, 38).
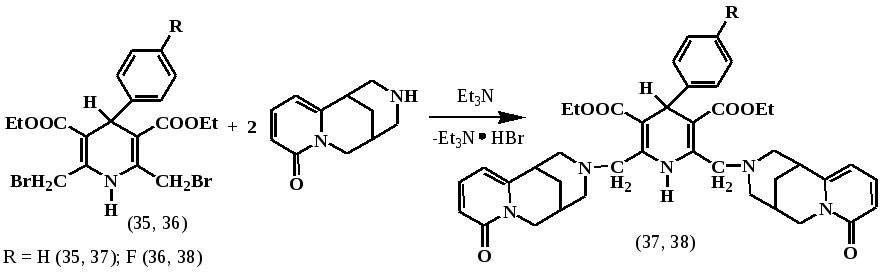
Продукты реакции (37, 38) выделяли после колоночной хроматографической очистки над силикагелем и оксидом алюминия (1:1) с последующей перекристаллизацией. Полученные дизамещенные производные (37, 38) представляют собой белые кристаллические вещества, легко растворимые во многих органических растворителях, кроме предельных углеводородов.
Состав, строение и индивидуальность синтезированных соединений (37, 38) подтверждены данными ИК- и ЯМР 1Н -спектроскопии. ЯМР 1Н - спектр соединения (37) показал не только синглеты N-H протона и С4-Н протона 1,4-дигидропиридинового цикла, но и наличие двойных сигналов триплета и квартета практически эквивалентных этокси-групп. Метиленовые протоны -СН2N в 2,6-положении 1,4-дигидропиридинового кольца оказываются неэквивалентными и проявляются в разных областях спектра уширенным дублетом при 2.94 м.д. и дублет дублетом при 3.92 м.д. Следует также отметить весьма интересный факт, что протоны цитизиновых каркасов выписываются не удвоенными, а дублирующими сигналами со смещением на расстояние 0.05-0.14 м.д., свидетельствующие об их неэквивалентности в молекуле (37), связанных, вероятно, с их различной пространственной ориентацией относительно 1,4-дигидропиридинового кольца.
2.9 О биологической активности синтезированных соединений 2.9.1 Антибактериальная активность
Некоторые из синтезированных соединений прошли биологические испытания на антибактериальную и противогрибковую активность в НПЦ «Фитохимия» (г.Караганда).
Исследование антимикробной активности были проведены на следующих соединениях: (4), (7), (10), (18), (19), (20), (27).
В результате проведенного биоскрининга установлено, что почти все исследованные соединения в условиях in vitro проявляют умеренно-выраженную антибактериальную и противогрибковую активность. Активность соединений оценивается ниже препарата сравнения – гентамицина, но выше широко известного антибиотика – бензилпенициллина натриевой соли, различаясь несколько в широте действия относительно некоторых грамположительных (Staphylococcus aureus, Bacillus subtilis) и грамотрицательных штаммов (Pseudomonas aeruginosa, Escherichia coli).
2.9.2 Ростстимулирующая активность
Испытания на ростстимулирующую активность водорастворимого соединения (10) проводили в ТОО «Казахский НИИ плодоводства и виноградарства», в лаборатории агроэкологии и массовых анализов. Контролем служила вода, в качестве эталона сравнения применяли "Акпинол". Испытание проводили на отростках фасоли обыкновенной, проверяемые концентрации – 10, 50 и 100 мг/л. Изучение корнеобразования исследовалось по следующим факторам: длина корневой зоны, количество точек роста, количество бугорков, количество корней, суммарная длина всех корней (таблица 2).
Анализ всех полученных данных показал, что исследуемое соединение (10) при исследуемых концентрациях способствовало лучшему корнеобразованию фасоли как по сравнению с водой, так и по сравнению с эталоном сравнения – "Акпинолом". При этом наибольший двукратный эффект на корнеобразование по сравнению с "Акпинолом", испытуемое соединение (10) показало при концентрации 50 мг/л.
Таблица 1 – Влияние регулятора роста на корнеобразование фасоли
Препарат
|
Концентрация, мг/л
|
Длина корневой зоны, см
|
Кол-во точек роста, шт.
|
Кол-во бугорков, шт.
|
Кол-во корней, шт.
|
Длина всех корней, см
|
Вода (контроль)
|
-
|
5,7
|
27
|
6
|
21
|
32,0
|
Акпинол
(препарат
сравнения)
|
10
|
5,3
|
19
|
8
|
11
|
79,4
|
50
|
4,7
|
16
|
5
|
11
|
62,6
|
100
|
5,4
|
22
|
13
|
9
|
56,0
|
N-аминоглюкозид (10)
|
10
|
6,4
|
27
|
6
|
22
|
101,9
|
50
|
7,5
|
30
|
10
|
20
|
125,3
|
100
|
6,0
|
27
|
8
|
19
|
83,0
|
Таким образом, соединение (10) рекомендовано для дальнейших углубленных испытаний.
3 Экспериментальная часть
В главе приводится описание методик получения, выделения, выходы, температуры плавления и спектральные данные синтезированных соединений.
ЗАКЛЮЧЕНИЕ
Оценка полноты решения поставленных задач. Цель диссертационной работы заключалась в поиске и разработке целенаправленного синтеза новых азот- и серосодержащих гетероциклических производных, сочетающих в своей структуре физиологически активные полифункциональные фармакофорные заместители, в изучении механизма их образования, внутримолекулярной гетероциклизации, установлении строения и реакционной способности, а также в проведении скрининговых исследований биологической активности некоторых синтезированных соединений. Выявлены вещества, обладающее умеренно-выраженной антибактериальной активностью и высокой ростстимулирующей активностью.
Разработка рекомендаций и исходных данных по конкретному использованию результатов. Разработаны оптимальные условия синтеза новых азот- и серосодержащих полифункциональных гетероциклических производных. Приведенные механизмы внутримолекулярных реакций внесут определенный вклад в теорию органической химии. Синтезированные новые соединения пополнили базы и библиотеки данных по ЯМР 1Н- спектроскопии, масс-спектрометрии и Кембриджский Банк Структурных данных тремя изученными пространственными структурами. Одно из синтезированных соединений рекомендовано к углубленному биологическому испытанию с целью применения его в качестве высокоактивного ростстимулирующего средства.
Сравнение с лучшими достижениями в этой области. Синтезу, строению и изучению физиологической активности N,S-содержащих гетероциклических производных посвящено достаточное количество работ, но область их дальнейшего изучения еще весьма безгранична и далека до полного завершения. В работе впервые разработаны условия синтеза новых азот- и серосодержащих полифункциональных гетероциклических производных (пиразола, тиазолина, 1,3-тиазолин-2-тиона, 1,3-тиазина, 1,4-дигидропиридина и бициклических тиазолопиримидинов).
Проведенные первичные скрининговые биоиспытания на антибактериальную и ростстимулирующую активность, показали перспективность применения подобного рода соединений в медицине и сельском хозяйстве.
По итогам научно-исследовательской работы по целенаправленному поиску и синтезу новых азот- и серосодержащих полифункциональных гетероциклических производных можно сделать следующие выводы:
-
Взаимодействием 3,5-диметилзамещенного пиразола с некоторыми изотиоцианатами получены и охарактеризованы новые тиомочевинные и тиазолиновые производные, кристаллическая структура одного из продуктов циклизации 2-пиразол-1-ил)-1,3-тиазолина установлена рентгеноструктурным анализом. Изучено нуклеофильное замещение 4-бром-3,5-диметилпиразола галоген- и нитросодержащими производными. Проведена конденсация (1, 3, 5 -триметил-1-Н-пиразол-4-ил)метанамина с моносахаридами d-глюкоза и d-галактоза;
-
На основе физиологически активного 5-бромпиридинового цикла синтезированы новые аминоацильные производные алкалоида цитизин и биогенного амина морфолин;
-
Изучена особенность реакции образования циклического 3-бензил-5-(4-нитрофенил)тиазол-2(3H)-тиона, взаимодействием бензилдитиокарбамата триэтиламина с n-нитрофенилоксираном. Установлено, что на процесс ароматизации промежуточно образующегося тиазолидинового кольца в тиазолиновое на конечной стадии реакции существенное влияние оказывает добавление в реакционную смесь нитробензола;
-
Осуществлен синтез -N-(метакрилоилкарбамотиоил)изоникотингидразида и изучена его внутримолекулярная гетероциклизация при нагревании и под действием эквивалентных количеств аминов в соответствующее 1,3-тиазиновое производное, строение которого доказано рентгеноструктурным анализом;
-
Проведено алкилирование 4-арилзамещенных 3,4-дигидропиримидин(1Н)-2-тионов метиловым эфиром хлоруксусной кислоты, установлено, что в процессе реакции происходит циклизация в бициклические 3,5-дигидро-2H-тиазоло[3,2-a]пиримидины, строение одного из которых доказано РС-анализом;
-
На основе 1,4-дигидропиридинового цикла осуществлен синтез дизамещенного производного алкалоида цитизин;
-
В результате проведенных исследований осуществлен синтез 24 новых азот- и серосодержащих полифункциональных гетероциклических производных. Строение и состав полученных соединений доказаны физико-химическими методами анализа (ИК-спектроскопия, ЯМР 1Н-, ЯМР 13С спектроскопия, масс-спектроскопия и рентгеноструктурный анализ). Проведенные скрининговые биологические испытания ряда синтезированных соединений показали, что они обладают умеренно-выраженной антибактериальной активностью и одно соединение – высокой ростстимулирующей активностью.
Список опубликованных работ по теме диссертации
-
Кулаков И.В., Исабаева Г.М., Турдыбеков Д.М., Нуркенов О.А., Махмутова А.С., Турдыбеков К.М. О реакции алкилирования 4-арилзамещенных 3,4-дигидропиримидин(1Н)-2-тионов метиловым эфиром хлоруксусной кислоты // Материалы Межд. науч.-практ. конф. «Современное состояние и перспективы развития науки и высшего образования в Центральном Казахстане».– Караганда, 2008. – С.28-30.
-
Кулаков И.В., Исабаева Г.М., Фазылов С.Д., Татеева А.Б., Кабиева С.К., Нуркенов О.А. Синтез N-аминогликозидов на основе (1, 3, 5 –триметил-1-Нпиразол-4-ил)метанамина // Материалы Межд. конф. по химии и химической технологии «VI Беремжановские чтения». – Караганда, 2008. – С. 326-329.
-
Кулаков И.В., Исабаева Г.М., Нуркенов О.А., Фазылов С.Д. О реакции п-нитрофенилоксирана с триэтиламмониевой солью бензилдитиокарбаминовой кислоты // Материалы XI молодежной конф. по органической химии, посвящ. 110-летию со дня рождения И.Я. Постовского. – Екатеринбург, 2008. – С.103-105.
-
Кулаков И.В., Исабаева Г.М., Нуркенов О.А., Айнабаев А.А., Фазылов С.Д. Синтез новых потенциально биологических веществ на основе 4-бром-3,5-диметилпиразола // Материалы II-ой Межд. науч. конф. «Инновационное развитие и востребованность науки в современном Казахстане». – Алматы, 2008. – С.152-154.
-
Кулаков И.В., Исабаева Г.М., Фазылов С.Д. , Турдыбеков Д.М., Нуркенов О.А., Турдыбеков К.М. Алкилирование некоторых арилзамещенных 3,4-дигидропиримидин(1Н)-2-тионов метиловым эфиром хлоруксусной кислоты и -хлорацетил--фенилгидразидом бензиловой кислоты // Известия НАН РК. Сер. химическая.– 2008. – № 6.– С. 47-51.
-
Кулаков И.В., Исабаева Г.М. , Фазылов С.Д., Газалиев А.М. Синтез гетероциклических производных алкалоида цитизина и их компьютерный биопрогноз // Тезисы докл. конф. «Актуальные проблемы химии природных соединений». – Ташкент, 2009. – С.322.
Кулаков И.В., Исабаева Г.М. , Нуркенов О.А. , Фазылов С.Д. Синтез 3-бензил-5-(4-нитрофенил)тиазол-2(3H)-тиона на основе 4-нитрофенилоксирана, бензиламина и сероуглерода // Химия гетероцикл. соед. – 2009. –Т.45, № 4. –С. 631-632 (Chemistry of Heterocyclic Compounds. – 2009. – Vol. 45, № 4. – p. 498-499). Кулаков И.В., Исабаева Г.М., Нуркенов О.А., Фазылов С.Д. Синтез тиомочевинных производных на основе 4-бром-3,5-диметилпиразола // Известия НАН РК. Сер. химическая. –2009. – № 1 (373). – С. 75-78. -
Кулаков И.В., Исабаева Г.М., Нуркенов О.А., Фазылов С.Д. Синтез галогензамещенных производных нитроанилидов на основе 4-бром-3,5-диметилпиразола // Химический Журнал Казахстана. – 2009. – № 1 (24). – С.160-163.
-
Кулаков И.В., Нуркенов О.А., Турдыбеков Д.М., Исабаева Г.М., Махмутова А.С., Турдыбеков К.М. Синтез тиазолопиримидинов на основе 4-арилзамещенных 3,4-дигидропиримидин(1Н)-2-тионов и кристаллическая структура этилового эфира 5-(2,4-диметоксифенил)-7-метил-3-оксо-3,5-дигидро-2H-тиазоло[3,2-a]пиримидин-6-карбоновой кислоты // Химия гетероцикл. соед. – 2009. –Т.45, № 7. – С. 1075-1079 (Chemistry of Heterocyclic Compounds. – 2009. – Vol. 45, № 7. – p. 856-860).
-
Кулаков И.В., Турдыбеков Д.М., Нуркенов О.А., Исабаева Г.М., Махмутова А.С., Турдыбеков К.М., Фазылов С.Д. Синтез и кристаллическая структура -N-(5-метил-4-оксо-5,6-дигидро-4H-1,3-тиазин-2-ил)изоникотингидразида // Химия гетероцикл. соед. – 2009. –Т.45, № 9. – С. 1395-1399 (Chemistry of Heterocyclic Compounds. – 2009.– Vol. 45, № 9. – p. 1117-1121).
-
Кулаков И.В., Исабаева Г.М., Фазылов С.Д., Нуркенов О.А., Мулдахметов З.М., Султанова З.К. Синтез и ростстимулирующая активность N-аминогликозидов на основе (1, 3, 5 -триметил-1-Н-пиразол-4-ил)метанамина // Известия НАН РК. Сер. химическая. – 2009. – № 5 (377). – С. 26-29.
-
Исабаева Г.М., Аринова А.Е., Кулаков И.В., Нуркенов О.А. Синтез тиазолиновых производных на основе замещенных пиразолов // Материалы Межд. науч.-практич. конф. «Наука и ее роль в современном мире». – Караганда, 2010. – С.319-322.
ИСАБАЕВА ГҮЛСІМ МАҚСҰТҚЫЗЫ
Кейбір гетероциклдік қосылыстардың азот- және күкірт құрамды туындыларының синтезі, құрылысы мен қасиеттері
«02.00.03 – органикалық химия» мамандығы бойынша химия ғылымдарының кандидаты ғылыми дәрежесін алу үшін дайындалған диссертацияның авторефераты
ТҮЙІНДЕМЕ
Зерттеу объектілері. Жаңа N-, S- құрамды гетероциклдік туындыларының синтездеу әдістері, олардың құрылысы мен түзілу реакцияларының механизмдерінің стереохимиялық ерекшеліктерін, қосылыстардың биологиялық қасиеттерін анықтау.
Жұмыс мақсаты. Құрамында физиологиялық белсенді жартылайфункционалды фармакофорлы алмастырушыларды байланыстыратын жаңа N-, S- гетероциклдік туындыларының бағытталған синтездеу жолдарын жасау және кейбір синтезделген қосылыстарға биологиялық белсенділігінің скринингілік зерттелуін жүргізу.
Зерттеу әдістемелері. Жаңа N-, S- құрамды гетероциклдік туындыларының синтездеу жолдарын жасауда классикалық жұмсақ жағдайда органикалық синтездің – нуклеофильді алмасу, қосылу, алкилдену, ацилдену, конденсациялану; реакция өнімдерін алу кезінде колонкалық хромотография, қайта кристалдану мен вакуумда айдау әдістері қолданылды. Синтезделген қосылыстардың құрылымы мен құрамы қазіргі жаңа заманғы физико-химиялық талдау әдістерімен – ИҚ-, ПМР-, масс- спектроскопия элементті және рентген құрылымдық талдауды қолдану арқылы дәлелденді.
Жұмыстың негізгі нәтижелері. Жүргізілген ғылыми зерттеу жұмыстарының нәтижесінде келесі жаңа ғылыми мәліметтер алынды:
-
жұмсақ жағдайда 3,5-диметилді орын басқан пиразол кейбір изотиоцианаттармен әрекеттестіріліп, жаңа тиомочевинді және тиазолинді туындылар алынды және сипатталынды. Циклденген 5-(бромметил)-2-(3,5-диметил-1H-пиразол-1-ил)-4,5-дигидротиазол өнімінің кеңістік құрылымы белгіленді;
-
4-бром-3,5-диметилпиразол 2,6-дибром-, 2,6-дихлор- және 2,6-дийод-4-нитроанилидтің 2-бромсірке қышқылдың нуклеофильді алмастыруы зерттелді;
-
(1, 3, 5 -триметил-1-Н-пиразол-4-ил) метанамин мен d-глюкоза және d-галактоза моносахаридтарының конденсациясы жүргізілді;
-

жаңа аминоацильді туындылар: алкалоидты цитизин және өзінің құрамында физиологиялық белсенді 5-бромпиридинді циклді биогенді аминді морфолин синтезделді;
-
бензилдитиокарбамат үшэтиламмонийдің n-нитрофенилоксиранмен циклдік 3-бензил-5-(4-нитрофенил)тиазол-2(3H)-тион реакциясының ерекшелігі зерттелді. Ароматтандыру процесіне тиазолидин сақинасы тиазолинге бастапқы реагенттегі нитротобтың бар болуы реакцияның соңғы сатысында маңызды әсер келтіретіні, қоспаға нитробензолды қосқанда дәлелденді;
-
-N-(метакрилоилкарбамотиоил)изоникотингидразидтің ішкі молекулалық гетероциклизациясы аминдермен әсер еткенде -N-(5-метил-4-оксо-5,6-дигидро-4H-1,3-тиазин-2-ил) туындысына сәйкес синтезі жүргізілді, құрылымы рентгенқұрылымдық анализ арқылы дәлелденді;
-
4-арилорын басқан 3,4-дигидропиримидин(1Н)-2-тион метил эфир хлорсірке қышқылымен алкилдеу өткізілді, реакция процесінде циклде бицикілдеу 3,5-дигидро-2H-тиазоло[3,2-a]пиримидинге өткізілгені және солардың ішіндегі біреуінің құрылымы ренгенқұрылымдық анализ арқылы дәлелденді;
-
1,4-дигидропиридинді циклдің негізінде орын басқан цитизин алкалоидының туындысының синтезі жасалды;
-
қосындылардың антибактериалды және өсуін арттыруға ынталандыру белсенділігін алғашкы скринингті зерттеулері өткізілді.
Алынған нәтижелердің тәжірибелік маңыздылығы. Жаңа 24 полифункционалды азот және күкірт құрамды гетероциклдік туындылардың 3,5-ди- және 1,3,5-үшметилорын басқан пиразол, 5-бромпиридин, тиазолин-2-тион, 5-метил-4-оксо-5,6-дигидро-4H-1,3-тиазин, 3,5-дигидро-2H-тиазоло[3,2-a]пиримидин, 1,4-дигидропиридиндердің синтезі жасалынып, құрылымы анықталды. Бұл органикалық химияның теориялық және препаративтік сұрақтарына, сонымен қатар қосылыстардың биологиялық белсенділігін әрі қарай зерттеу нысандары ретінде қызығушылық тудырады.
Кейбір N- және S-құрамды гетероциклдердің полифункционалды туындыларын алудың қолайлы әдістері зерттеліп, олардың ерекшеліктері мен пайда болу механизмдері тағайындалды. Алынған жаңа қосылыстар ішінен антимикробтық және жоғары өсуді ынталандырылған заттар табылды.
Қолдану аймақтары. Жұмыстың негізгі нәтижелері жаңа гетероциклдік туындыларының қосындыларын синтездеу, олардың қасиеттері және реакциялық қабілеттіліктері, кеңістік құрылымының ерекшеліктерін зерттеу жұмыстарында, сонымен қатар антибактериалды және өсуді ынталандыру қасиеттері бар заттарды синтездеуде, медицинада, жер шаруашылық аймақтарында зерттеу жұмыстарын жүргізетін ғылыми зерттеу мекемелерінде қолданыс таба алады.

IsSabaYeva Gulsim Maksutovna
Synthesis, structure, properties of nitrogen- and sulfursubstituted derivatives of some heterocyclic compounds
Applicant’s Thesis on Candidate of Chemical Science on Specialty «02.00.03-Organic Chemistry»
SUMMARY
The object of the research. Development of methods of synthesis of new N-, S-containing heterocyclic derivatives, an establishment of a structure and stereochemical aspects of reactions mechanisms of its formation and biological properties of compounds.
The goal of the research. The purpose of the present work consists in the directed search and development of synthesis of novel nitrogen and sulfur-containing heterocyclic derivatives combining in the structure of physiologically active multifunctional pharmacy substations, in studying the mechanism of their formation, an establishment of the structure and reactivity and also in carrying out screening researches of biological activity of some synthesized compounds.
Methods of research. Classical methods of thin organic synthesis - reactions of nucleophilic substitution, attachment, alkylation, acylation, condensation have been used in synthesis new nitrogen and sulfurcontaining heterocyclic derivatives; methods of column chromatography, methods of crystalline modification and vacuum distillation are applied at excretion of reaction resultants; modern physical and chemical methods of the analysis - IR-, NMR1Н-, NMR13С-spectroscopy, mass spectrometry, X-ray crystal analysis are widely used at studying a structure of the synthesized compounds.
The general results. As a result of the researches following scientific results for the first time are obtained:
- novel thiourea and thiazoline derivatives are obtained and characterized by interaction of 3,5-dimethylsubstitued pyrazol with some isothiocyanates in soft conditions, the dimensional structure of product of ring formation of 5-(brominemethyl)-2-(3,5-dimethyl-1H-pyrazol-1-yl)-4,5-dihydrothiazol was stated;
- nucleophilic substitution of 4-bromine-3,5-dimethylpyrazol by 2,6-dibromine-, 2,6-dichlorine- and 2,6-diiodine-4-nitroanilides of 2-bromineacetic acids was studied;
-

condensation of (1,3,5-trimethyl-1-Н-pyrazol-4-yl)methanamine with monosaccharosessuch as d-glucoseandd-galactose was carried out;
- novel amineacyl derivatives of cytisine alkaloid and biogenic amine morpholine containing in the structure of physiologically active 5-brominepyridine cycle are synthesized;
- feature of interaction reaction of triethylammonium benzyldithiocarbamate with n-nitrophenyloxiranein cyclic 3-benzyl-5(4-nitrophenyl) thiazol-2(3H)-tion was studied, it was stated that presence of nitrogroup in the initial reagent renders essential influence on process of aromatization thiazolidine rings in thiazoline at a final stage of reaction, it was proved by addition in a reaction mixture of nitrobenzene;
- synthesisof-N-(metacryloylcarbamotyolyl) izonicotine gydrazide is carried outand is studied its intramolecular heterocyclization under action of amines in corresponding -N-(5-methyl-4-oxo-5,6-dihydro-4H-1,3-thiazin-2-yl) derivative which structure is proved by X-ray crystal analysis;
- alkylation of 4-arylsubstituted 3,4-dihydropyrimidine-(1Н)-2-tions is carried out by methylic chloroacetate, it was stated that ring had formatted during reaction in dicyclic 3,5-dihydro-2H-thiazol [3,2-a] pyrimidines , the structure of one of which is proved by X-ray crystal analysis;
- synthesis of disubstituted derivatives of alkaloid cytisine is carried out on the basis of 1,4-dihydropyridine cycle;
- primary screening tests of compounds are carried out on growing stimulating and antibacterial activity.
The practical importance of results. Synthesis of 24 novel multifunctional ninrogen- and sulfur-containing heterocyclic derivatives of 3,5-di- and 1,3,5-trimethylsubstituted pyrazol, 5-bromopyridine, thiazoline-2-tion, 5-methyl-4-oxo-5,6-dihydro-4H-1,3-thiazine, 3,5-dihydro-2H-thiazolo[3,2-a]pyrimidine, 1,4-dihydropyridine is carried out and their structure is determined. These compounds are of interest as objects of studying theoretical and preparative problems of organic chemistry and also the further studying of their biological activity is stated. Optimal methods of obtaining reception of the multifunctional derivatives of some N- and S-containing heterocycles are developed and investigated, some aspects and mechanisms of their formation, and also dimensional structure of three derivatives are stated. The compounds possessing antimicrobial and high growing stimulating activity are found out among new compounds obtained.
The practical value of the results. Results of thesis on synthesis of new derivatives of heterogeneous ring compounds, their properties and the reactivity, the stated features of a dimensional structure and also found antibacterial and growing stimulating properties of compounds can find application in the research organizations carry out basic researches in the field of organic synthesis, medicine, an agriculture.

Подписано в печать 22.02.2010г.
Печать – ризография, Заказ №
Усл.печ.л. 1,0 Тираж 130 экз.
П  ечать: г. Караганда, ечать: г. Караганда,

страница 1
|