имени А.Б. Бектурова»
доктор химических наук, профессор Салькеева Л.К.
ВВЕДЕНИЕ
Актуальность исследования. В настоящее время микроволновая активация в органическом синтезе (Microwave Assisted Organic Synthesis (MAOS)) является одним из наиболее бурно развиваемых направлений в органическом синтезе. Прежде всего, это связано с многократным (в десятки, сотни и тысячи раз) сокращением времени химических реакций. Потенциальный экономический эффект является бесспорным стимулом к развитию и продвижению данного направления органического синтеза, к созданию промышленно востребованных технологий.
Нельзя не отметить, что накопленный экспериментальный опыт применения микроволновой активации в органическом синтезе меняет и расширяет сложившиеся теоретические представления о направлении протекания и реакционной способности известных органических реакций. По этой причине всестороннее изучение протекания органических реакций в условиях микроволнового облучения имеет высокий теоретический интерес.
До 2005г. в Республике Казахстан не проводились исследования в этой бурно развивающейся и перспективной области. Разработка и внедрение методов органического синтеза в условиях микроволнового облучения в технологии химического и фармацевтического производства могут стать существенным фактором их развития.
Второй не менее важной задачей является поиск оригинальных лекарственных препаратов. Органический синтез в условиях микроволнового облучения является признанной технологией получения больших библиотек (до нескольких тысяч структурно-подобных соединений), что позволяет ускорить процесс поиска вещества с необходимыми фармакологическими свойствами в сотни раз.
Изученные в диссертационной работе классы органических веществ, также как и процессы их синтеза, представляют высокий научный и практический интерес. Так, 1,3-оксазолидины и 1,3-диоксоланы используются в сельском хозяйстве, в медицине, промышленности. 1,3-Оксазолидины применяются в производстве полимеров, отличающихся повышенной химической и механической стойкостью. Производные пиразина и хиноксалина, 2-амино-4-фенилтиазола являются биологически-активными веществами и используются в медицине. N-оксиды азотсодержащих гетероциклических соединений находят широкое применение в производстве косметической продукции и медицине.
Успешное лечение сердечно-сосудистых заболеваний и гипертензии не возможно без применения препаратов группы 1,4-дигидропиридинов и их структурных аналогов 3,4-дигидропиримидинонов (-тионов). В диссертационной работе рассмотрено получение лекарственных субстанций таких востребованных медицинских препаратов, как «Нитрендипин» и «Нимодипин». Также разработаны оригинальные методы синтеза действующих веществ известных противотуберкулезных лекарствнных средств, таких как «Изониазид», «Фтивазид», «Метазид».
Несмотря на то, что изученные в диссертационной работе классы органических соединений широко применяются в течение многих лет, усовершенствование методов их синтеза является актуальнейшей задачей, стоящей перед современными исследователями. Это связано с тем, что имеющиеся способы их получения характеризуются рядом серьезных недостатков: длительностью проведения реакции, необходимостью использования токсичных, дорогостоящих, требующих утилизации растворителей и т.д..
Тщательный анализ соответствующей литературы позволяет предположить, что внедрение микроволновой активации (МВА) в промышленном синтезе этих соединений позволит создать экологически безопасные и экономически эффективные методы их производства.
Степень разработанности проблемы. Первые работы по применению МВА в органическом синтезе были опубликованы в 1986 г., R. N. Gedue и R. J. Giguere. Этими авторами исследовалась эффективность применения микроволнового излучения при проведении реакций Дильса-Альдера, Кляйзена. В этих работах был описан эффект многократного сокращения времени химической реакции, однако причины указанного явления еще долгое время оставались неизученными. С тех пор количество публикаций в этой области неуклонно возрастает.
Признанными авторитетами в области органического синтеза в условиях микроволнового облучения являются Oliver Kappe, Alexander Stadler (Австрия), Andre´ Loupy (Франция), Alesia Amore (Нидерланды), Dariusz Bogdal (Польша), Werner Bonrath (Швецария), Khalid Bugrin, Mohamed Soufiaoui (Марокко), Ugo Chiacchio (Италия), Д.Л. Рахманкулов (Россия), Vladimir Cirkva (Чехия), Michael J. Collins, Rajender S. Varma (США), John R. Jones (Австрия), Thach Le Ngoc (Вьетнам), Bernd Ondruschka (Германия), Christopher R. Strauss (Австралия). В Республике Казахстан первые разработки в области применения МВА в органическом синтезе появились в ТОО «Институт органического синтеза и углехимии РК» в 2005 г.
Связь работы с планом государственных программ. Диссертационная работа является частью исследований, проводимых в лаборатории синтеза биологически активных веществ ТОО «ИОСУ РК» по темам: «Создание научных основ получения новых перспективных материалов на базе химически модифицированных продуктов переработки угольного сырья (комплексные удобрения, мелиоранты, деоксиканты и структурообразователи почв, сорбенты для очистки сточных вод, ингибиторы коррозии металлов, лекарственные средства, электронные материалы и высококачественное синтетическое жидкое топливо)» (2006-2008 гг.) (гос.рег.№ 0106 РК 01031); «Разработка нового одностадийного метода получения противотуберкулезного препарата «Изониазид» в условиях микроволнового облучения» (тема выполнена по гранту МОН РК по программе рисковых и инициативных исследований, 2008 г.).
Цель работы заключается в разработке новых высоко эффективных методов проведения промышленно-востребованных реакций таких как: реакция Манниха, N-оксидирования азотсодержащих гетероциклов пиридинового ряда, окисления карбонильных соединений диоксидом селена, а также в разработке методов синтеза таких классов гетероциклических соединений как 1,3-оксазолидины, 1,3-диоксоланы, 2-аминотиазолы, 2-фенилпиразин, 2-фенилхиноксалина. Также целью диссертационного исследования была разработка новых методов синтеза лекарственных веществ группы 1,4-дигидропиридинов и 3,4-дигидропиримидинонов (-тионов) по реакциям Ганча и Биджинелли.
Особое внимание в проведении диссертационного исследования было уделено разработке новых методов синтеза действующих веществ широко распространенных противотуберкулезных препаратов: гидразида изоникотиновой кислоты, и его производных «Фтивазид» и «Метазид» в условиях микроволнового облучения.
Также целью исследования было теоретическое изучение особенностей протекания реакций, выявление и систематизация закономерностей, создание прогностической модели.
Научная новизна определяется тем, что впервые:
-
разработана методика синтеза 2-замещенных-1,3-оксазолидинов в условиях МВА. Подобранные условия позволили сократить время реакции с 6-12 ч до 10-20 минут и провести синтез в условиях отсутствия растворителя;
-
изучена возможность синтеза 1,3-диоксоланов на основе бутандиола-2,3 в условиях МВА. Установлено, что при МВА реакции гетероциклизации образуется от 15 до 30 % побочного продукта – тетраметилдиоксана, что не наблюдается в условиях традиционного нагрева;
-
изучено влияние МВА на протекание реакции аминометилирования по Манниху фенилацетилена, ацетофенона, циклогексанона. Изучена зависимость выхода продуктов от строения реагентов. Установлено, что применение МВА позволяет отказаться от использования растворителя и сократить время реакции с 24 ч до 3-5 минут;
-
установлена зависимость реакционной способности изучаемых аминов и С-Н кислот от мощности и времени облучения в реакциях аминометилирования;
-
изучена возможность N-оксидирования азотсодержащих гетероциклов пиридинового ряда перекисью водорода в условиях МВА, разработаны удобные методы синтеза соответствующих N-оксидов. Время синтеза удалось сократить с 6 ч до 20 минут; Найдено, что единственным продуктом окисления анабазина и дианабазенилметана перекисью водорода является Ру-N-оксид δ-оксимино-δ-(пиридил-3) валериановой кислоты;
-
разработан новый одностадийный метод окисления 4-метилпиридина до изоникотиновой кислоты в условиях МВА, позволяющий значительно повысить интенсивность процесса;
-
изучено окисление карбонильных соединений диоксидом селена в условиях МВА. Установлена зависимость выхода конечного продукта от природы растворителя.
-
разработан метод синтеза 2-фенилпиразина и 2-фенилхиноксалина в условиях МВА;
-
разработан новый метод проведения реакции Ганча в условиях микроволнового облучения. Впервые с применением МВА осуществлен синтез 2-амино-4-метилтиазола по трехкомпонентной реакции Ганча. В классических условиях эта реакция не протекает.
-
разработаны новые оригинальные микроволновые методы синтеза 3,4-дигидропиримидинонов (-тионов) и 1,4-дигидропиридинов. Описаны методы синтеза действующих веществ таких лекарственных препаратов, как «Нитрендипин» и «Нимодипин».
-
разработан одностадийный метод синтеза известного противотуберкулезного препарата «Изониазид» взаимодействием изоникотиновой кислоты и гидразин-гидрата в условиях МВА, характеризующийся сокращением числа стадий, интенсификацией процесса. В классических условиях данная реакция не протекает;
-
методом математического планирования эксперимента по Малышеву подобраны оптимальные условия синтеза «Изониазида» в условиях МВА. Выявлены зависимости выхода «Изониазида» от мощности излучения, времени реакции и соотношения реагентов, составлен лабораторный регламент на синтез «Изониазида» в условиях МВА.
-
получены положительные решения на выдачу инновационных патентов на метод синтеза изоникотиновой кислоты, 2-амино-4-фенилтиазола.
На защиту выносятся следующие основные положения:
-
результаты исследований новых методов синтеза 1,3-оксазолидинов на основе диэтаноламина, 1,3-диоксоланов на основе бутандиола-2,3 и глицерина в условиях МВА;
-
особенности протекания реакции аминометилирования по Манниху фенилацетилена, ацетофенона, циклогексанона в МВА. Изучена зависимость выхода продуктов от строения исходных реагентов. Установлено, что применение МВА позволяет провести синтез в отсутствие растворителя и сократить время реакции с 24 ч до 3-5 минут;
-
в ходе изучения реакции N-оксидирования азотсодержащих производных пиридинового ряда перекисью водорода в условиях МВА были разработаны удобные методы синтеза соответствующих N-оксидов. Время реакции удалось сократить с 6 ч до 20 минут;
-
исследована реакция окисления анабазина и дианабазинилметана перекисью водорода в условиях микроволнового облучения. Найдено, что в обоих случаях единственным продуктом окисления является Ру-N-оксид δ-оксимино-δ-(пиридил-3)-валериановой кислоты;
-
изучено влияние МВА на протекание реакции окисления 4-метилпиридина азотной кислотой и разработан одностадийный метод синтеза изоникотиновой кислоты в условиях МВА, позволяющий сократить время реакции;
-
разработан новый метод окисления кетонов диоксидом селена в условиях МВА;
-
разработан новый метод синтеза и модификации производных 2-аминотиазолов в условиях МВА;
-
новые микроволновые методы проведения трехкомпонентных реакций Ганча и Биджинелли;
-
разработан одностадийный метод синтеза известного противотуберкулезного препарата «Изониазид» взаимодействием изоникотиновой кислоты и гидразин-гидрата в условиях МВА, характеризующийся сокращением числа стадий, повышением интенсивности процесса. В классических условиях данная реакция не протекает;
-
с применением метода математического планирования эксперимента по Малышеву подобраны оптимальные условия синтеза «Изониазида» в условиях МВА. Выявлены зависимости выхода «Изониазида» от мощности излучения, времени реакции и соотношения реагентов, составлен лабораторный регламент на синтез «Изониазида» в условиях МВА.
Практическое значение работы. В ходе исследования были разработаны новые методы проведения 14 органических реакций, которые могут быть использованы для синтеза библиотек изученных классов органических соединений. Осуществлен синтез более ста гетероциклических соединений, обладающих различными видами биологической активности и другими практически ценными свойствами.
Среди синтезированных соединений выявлено вещество – дианабазинилметан, обладающий выраженной ростстимулирующей активностью.
Описаны методы синтеза действующих веществ следующих лекарственных препаратов: «Нитрендипин», «Нимодипин», «Изониазид», «Метазид», «Фтивазид».
Разработанные методы соответствуют принципам концепции «Зеленая химия»
Личный вклад автора заключается в выборе научного направления и постановке задач исследования; в анализе патентной и периодической профильной литературы; планировании и проведении экспериментальных исследований; анализе и интерпретации полученных результатов; проведении компьютерного моделирования и квантово-химических расчетов; обобщении полученных результатов.
Апробация работы Материалы диссертационной работы представлены и обсуждены на международных научно-практических конференциях: «Валихановские чтения-11» (Кокчетав, 2006), «Современные проблемы органического синтеза, электрохимии и катализа» (Караганда, 2006), «Аманжоловские чтения-2007» (Усть-Каменогорск, 2007), «Наука и ее роль в современном мире» (Караганда, 2009), V-International Conference on Mechanochemistry and Mechanical Alloying “Income 2006”, (Novosibirsk, Russia, 2006), III Международной конференции по теоретической и экспериментальной химии, (Караганда, 2006), Международной научной конференции молодых ученых «VIII Сатпаевские чтения» (Павлодар, 2008); «Высокие технологии, фундаментальные и прикладные исследования, образование» (Санкт-Петербург, 2007); «Химия и технология растительных веществ» (Уфа, 2008); «Современное состояние и перспективы развития науки и высшего образования в Центральном Казахстане» (Караганда, 2008); «Инновационное развитие и востребованность науки в современном Казахстане» (Алматы, 2008); VI Международном Беремжановском съезде по химии и химической технологии (Караганда, 2008); «XII Международная молодежная конференция по органической химии» (Иваново, 2009); XIV и XV Международные конференции студентов, аспирантов и молодых ученых "Ломоносов-2008, 2009" (Москва, 2008, 2009).
Публикации. По теме диссертационной работы опубликовано 53 научных работ, из них 2 инновационных патента РК; 12 монопубликаций (8 моностатей и 4 доклада в трудах международных конференций), 17 совместных публикаций в журналах, входящих в список ККСОН РК, 22 докладов в трудах международных научно-практических конференций. Всего в журналах, входящих в список ККСОН РК, опубликовано 22 статьи, из них 9 в переводных Российских изданиях («Журнал общей химии», «Журнал прикладной химии»)
Структура и объем диссертации. Диссертационная работа состоит из введения, основной части, состоящей из литературного обзора, обсуждения результатов, экспериментальной части, заключения, списка использованных источников, включающего 424 наименований и 2 приложения, содержащих лабораторный регламент на производство «Изониазида» в условиях МВА и акт биологического испытания. Работа изложена на 299 страницах, включает 72 таблицы и 71 рисунок.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
1 Органический синтез в условиях микроволнового облучения: история, перспективы развития, теоретические основы, экспериментальные особенности (литературный обзор).
Данный раздел состоит из одиннадцати подразделов (1.1-1.11) и содержит исторические сведения, перспективы развития микроволновой химии, а также современные представления о теоретических основах и экспериментальных особенностях органического синтеза в условиях микроволновой активации.
2 Особенности протекания некоторых органических реакций в условиях микроволнового облучения (обсуждение результатов)
В разделе 2, состоящем из 7 подразделов (2.1-2.7), приведены результаты экспериментальных и теоретических исследований по разработке новых методов синтеза практически полезных азотсодержащих гетероциклических соединений в условиях микроволнового облучения.
2.1 Особенности синтеза 1,3-оксазолидинов и 1,3-диоксоланов конденсацией вицинальных аминоспиртов (гликолей) с карбонильными соединениями в условиях микроволнового облучения
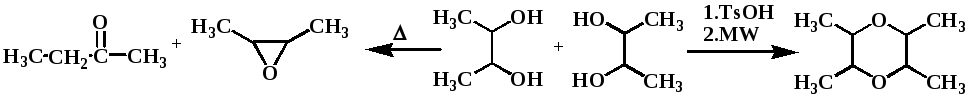
В подразделе 2.1, состоящем из двух пунктов (2.1.1-2.1.2) приведен подробный обзор области применения 2-замещенных-1,3-оксазолидинов и 2-замещенных -1,3-диоксоланов в медицине, промышленности и сельском хозяйстве. Рассмотрены недостатки традиционных методов их синтеза. Описаны результаты синтеза 1,3-оксазолидинов и 1,3-диоксоланов в условиях микроволнового облучения.
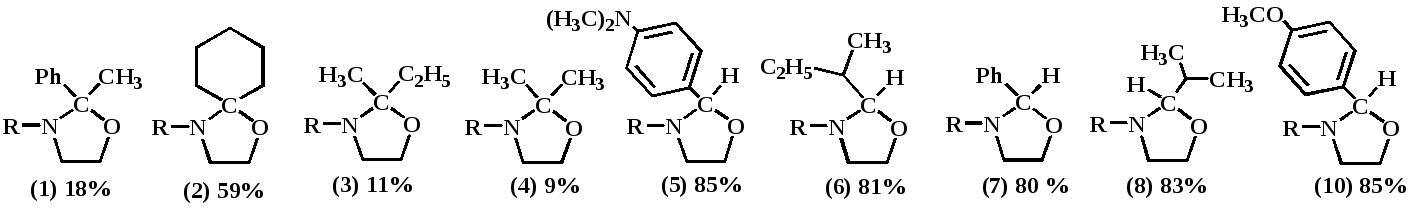
Установлено, что 10-30 минут МВА достаточно для образования 1,3-оксазолидинов на основе альдегидов и 40-60 минут на основе кетонов. Оптимальная мощность излучения составляет 70-90 Вт. При повышении мощности излучения до 350 Вт и выше наблюдается заметное снижение выхода желаемого продукта. Предположительно, решающую роль в образовании 1,3-оксазолидинов играет специфический термический и специфический не термический микроволновые эффекты. В ходе эксперимента были синтезированы следующие соединения:
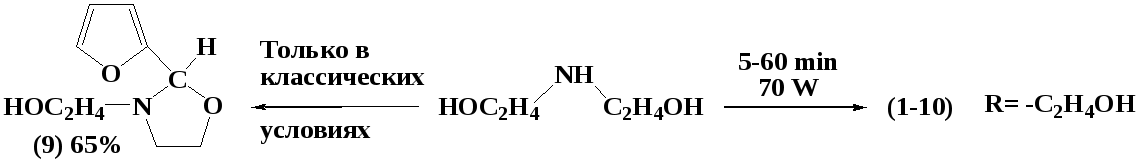
Обнаружено, что МВА смеси фурфурола с диэтаноламином в течение 10 секунд при мощности облучения 70-90Вт приводит не к образованию ожидаемого 1,3-оксазолидина, а к инициированию бурной экзотермической реакции сополимеризации, вероятно, протекающее следующей схеме:
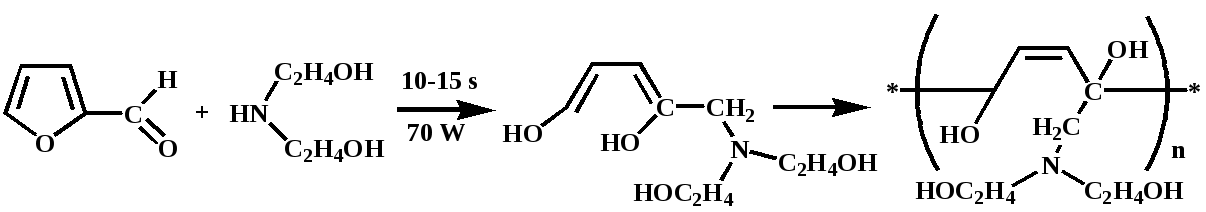
В работе рассмотрен подробный механизм реакции, согласно которому в условиях микроволнового облучения происходит раскрытие фуранового кольца с образованием диеновых соединений, впоследствии полимеризующихся.
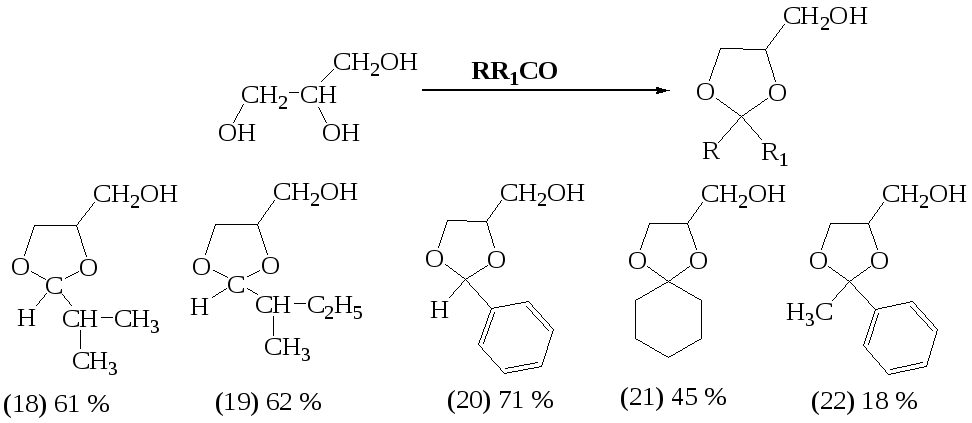
В диссертации подробно рассмотрена область применения 1,3-диоксоланов, классические методы их синтеза, характеризующиеся длительностью проведения реакции (5-9 часов), необходимостью применения катализаторов, использовании токсичных и пожароопасных растворителей. Все это делает процесс синтеза 1,3-диоксоланов экологически небезопасным и экономически затратным.
В работе подробно изучен синтез 2-замещенных-3,4-диметил-1,3-диоксоланов в условиях МВА, который был проведен по следующей схеме:
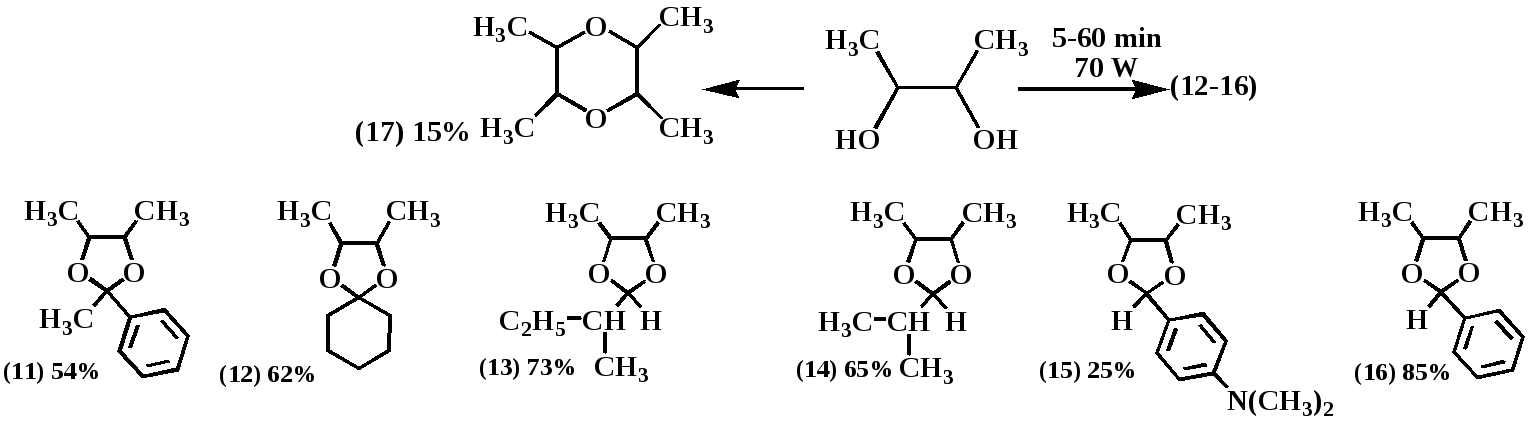
С целью подбора оптимальных условий проводилось варьирование времени облучения в диапазоне от 30 сек до 60 мин и мощности излучения от 70 до 800 Вт Реакции проведены без растворителя. В качестве катализатора применялась пара-толуолсульфокислота. Найдено, что оптимальное время МВА составляет 5-15 минут для альдегидов и 40-60 минут для кетонов. Оптимальные значения мощности 70-90 Вт. Увеличение мощности приводит к снижению выхода желаемого продукта.
При проведении всех указанных реакций наблюдалось образование побочного продукта, идентифицированного как тетраметилдиоксан (17). В контрольном опыте микроволновому облучению мощностью 70 Вт был подвергнут бутандиол-2,3, содержащий такие же количества пара-толуолсульфокислоты, как и в синтезе 1,3-диоксоланов. В результате был выделен тетраметилдиоксан, что является химическим подтверждением строения последнего.
При нагревании смеси бутандиола-2,3 с каталитическими количествами пара-толуолсульфокислоты на сплаве Вуда, нагретого до 210оС получена смесь продуктов – цис- и транс-изомеров окиси бутилена-2,3 и незначительные количества метилэтилкетона.
Наблюдаемое различие в направлении протекания реакции легко объясняется, если предположить, что раствор бутандиола-2,3 при комнатной температуре имеет трехмерную структуру, образованную за счет межмолекулярных водородных связей (рисунок 1 А). Термический нагрев от стенок сосуда создает градиент температуры и вызывает конвекционное перемешивание раствора. Необходимо заметить, что плавное повышение температуры приводит, в первую очередь, не к химической реакции, а к нарушению трехмерной структуры и увеличению межмолекулярного расстояния между молекулами бутандиола-2,3. (рисунок 1 Б). Согласно закону распределения Больцмана, энергию достаточную для вступления в реакцию имеет незначительная доля молекул, которые могут находиться на удалении друг от друга. В этом случае происходит внутримолекулярная реакция, приводящая к образованию стереоизомеров окиси бутилена-2,3.
Проникающая природа микроволнового облучения приводит к одномоментному нагреву жидкости по всему объему и, следовательно, селективной активации гидроксильных групп. Отсутствие конвективных потоков благоприятствует сохранению трехмерной структуры жидкости, что создаёт благоприятные условия для бимолекулярной реакции образования тетраметилдиоксана.
А Б
Рисунок 1 – Трехмерная модель раствора А – в условиях МВО;
Б – в условиях конвекционного нагрева
Диоксоланы на основе глицерина являются промышленно выпускаемыми продуктами, поэтому разработка новых, высокоэффективных, экологически дружественных, экономически рентабельных методов их синтеза имеет практическое значение. Исследование реакция синтеза 2-замещенных-1,3-диоксоланов в условиях МВА на основе глицерина проводилось в отсутствии растворителя по схеме:
Установлено, что процесс может быть успешно завершен за 5-60 минут при мощности облучения 70-90 Вт. Строение синтезированых соединений подтверждено данными ИК-, ЯМР-1Н спектроскопии, а также результатами элементного анализа.
Так как переменные производственные издержки напрямую связаны с затратами времени, в главе приводится анализ хронометрических затрат на каждую стадию процесса. Так на синтез 1,3-диоксоланов в условиях конвекционного нагрева тратится 28 ч. Эта цифра складывается из: очистки исходных веществ (4ч), абсолютизации растворителя (12ч), синтез (6-8ч), выделение продукта (4ч). На эти операции расходуется не только время, но и материальные и трудовые ресурсы. В предложенном методе стадия абсолютизации растворителя отсутствует, а стадия синтеза продукта сокращена до 5-15 минут (в случае альдегидов) и 1 часа (в случае кетонов). Стадия выделения и очистки продукта также сокращена за счет отсутствия необходимости в отгоне растворителя из реакционной среды, его очистки и регенерации. Синтез 1,3-диоксоланов в условиях МВА может быть осуществлен за 5-6 ч.
Таким образом, очевидно преимущество проведения синтезов 2-замещенных-1,3-диоксоланов в условиях МВА. Это связано с сокращением времени производственного цикла в 5-6 раз, отсутствием растворителя, что делает предложенный метод полностью соответствующим концепции «Зеленая химия».
2.2 Проведение реакции С-Н и N-H аминометилирования по Манниху в условиях микроволновой активации
В подразделе 2.2, состоящем из 2 пунктов (2.2.1-2.2.2) подробно описаны современные тенденции развития методов проведения реакции Манниха. Приведены примеры ее коммерческого применения в производстве резинотехнических изделий, горюче-смазочных материалов, в синтезе биологически-активных веществ, в модификации известных лекарственных средств, в частности методами комбинаторной химии. Описаны результаты проведенных исследований.
В ходе исследования было проведено аминометилирование таких С-Н кислот как фенилацетилен, ацетофенон, циклогексанон. Изучены процессы N-H аминометилирования
В классических условиях аминометилирование фенилацетилена проводится длительным кипячением исходных реагентов в течение 12-24 часов в среде диоксана, токсичного и пожароопасного растворителя. В целях интенсификации процесса была изучена возможность применения МВА в отсутствие растворителя, согласно схеме:
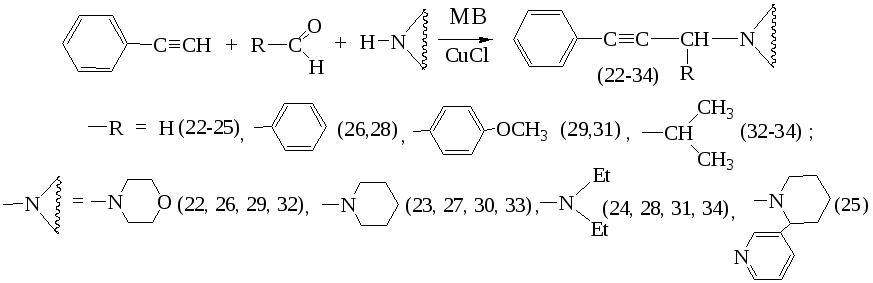
Установлено, что при МВА реакционной смеси, состоящей из фенилацетилена, альдегида и соответствующего амина при мощности исходящего облучения 350 Вт в течение 3-5 минут удается синтезировать целевые продукты (1-13). Реакция была проведена в отсутствии растворителя.
Наилучшие выходы продуктов аминометилирования достигаются в случае применения параформа, бензальдегида и анисового альдегида (52-71%), а наименьшие выходы – в случае изомасляного альдегида (41-57%). Строение синтезированных соединений доказано данными ИК-, ЯМР1Н – спектроскопии а также встречным синтезом по известным методикам.
На рисунке 2 приведены графики зависимости выхода соединения (1) от мощности и времени излучения.
Рисунок 2 –Зависимость выхода соединения (22) от мощности и времени излучения
Производные ацетофенона и реакция аминометилирования ацетофенона и его производных имеет важное научное и промышленное значение, а возможность её интенсификации в микроволновом поле представляет коммерческий интерес. Поиск новых условий аминометилирования ацетофенона в условиях МВА был проведен по следующей схеме:
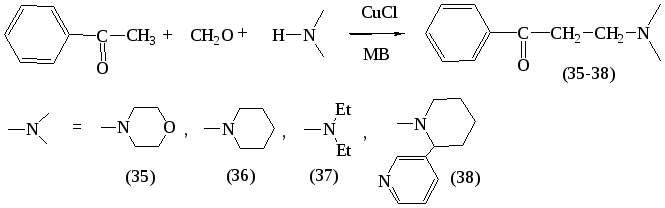
В результате проведенных исследований установлено, что основания Манниха (35-38) образуются с выходами 46-70 % при МВА реакционной смеси, состоящей из ацетофенона, параформа и вторичного амина в мольном соотношении (1:1,3:1,3). В классических условиях выходы продуктов (35) и (36) составляют 75 % и 65 % соответственно.
Подбор условий показал, что эффективным является мощность облучения 350 Вт, при времени экспозиции 3-4 мин.
Стерически затрудненный амин, -пиперидил--пиридин (анабазин), во всех изученных условиях микроволнового облучения приводил к частичному осмолению реакционной массы, что затрудняло выделение и очистку целевого продукта.
Вещества (35-38) являются сильно гигроскопичными маслами, поэтому в целях подтверждения их строения на их основе в условиях конвекционного нагрева были получены соответствующие 2,4-динитрофенилгидразоны. Строение полученных веществ доказано данными ИК-, ЯМР-1Н спектроскопии.
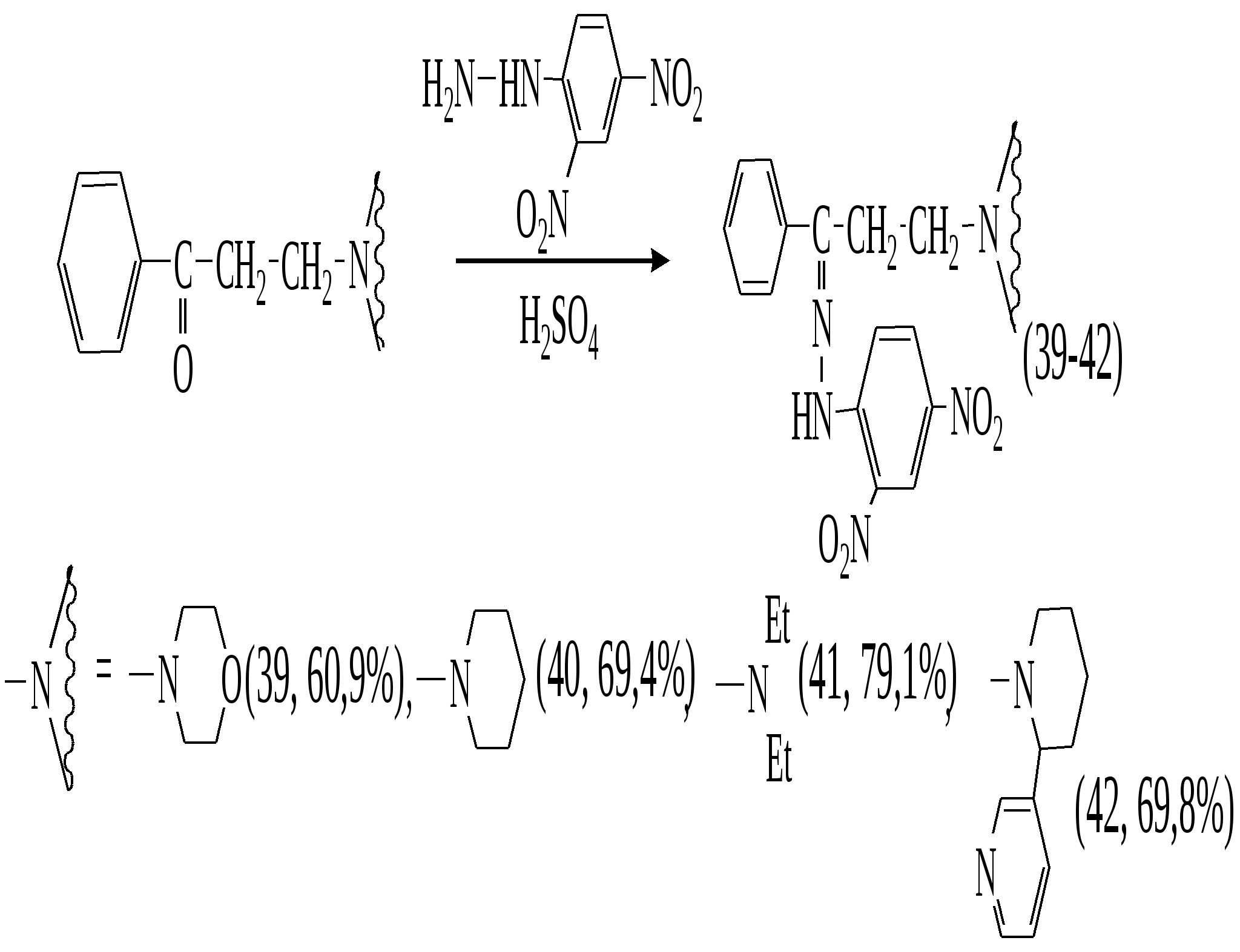
Реакция аминометилирования циклогексанона в условиях МВА различными вторичными аминами проведена согласно следующей схемы:
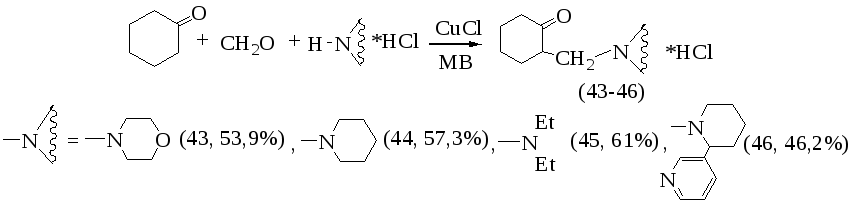
Наибольшие выходы соответствующих аминометилкетонов (43-46) (46-61%) достигаются при мощности излучения 350 Вт и времени экспозиции 10-15 минут без растворителя.
Вещества (43-46) гигроскопичны, их выделение и идентификация были осуществлены переводом в соответствующие 2,4-динитрофенилгидразоны (47-50). Структура и строение которых были доказаны данными ИК-, ЯМР-1Н спектроскопии.
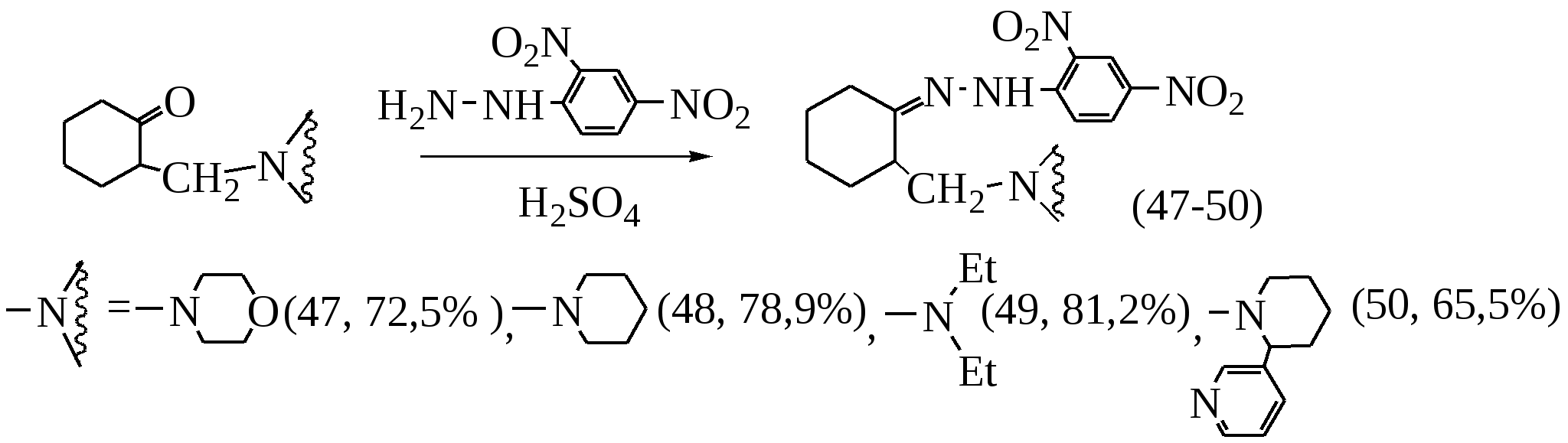
В этом пункте описаны реакции N-Н аминометилирования в условиях МВА как показано на следующей схеме:
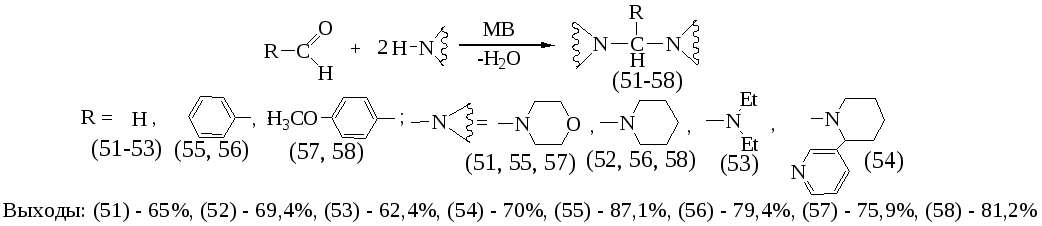
Наилучшими условиями реакции N-H аминометилирования является мощность облучения от 70 до 350Вт, время 3-5 минут. Реакция проведена без растворителя.
Установлено, что параформ вступает в реакцию N-Н аминометилирования со всеми исследованными аминами. В случае ароматических альдегидов в реакцию N-Н аминометилирования легко вступают только морфолин и пиперидин.
Строение полученных веществ доказано данными ИК-, ЯМР1Н-спектроскопии, масс-спектрометрии.
2.3 Реакция окисления в условиях МВ-облучения
Данный подраздел, состоящий из 5 пунктов (2.3.1-2.3.5), посвящен изучению процессов окисления в условиях микроволновой активации. Реакция окисления является одним из основных процессов создания и модификации функциональных групп. В подразделе рассмотрена область применения и недостатки некоторых реакций окисления в производстве практически востребованных соединений в условиях конвекционного нагрева.
Установлено, что соответствующие N-оксиды пиридина (59) и 4-метилпиридина (60), никотиновой (61), изоникотиновой кислоты (62), никотинамида (63), а также хиноксалина в условиях МВА под действием перекиси водорода в среде ледяной уксусной кислоты. Вещества (59-63) образуются за 20 минут при мощности излучения 70 Вт, при этом выходы продуктов составляют от 70 до 85%.
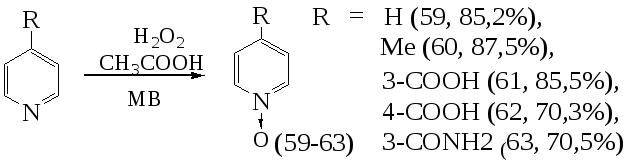
Необходимо отметить, что в условиях конвекционного нагрева проведение реакции N-оксидировния требует больших затрат времени (12-16 ч).
Изучено влияние МВА на окисление анабазина и дианабазинилметана 30%-ным раствором перекиси водорода в среде ледяной уксусной кислоты. Установлено, что окисление дианабазинилметана протекает хемиоселективно с образованием продукта, идентичного продукту окисления анабазина - Ру-N-оксида δ-оксимино-δ-(пиридил-3) валериановой кислоты (74). Обращает на себя внимание тот факт, что наилучшие выходы продукта (74) достигаются окислением как анабазина, так и дианабазинилметана в идентичных условиях: мощность 70 Вт, время 20-30 минут. Окисление проводится 30 % раствором перекиси водорода в среде ледяной уксусной кислоты.
Из этого наблюдения следует вывод, что ускорение химической реакции обусловлено влиянием термического и специфического термического эффекта. Можно предположить, что скоростьлимитирующей стадией является стадия жидкофазного окисления субстрата атомарным кислородом, протекающая через малополярные переходные состояния. Механизм реакции приведен на схеме:
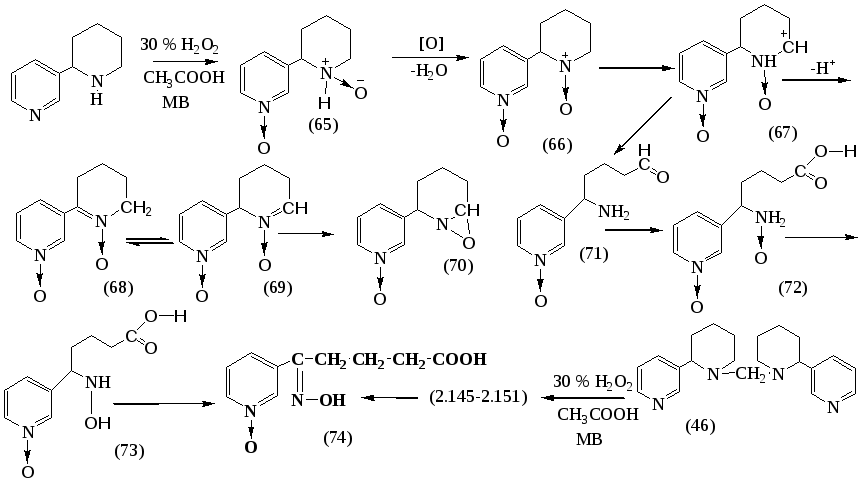
Окисления (46) протекает через образование тетра-N-оксида дианабазенилметана (75). Метиленовый мостик, связывающий два анабазиновых кольца, испытывает на себе сильное электроноакцепторное действие со стороны атома азота, усиленное электроноакцепторным влиянием атома кислорода, связанного с атомом азота посредством семиполярной связи. Компьютерное моделирование (75) с использованием программы HyperChem 8.06 показало, что связь N-C между
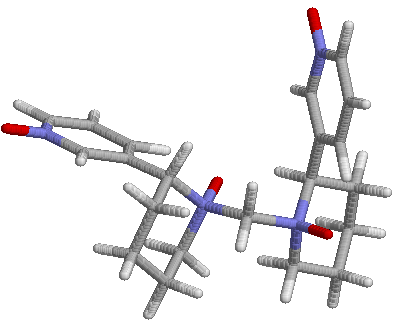
Рисунок 3- Пространственное
строение тетра-N-оксида дианабазинилметана (75)
|
|
метиленовым мостиком и анабазиновым скелетом составляет 1,57А. Обычно связь N-C значительно короче и составляет 1,48А. Значения длин связи С-Н также несколько больше и составляют 1,128 А, против обычных 1,1А. Положительный заряд на атомах водорода приблизительно на 30% больше, чем заряд на атомах водорода пиперидинового кольца и составляет 1,11 ед. заряда электрона. Таким образом, результаты компьютерного моделирования показывают стерическую доступность метиленового фрагмента для атаки атомарным кислородом, а завышенные значения длин связей между метиленовым атомом углерода и анабазиновым скелетом позволяют предположить, что именно эта связь разорвется первой в процессе окисления.
Реакция N-оксидирования 2-фенилхиноксалина была проведена по следующей схеме:
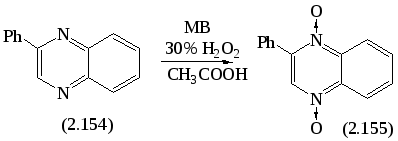
В ходе поиска оптимального сочетания мощности и времени реакции, установлено, что синтез 1,4-ди-N-оксида 2-фенилхиноксалина (2.155) легко протекает за 20 минут при мощности 90 Вт. Выход желаемого продукта составил 86,5 %. Строение соединения (2.155) было доказано данными ИК-, ЯМР1Н-спектроскопии и встречным синтезом в условиях конвекционного нагрева.
Разработан новый метод получения изоникотиновой кислоты (ИНК) заключающийся в МВА смеси 4-метилпиридина и разбавленной азотной кислоты на подложке из силикагеля. Наилучшие результаты (30%) были получены при мощности облучения 70Вт в течение 20 минут.
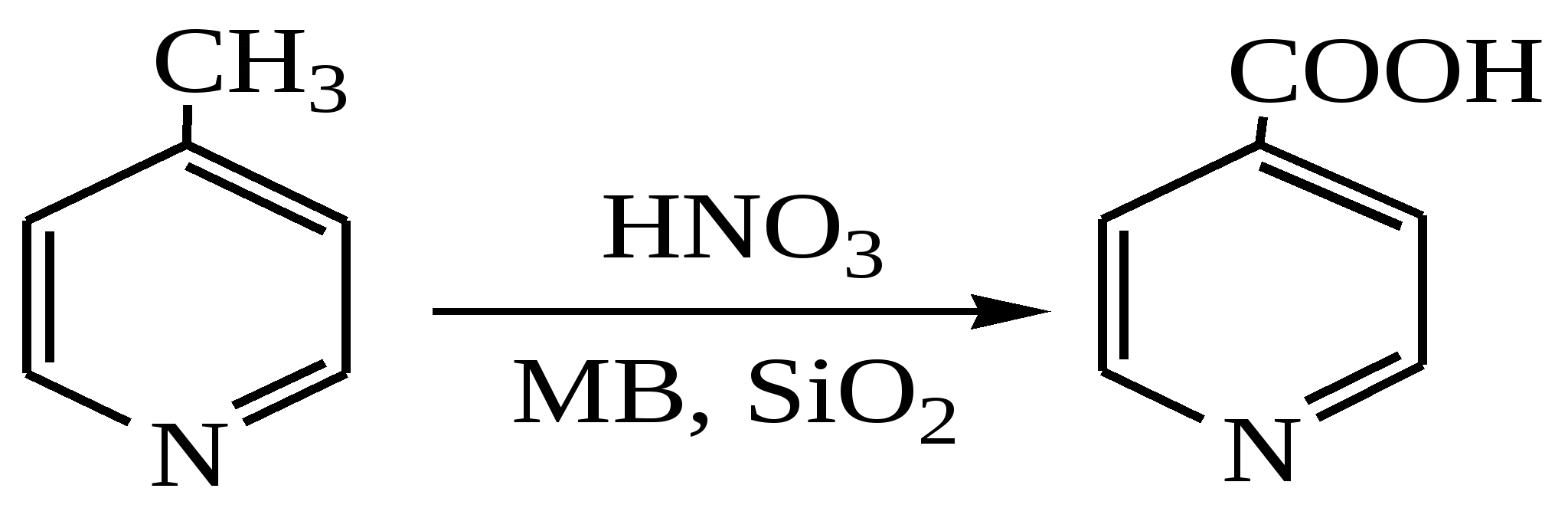
Часто используемым методом получения α-дикетонов является окисление карбонильных соединений диоксидом селена. Основной недостаток данного метода - длительность проведения процесса (3-15ч). В ходе работы было изучено окисление ацетофенона, циклогексанона, малонового и ацетоуксусного эфиров диоксидом селена в условиях МВА. Это позволило сократить время реакции до 2-4 минут. Реакция проводилась в среде диоксана по следующей схеме:
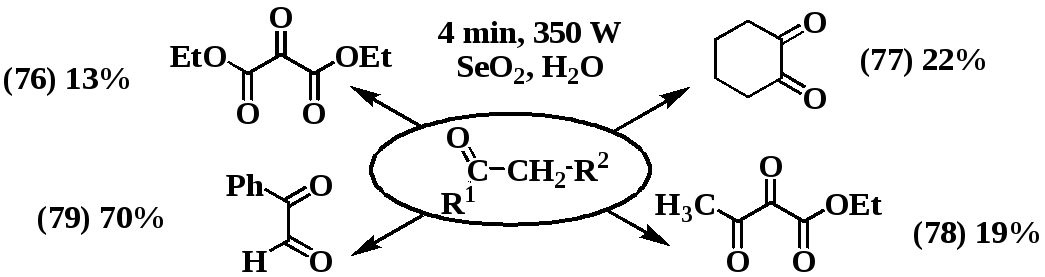
Выходы и физико-химические характеристики продуктов (76-79) совпали с описанными в литературе.
Хотелось бы отметить, что выход по селену, практически во всех случаях составляет 90-95 %, в то время как выход по веществу при окислении ацетофенона составляет 70 %. При окислении предельных соединений (циклогексанона) выход, и в классических условиях, и в условиях СВЧ-облучения составляет 19-25 %. Столь высокую разницу в выходе по селену и по веществу в случае использования предельных кетонов мы объясняем следующим циклом превращений:
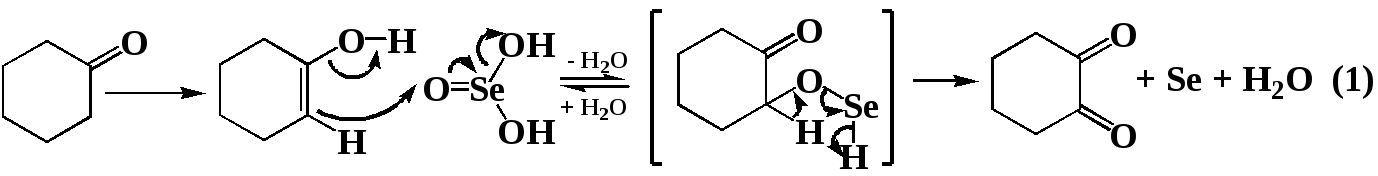
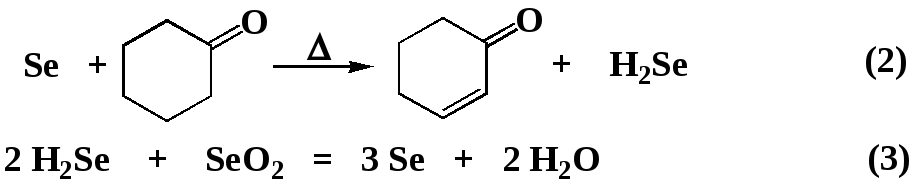
Окисление ацетофенона протекает в мягких условиях при МВА мощностью 350 Вт, и времени реакции 4-5 минут. Так как диоксан мало восприимчив к микроволновому облучению, а реакционная масса в конце облучения не нагревается даже до температуры кипения, то очевиден вывод – реакция протекает под влиянием специфического не термического микроволнового эффекта.
В литературе описан конвекционный метод окисления камфоры диоксидом селена до соответствующего дикетона, эту реакцию в условиях МВА провести не удалось. Независимо от условий проведения реакции, после обработки реакционной смеси, была выделена камфора. Вероятно жесткая каркасная структура камфары, отсутствие вращательных степеней свободы, делает ее невосприимчивой к МВА.
2.4 Новые методы синтеза 2-фенилпиразина, 2-фенилхиноксалина, производных 2-аминотиазола и их модификация в условиях микроволнового облучения
В данном подразделе, состоящем из трех пунктов (2.4.1-2.4.3), подробно рассмотрены традиционные методы синтеза потенциально биологически активных производных 2-фенилпиразина, 2-фенилхиноксалина и 2-аминотиазола. Подробно описана биологическая активность производных этих соединений и наиболее важные области их применения в технике.
Применение МВА оказалось эффективным для синтеза пиразинового кольца, что было подтверждено взаимодействием фенилглиоксаля с этилендиамином и орто-фенилендиамином как показано на схеме:
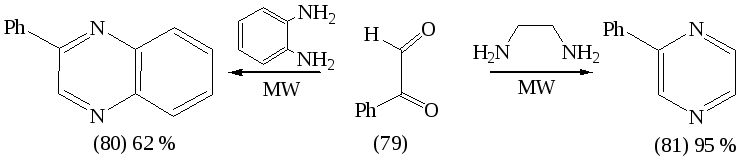
Реакция завершается в течение 2-5 минут при мощности облучения 350 Вт. Строение (80) и (81) доказано результатами элементного анализа, ИК-, ЯМР-1Н-спектроскопии.
В ходе выполнения эксперимента, была изучена возможность применения микроволнового облучения для синтеза 2-амино-4-фенилтиазола и его гомологов.
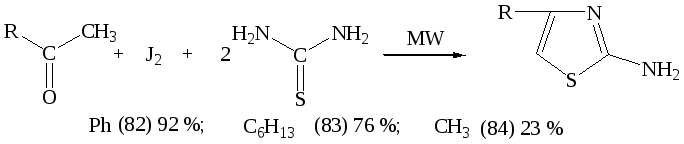
В ходе поиска оптимальных значений мощности излучения и времени реакции было установлено, что эффективно воздействует на скорость процесса МВА мощностью 350 Вт при времени экспозиции 5 минут.
Осуществить синтез 2-амино-4-метилтиазола (84) в описанных условиях удалось с выходом не более 20-25 %. Необходимо заметить, что в классических условиях (84) не образуется. Строение (82-84) подтверждено данными ИК- и ЯМР-1Н - спектроскопии, а также элементным анализом. Строение (83) подтверждено РСА.
Рентгеноструктурный эксперимент
Параметры ячейки и интенсивности 1751 независимых отражений соединения (83) измерены при 20оС на автоматическом четырехкружном дифрактометре «BrukerP4» c графическим монохроматором с использованием МоК-излучения (/2-сканирование, 2<55о). Кристаллы ромбические, а=13.4561 (7), в=14.6365(11), с=8.1348(4)Å, α=β=γ=90о, V=1602.15(7)Å3, dвыч.=1,279мг/м3, Z=8, (С7Н10N2S). Пространственная группа Рcnn. Окончательные факторы расходимости R = 0,065, WR2=0,177. Уточнение геометрии проведено по программе «SHELXL-97» Параметры ячейки и интенсивности 1751 независимых отражений соединения (83) измерены при 20оС на автоматическом четырехкружном дифрактометре «BrukerP4» c графическим монохроматором с использованием МоК-излучения (/2-сканирование, 2<55о). Кристаллы ромбические, а=13.4561 (7), в=14.6365(11), с=8.1348(4)Å, α=β=γ=90о, V=1602.15(7)Å3, dвыч.=1,279мг/м3, Z=8, (С7Н10N2S). Пространственная группа Рcnn. Окончательные факторы расходимости R = 0,065, WR2=0,177. Уточнение геометрии проведено по программе «SHELXL-97».
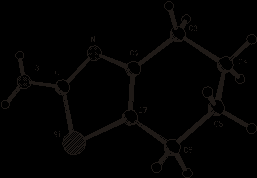
|
|
Рисунок 4 – Пространственное
строение 2-амино-3,4,5,6-тетра-гидробензотиазола (83)
|
|
Введение в 5-е положение 2-амино-4-фенилтиазола (82) биогенного амина проводилась в две стадии: взаимодействие (82) с молекулярным бромом в среде таких растворителей как хлороформ, 1,4-диоксан, тетрахлорметан, уксусная кислота в классических условиях. Наилучшим растворителем для реакции бромирования 2-амино-4-фенилтиазола является 1,4-диоксан.
Дальнейшая модификация проводилась аминированием 2-амино-5-бром-4-фенилтиазола (85) различными вторичными аминами и гидразином в условиях МВА по следующей схеме:
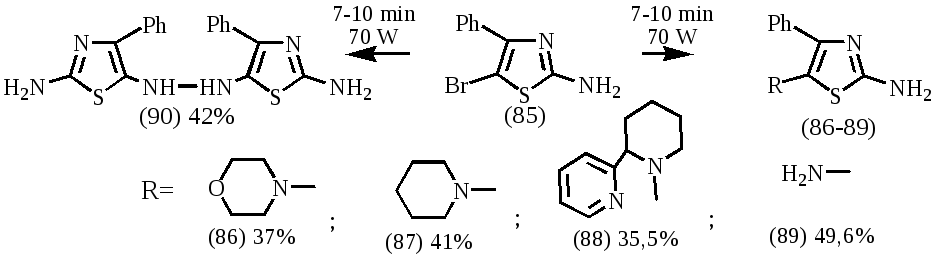
При проведении реакции аминирования низкокипящими аминами, такими как морфолин, пиперидин и гидразин, в роли растворителя выступал десятикратный мольный избыток амина. Алкилирование анабазина проводилось в среде триэтиламина. В процессе подбора оптимальных условий реакции найдено, что наилучшими является сочетание мощности микроволнового облучения 70 Вт при времени облучения 7-10 минут.
Строение полученных соединений однозначно подтверждают результаты ЯМР-1Н и ИК-спектроскопии, масс-спектрометрии и данные элементного анализа.
2.5 Новые методы проведения реакции Биджинелли в условиях микроволнового облучения
Подраздел состоит из трех пунктов (2.5.1-2.5.3) посвященных разработке новых методов синтеза 3,4-дигидропиримидинонов (-тионов) по реакции Биджинелли.
Реакция Биджинелли находит широчайшее применение в органическом синтезе, однако, несмотря на комплексную и всестороннюю изученность, проведение этой реакции в условиях конвекционного нагрева требует длительных временных затрат, применение растворителя, труднодоступных и дорогостоящих катализаторов.
Синтез 3,4-дигидропиримидинонов (-тионов) при МВА проведен по следующей схеме:
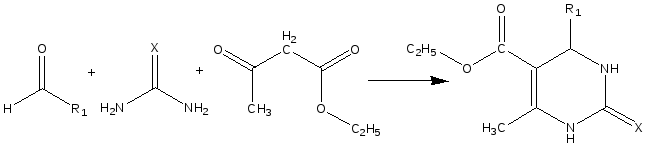
X=O; R= Ph (91, 78%), -CH(CH3)(C2H5) (92, 48%), 4-CH3OC6H4 (93, 79%), -CH(CH3)2 (94, 41%), 4-NO2OC6H4 (95, 90%), 4-(CH3)2NC6H4 (96, 90%)
X=S; R= Ph (97, 94.2%), -CH(CH3)(C2H5) (98, 64%), 4-CH3OC6H4 (99, 82.5%), -CH(CH3)2 (100, 67%), 4-NO2OC6H4 (101, 65.5%), 3-HOC6H4 (102, 82.5%), H(103, 27.2%)
В серии опытов, проведенных при варьировании растворителя, наилучшие результаты были получены при использовании изопропанола, мощности МВА 150Вт и времени 10 мин. Использование этанола и ДМФА было менее эффективно. Соотношение альдегида, ацетоуксусного эфира и мочевины (тиомочевины) в мольном соотношении составляли 1:1:1,5 соответственно. В качестве катализатора был использован N-бромсукцинимид.
Одной из современных тенденций проведения органического синтеза, с одной стороны снижающую экологическую опасность процесса, с другой -повышающую экономическую рентабельность, являются процессы, проводимые без растворителя. Так как реакция Биджинелли имеет промышленное значение, была проведена серия экспериментов в отсутствие растворителя. Установлено, в этом случае реакция завершается за 90-120 секунд при мощности излучения 150 Вт. Количества и соотношение реагентов такое же, как и в предыдущем примере.
Одним из специфических приемов органического синтеза в МВА, является проведение химической реакции на подложке, материале прозрачном в области сверхвысокочастотного излучения, обладающем каталитическими свойствами. В этой реакции в качестве подложки был использован силикагель, активированный следовыми количествами серной кислоты. Это позволило сократить время реакции до 30-50 секунд с выходом желаемого продукта 80-90 %. Мощность облучения составила 600 Вт. Также установлено, что при использовании подложки желаемый продукт получается более чистым.
Строение синтезированных веществ доказано результатами ИК-, ЯМР-1Н-спектроскопии, масс-спектрометрии и элементным анализом.
2.6 Новые методы синтеза некоторых известных лекарственных веществ в условиях микроволнового облучения
Подраздел состоит из 4 пунктов (2.6.1-2.6.4), в которых приведены результаты исследования новых методов синтеза широко востребованных медицинских препаратов. Таких как: симметричные и несимметричные 1,4-дигидропиридины, а также известных противотуберкулезных препаратов: «Изониазид», «Фтивазид», «Метазид».
Симметричные 1,4-дигидропиридины активно используются в медицинской практике. Классические методы синтеза производных данного класса имеют серьезный недостаток – длительность проведения реакции в среде токсичных растворителей. В ходе исследования разработан новый метод синтеза симметричных 1,4-дигидропиридинов в условиях МВА по схеме:
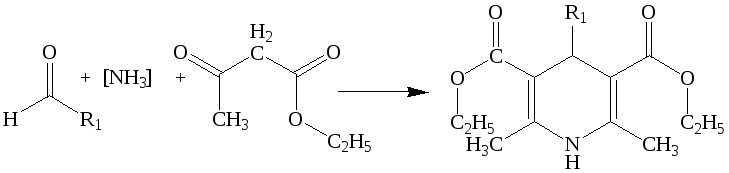
R= Ph (104, 86%), -CH(CH3)(C2H5) (105, 53%), 4-CH3OC6H4 (106, 64%), -CH(CH3)2 (107, 47%), 4-NO2OC6H4 (108, 82.6%), 3-NO2OC6H4 (109, 75%)
Наилучшие результаты были получены при проведении реакции без растворителя, при применении в качестве донора аммиака водный раствор ацетата аммония. При мощности облучения 600 Вт в течение 1-3 минут. В качестве донора аммиака может быть использован водный раствор аммиака и карбонат аммония. Разработана новая, эффективная методика синтеза действующего вещества промышленно востребованного 1,4-дигидропиридина - «Нитрендипина»
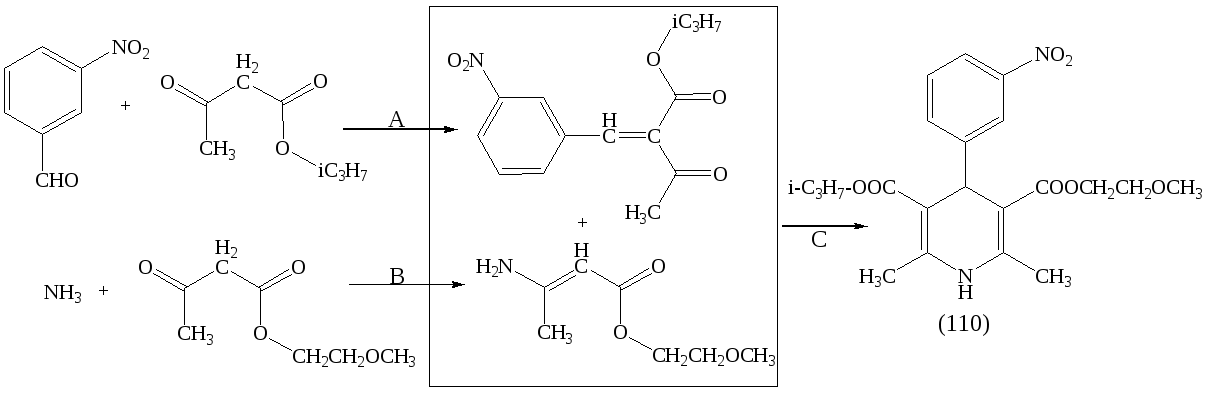
«Нимодипин» представляет собой несимметричный 1,4-дигидропиридин и может быть синтезирован в три стадии как это показано на схеме ниже.
Анализ литературы показал, что в условиях конвекционного нагрева стадия A завершается за 7-10 часов, стадия B – за 20-24 часа, а стадия C за 24-30 часов. Установлено, что применение МВА позволяет сократить время проведения каждой из стадий до 3 минут при мощности облучения 350 Вт. Реакция проведена без растворителя.
Показана принципиальная возможность одновременного проведения всех трех реакций в одной микроволновой печи. Строение (104-110) подтверждено результатами ИК-, ЯМР1Н - спектроскопии и масс-спектроскопии.
Известно, что в условиях конвекционного нагрева гидразид изоникотиновой кислоты (112) не образуется при взаимодействии изоникотиновой кислоты (111) с гидразином. В ходе экспериментальной работы была установлена возможность синтеза гидразида изоникотиновой кислоты взаимодействием изоникотиновой кислоты (ИНК) с 75% гидразин-гидратом в условиях микроволновой активации по схеме:
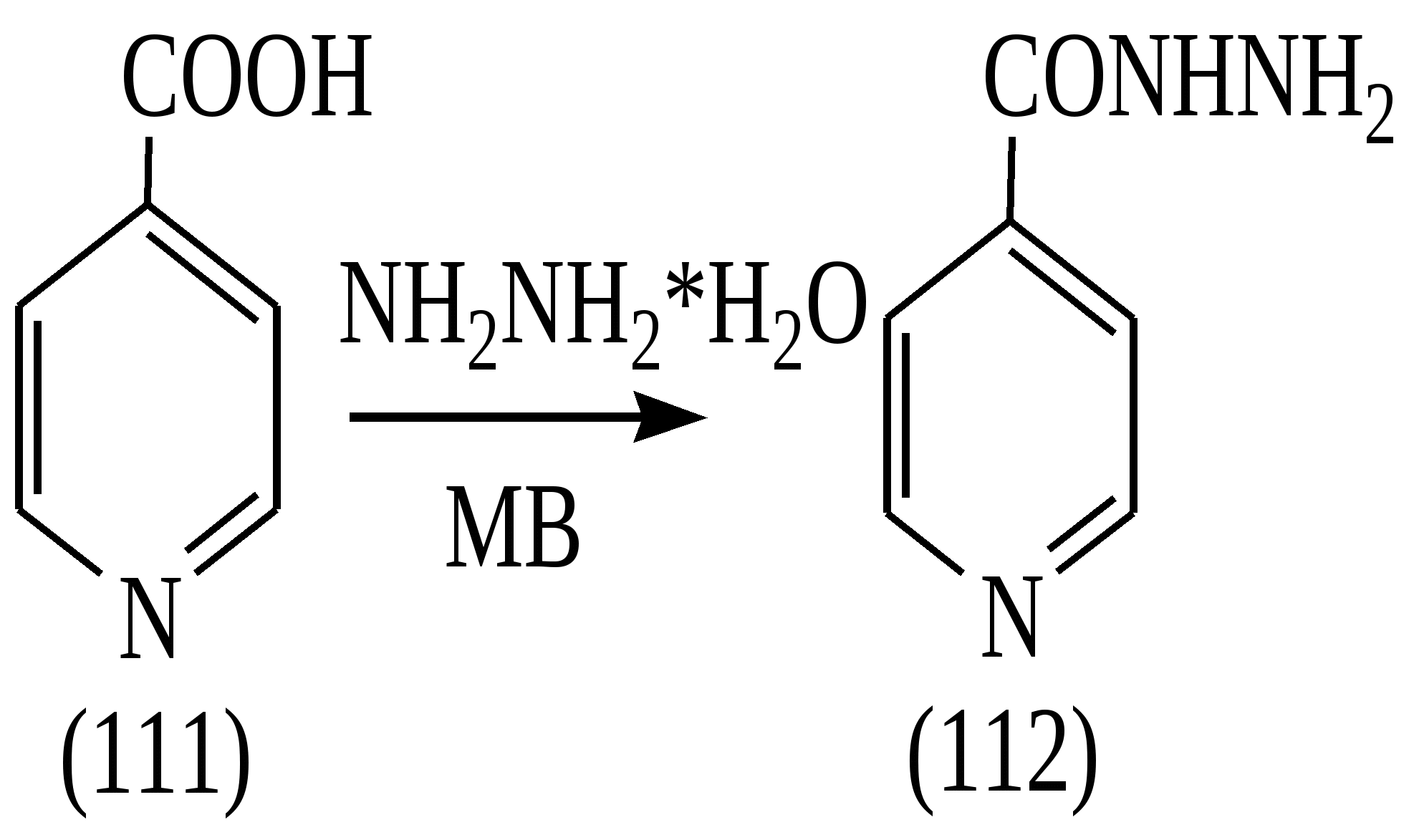
Необходимо заметить, что при проведении реакции гидразинирования никотиновой кислоты гидразин-гидратом в условиях аналогичных для ГИНКа, ожидаемый продукт - гидразид никотиновой кислоты не образуется.
С целью повышения выхода ГИНКа был использован метод математического планирования эксперимента и статистической обработки экспериментальных данных с выводом обобщенного уравнения по Малышеву. Эксперименты проводились по трехфакторной матрице на пяти уровнях. Результаты оценивались по выходу ГИНКа при влиянии следующих факторов: мощность излучения (Yw), время облучения (Y), коэффициент избытка гидразин-гидрата (Yk).
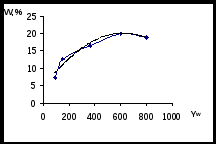
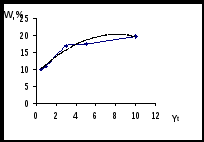
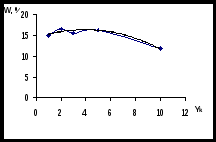
Рисунок 5 - Точечные графики и кривые аппроксимации для оптимизации
процесса синтеза ГИНКа
Таким образом, обобщенное уравнение Протодъяконова для процесса синтеза «Изониазида» можно представить следующим образом (4):
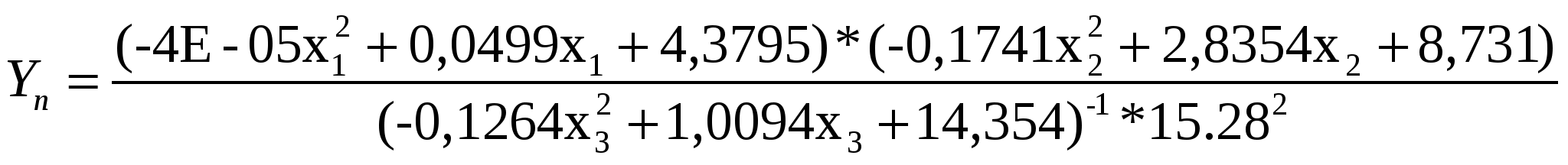
(4)
На основании проведенных исследований установлены следующие оптимальные условия синтеза ГИНКа: мощность МВА – 600 Вт, время МВА – 10 мин, коэффициент избытка гидразин-гидрата – 2. Выход ГИНКа – 30%.
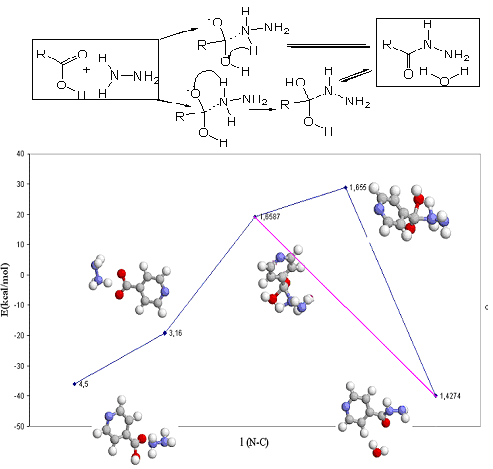
С использованием методов компьютерного моделирования (HyperChem 8.06, Mopac 7.0), был осуществлен расчет энергии образования исходных и конечных продуктов, энергии образования переходного состояния процесса гидразинолиза ИНК. Предложены два пути образования ГИНКа: перегруппировка соли в конечный продукт; замещение гидразином гидроксильной группы по нуклеофильному механизму – взаимодействием электронной пары атома азота по карбонильному атому углерода. Из данных графика (рисунок 6) следует, что энергия образования исходных продуктов составляет -36,01 ккал/моль. Это на 4 ккал/моль больше энергии образования конечных продуктов.
Таким образом, в условиях термодинамического контроля должна существовать равновесная смесь исходных и конечных продуктов, что и наблюдается в ходе проведения эксперимента.
|
|
Рисунок 6 - График зависимости энергии образования от координаты реакции
|
Энергии активации прямых и обратных процессов отличаются на 4 ккал/моль и составляют соответственно 55 и 59 (направление А) для первого направления и 68 и 64 ккал/моль для второго направления (В) течения реакции. На основании расчетов и известных литературных данных можно сделать вывод о том, что решающую роль в образовании ГИНКа играет специфический микроволновой эффект. Незначительная разница в энергиях активации прямой и обратной реакции (4 ккал/моль) показывает, что реакция гидразинолиза ИНК является обратимой.
Аналитические методы «Зеленой химии» позволяют количественно оценить экологическую опасность химического процесса. Одним из основных показателей является величина атомной экономии (АЭ), показывающая, сколько атомов исходных реагентов вошло в состав продукта. Чем выше значение АЭ – тем более экологически чистым является процесс.
Суммарное уравнение получения ГИНКа в условиях конвекционного нагрева:
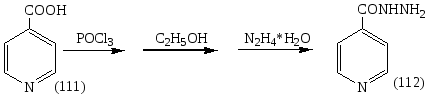
Реагенты: Mr (ИНК) = 123; Mr (POCl3) = 153,5; Mr (C2H5OH) = 46, Mr (N2H4*H2O) = 50. Продукт: Mr (ГИНК) = 137. Атомная экономия классического метода получения ГИНКа составляет 36,77%.
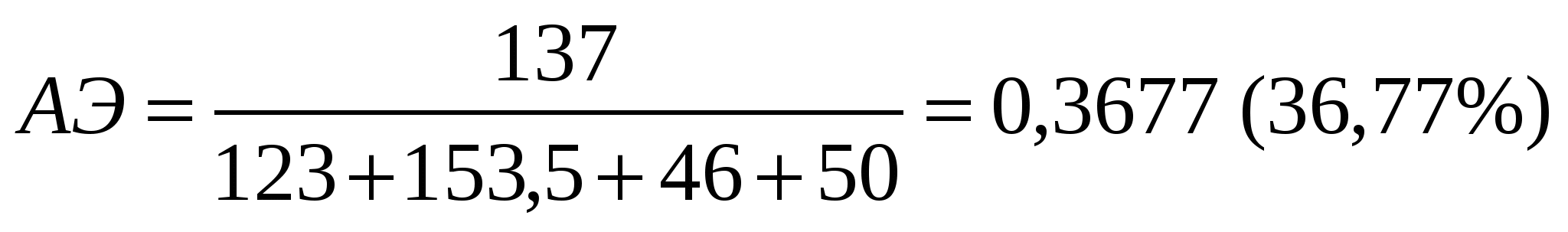
(5)
Суммарное уравнение метода получения ГИНКа в условиях МВА:
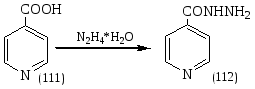
Реагенты: Mr (ИНК) = 123; Mr (N2H4*H2O) = 50. Продукт: Mr (ГИНК) = 137.
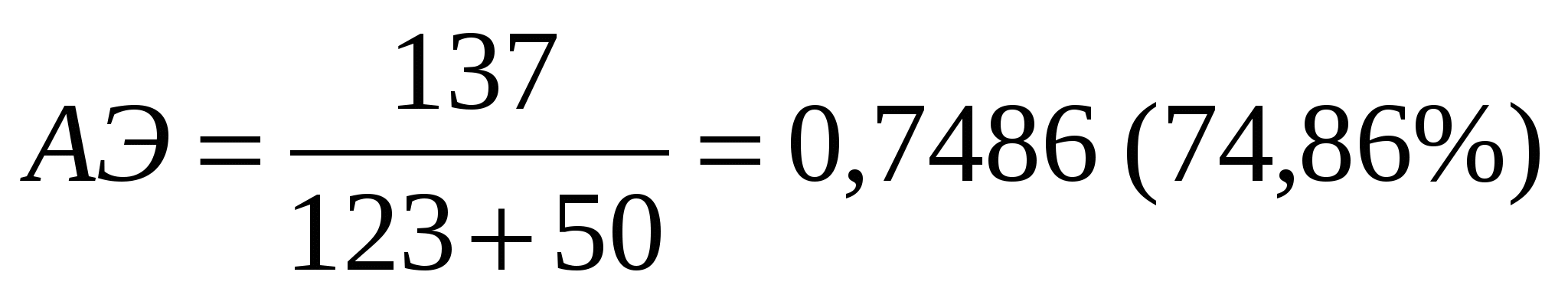
(6)
Сравнение значений АЭ в классических условиях (36,7%) и МВА (74,8%), а также времени протекания реакции показали, что предложенный способ синтеза известного противотуберкулезного препарата «Изониазид» в условиях МВА является методом, отвечающим требованиям экологической чистоты и безопасности концепции «Зеленая химия», что позволяет рассматривать его как перспективный промышленный метод его производства.
На основе ГИНКа были разработаны методы синтеза действующих компонентов проверенных и эффективных противотуберкулезных препаратов: «Фтивазид» (113) и «Метазид» (114) в условиях МВО по следующей схеме:
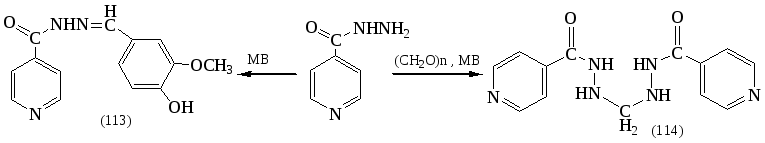
Применение микроволнового излучения позволило сократить время синтеза (114) с 3ч. до 1-2 мин, а (113) с 2 ч. до 30 сек. Выходы «Фтивазида» и «Метазида» составили 97 и 95% соответственно.