страница 1 страница 2 ... страница 4 | страница 5
ФИЗИКА ТОНКИХ ПЛЕНОК И МАЛЫХ ЧАСТИЦ
Конспект лекций
Лекция 1
ВВЕДЕНИЕ
Понятие тонкопленочного состояния вещества. Малые частицы, кластеры. Основные определения, Применение тонких пленок в различных областях науки, техники, технологии микроэлектроники.
Программа курса, особенности прохождения.
Методические указания студентам.
Основная и дополнительная литература.
Свойства тонкой пленки могут сильно отличаться от свойств массивного материала, особенно если толщина пленок очень мала. Эти отличия обусловлены спецификой структуры пленки, которая, очевидно, обусловлена процессами, происходящими во время формирования пленки.
Пленку можно получить с помощью таких простых процессов, как ковка или прокатка массивного куска материала. Но как правило, тонкие пленки получают путем осаждения атом за атомом, например путем конденсации из паровой фазы или электролитическое осаждение металлической пленки из раствора. Получение пленок с помощью вакуумного напыления или газотранспортных реакций представляет наибольший интерес с практической точки зрения.
Конденсация означает переход из газообразного состояния в жидкое или твердое.
С точки зрения термодинамики, для того, чтобы происходила конденсация необходимо, чтобы парциальное давление соответствующего газообразного материала было равно или больше равновесного давления паров этого материала над конденсированной фазой при данной температуре. Конденсация начинается с соединения нескольких адсорбированных атомов в небольшие скопления, которые называются зародышевыми центрами, или зародышами, а процесс их образования – зародышеобразованием. Процесс увеличения зародышевого центра и образование, в конце концов, однородной пленки называется ростом пленки. Часто образование зародышей и их рост происходят одновременно в процессе образования пленки.
Процесс конденсации нельзя рассматривать просто как случайное падение на подложку липких шариков (атомов или малых частиц, состоящих из группы атомов), которые прилипают там же, где упали. Напротив, адсорбированные атомы обладают большой поверхностной подвижностью, и в результате ярко выраженные островки из материала пленки образуются на подложке даже спустя длительное время после образования зародышей. В конце концов, эти островки сливаются и образуют непрерывную пленку, это происходит, когда средняя толщина пленки составит по крайней мере несколько атомных слоев.
Широкое и разнообразное применение тонких пленок в различных научно-технических областях. Оптика. Машиностроение. Приборостроение. Медицина. Архитектура и строительство. Бытовые приборы. Радиоэлектроника, электроника и микроэлектроника.
Лекция 2
Падение частиц на подложку, процессы при взаимодействии атомов, молекул и радикалов с поверхностью
Падение частиц на подложку, адсорбция и термическая аккомодация, процессы при взаимодействии атомов, молекул и радикалов с поверхностью
Во всех теориях зародышеобразования первым этапом считается столкновение атомов или молекул пара с подложкой. В результате столкновения частицы пара могут адсорбироваться и прочно закрепиться на подложке, могут через конечный промежуток времени после адсорбции снова испариться, а могут и мгновенно упруго отразиться от подложки.
В общем случае незаряженные нейтральные частицы (НЧ) пара падают на поверхность с энергиями, значительно большими kT, где T – температура подложки. Поэтому возникает вопрос, сможет ли такая частица, например атом пара достаточно быстро прийти в равновесие с подложкой так, чтобы смогла произойти его адсорбция, или он отразится от подложки, не отдав ей при этом всей своей энергии. В последнем случае, коэффициент термической аккомодации, который определяется как
T = (Ev – Er) / (Ev – E) = (Tv – Tr) / (Tv – T), (1)
будет меньше единицы. Ev – кинетическая энергия атома пара, падающего на подложку; Er – энергия десорбированного атома до установления равновесия с подложкой; E – энергия десорбированного атома после установления равновесия с подложкой; Tv, Tr, T – соответствующие температуры.
Мак-Фи и Леннард-Джонс показали, что время, необходимое для того, чтобы падающий атом потерял свою избыточную кинетическую энергию и закрепился на подложке, порядка 2/, где частота колебаний решетки в подложке. Таким образом, атом, столкнувшись с подложкой, за несколько колебаний решетки теряет почти всю свою избыточную энергию. Поэтому будем в дальнейшем полагать, что установление равновесия происходит мгновенно.
Классификация процессов.
Процессы взаимодействия НЧ с поверхностью можно разделить на группы:
-
процессы, происходящие на поверхности и в тонком приповерхностном слое и приводящие к адсорбции или отражению первичных НЧ, диффузии адсорбированных частиц, внедрению НЧ в приповерхностный слой, нагреву поверхности;
-
эмиссионные процессы: эмиссия электронов, физическое и химическое распыление, десорбция первичных НЧ и слабосвязанных физически адсорбированных инородных частиц
Отражение первичных НЧ.
а). Упругое отражение без изменения кинетической энергии НЧ.
Такой процесс наблюдается при энергии падающей на поверхность частицы Е0 от 0,03 до 0,5 эВ. Коэффициент отражения составляет от 10-3 до 10-1 в зависимости от типа НЧ и материала поверхности и растет в этих пределах с уменьшением поляризуемости НЧ.
б). Упругое отражение с обменом кинетической энергией.
Такой процесс наблюдается при Е0 < 0,5 эВ. Коэффициент отражения лежит в интервале 0,8 – 0,95. Обмен энергией между НЧ и твердым телом возможен в том случае, когда падающая НЧ находится некоторое время в адсорбированном состоянии.
Для многоатомных НЧ в обмене энергией могут принимать участие не только кинетическая энергия, но и вращательная и колебательная. Коэффициент аккомодации в этом случае будет больше, чем для одноатомных НЧ и включает в себя три парциальных коэффициента, соответствующих каждому виду энергии. Для большинства металлических поверхностей при столкновении с молекулами N2, O2, CO2, CnHm, SF6 коэффициент аккомодации лежит в интервале 0,5 – 0,95. Максимальное значение, равное 0,98, он принимает для молекулы H2O.
в). Неупругое отражение с поверхностной ионизацией.
Часть падающих НЧ может покинуть поверхность в ионизованном состоянии, т.е. приобрести или положительный или отрицательный единичный заряд.
Наиболее ярко положительная ионизация наблюдается при столкновении атомов щелочных металлов или их галогенидов (KF, KBr, KCl) с нагретыми поверхностями тугоплавких металлов. Например, при столкновении атомов К с поверхностью Pt, нагретой до температуры 1800 К, коэффициент ионизации (отношение числа отраженных ионов к числу падающих атомов) составляет 0,25.
Отрицательная ионизация наблюдается при столкновении электроотрицательных НЧ с нагретыми поверхностями. В этом случае частица захватывает с поверхности электрон. Типичные примеры таких НЧ – F, Cl, Br, O, NO, O2.
г). Неупругое отражение с поверхностным тушением.
Если падающая НЧ находится в возбужденном состоянии, то в процессе отражения она переходит в основное с вероятностью близкой к единице.
Эмиссия электронов.
Обнаружено два механизма эмиссии электронов при взаимодействии НЧ с поверхностями: потенциальная и кинетическая эмиссия. Потенциальная эмиссия происходит при условии, когда НЧ обладает внутренней энергией Ев (энергией возбуждения) и она превышает работу выхода электрона e. Возбужденные НЧ имеют высокую поляризуемость (большой дипольный момент). При их приближении к поверхности на расстояние 2 – 3 Å происходит полевое вырывание электрона и тушение частицы. Максимальная энергия эмитированного электрона равна Ев – e. Коэффициент эмиссии при столкновении метастабильных возбужденных атомов Ar и He с поверхностью металлов порядка 0,05, с поверхностью полупроводников – 0,001.
Кинетическая эмиссия происходит, если не выполняется условие для потенциальной и кинетическая энергия частицы Е0 превышает 500 эВ. Механизм эмиссии сводится к ударной ионизации частицы поверхности. Коэффициент эмиссии растет от 10–3 до 5.10–2 при облучении металлов атомами Ar с Е0 от 0,7 до 2 кэВ.
Физическое распыление поверхности.
Это процесс удаления (выбивания) с поверхности атомов (молекул, радикалов), принадлежащих материалу поверхности, под действием падающих НЧ. Процесс относится к пороговым, т.к. Е0 должна быть больше или равна энергии связи частиц поверхности ЕСВ. Для очень широкого круга материалов поверхности (от Be до Au) ЕСВ = 15 – 30 эВ. При Е0 > Есв коэффициент распыления весьма низок и может достигать 10–3 – 10–4 из-за низкой энергии НЧ. Процесс можно наблюдать лишь при использовании ионно-лучевых, ионно-плазменных и ионных источников НЧ.
Десорбция слабосвязанных инородных частиц.
Это процесс удаления с поверхности физически адсорбированных инородных частиц, т.е. частиц с энергией связи ЕСВ = 0,01 – 0,5 эВ. Процесс относится к пороговым, т.к. Е0 должно превышать ЕСВ. При их отличии на порядок и более вероятность десорбции превышает 0,5.
Адсорбция падающих НЧ.
Это процесс прилипания падающих НЧ к поверхности под действием сил связи (притяжения).
Силы связи при адсорбции.
При приближении НЧ к поверхности на расстояние меньше 10 Å между ней и частицами поверхности возникают силы взаимодействия. Различают три предельных типа сил взаимодействия, приводящих к адсорбции: силы Ван-дер-ваальса, обменные и гетерополярные.
Адсорбцию под действием сил Ван-дер-ваальса называют физической. Силы Ван-дер-ваальса – это электростатически наведенные силы, обусловленные деформацией внешних электронных оболочек. Они относятся к слабым силам. Энергия связи под действием этих сил составляет 0,01 – 0,3 эВ в зависимости от материала поверхности и рода НЧ. Силы проявляются при приближении НЧ к поверхности на расстояние 3 – 10 Å и относятся к дальнодействующим. Особенностью этих сил является отсутствие у них активационного барьера. Силами Ван-дер-ваальса в основном обусловлена физическая адсорбция органических молекул, атмосферных частиц, многоатомных молекул и инертных газов.
Силы Ван-дер-ваальса в свою очередь делятся на ориентационные, индукционные и дисперсионные. Ориентационные силы возникают между частицами с постоянными дипольными моментами. Индукционные силы возникают между частицами с постоянным и наведенным дипольным моментом или наведенным зарядом (для металлических и полупроводниковых поверхностей). Дисперсионные силы возникают при корреляции между флуктуирующими дипольными моментами.
При физической адсорбции инертных газов, а также молекул N2, O2, и H2 преобладают дисперсионные силы. При физической адсорбции молекул H2O, CO, и NH3 преобладают ориентационные силы.
Адсорбция под действием обменных сил называется химической или слабой хемосорбцией. Обменные силы возникают при перекрытии электронных оболочек взаимодействующих частиц и обусловлены электронными переходами между НЧ и частицей поверхности. Эти силы проявляются при расстояниях 1 – 3 Å и относятся к короткодействующим. Обменные силы приводят к образованию химической ковалентной связи между НЧ и частицей поверхности. Такая связь образуется двумя электронами с противоположными спинами, принадлежащими двум атомам. Энергия связи – единицы эВ. Для НЧ, совпадающих с материалом поверхности, энергия связи может достигать
30 эВ.
Для молекулярных НЧ возникновение обменных сил требует энергии активации (например, для разрыва замкнутых поверхностных связей или диссоциации падающей НЧ). Для идеальных поверхностей, например, поверхности Si, полученной сколом в вакууме, химическая адсорбция атомов металла происходит без подвода энергии активации. Причем прочность соединения (силицид) выше прочности каждого из материалов в отдельности.
Адсорбция под действием гетерополярных (или кулоновских) сил называется сильной хемосорбцией. Гетерополярные силы возникают при передаче электрона от НЧ к поверхности или наоборот. На поверхности образуется слой ионов, который индуцирует в материале поверхности заряд обратного знака. Под действием гетерополярных сил возникает ионная связь. Энергия связи превышает эту величину для обменных сил и составляет единицы эВ. Для возникновения гетерополярных сил НЧ должна приблизиться к поверхности на 1 – 2 Å.
Потенциальные кривые адсорбции. Десорбция и миграция.
Процесс адсорбции НЧ хорошо иллюстрируется потенциальными кривыми адсорбции, показывающими зависимость потенциальной энергии W НЧ от ее расстояния r до поверхности (рис. 2.1).
На участках кривых 1 и 2, где dW/dr > 0 действуют силы притяжения, при обратном знаке производной – силы отталкивания.
Адсорбция, описываемая кривой 1, происходит при столкновении с поверхностью НЧ, не обладающих внутренней энергией (энергия возбуждения и диссоциации). Примерами таких частиц могут быть молекулы N2, O2, H2, H2O и т.д., атомы инертных газов, атомы металлов и полупроводников, если материал поверхности не совпадает с родом НЧ. Адсорбция, описываемая кривой 2, происходит для НЧ, имеющих внутреннюю энергию. Такими НЧ являются возбужденные химически устойчивые молекулы, молекулярные радикалы в основном и возбужденном состоянии, атомы, обладающие свободными химическими связями (например, N, O, H, OH) и способные образовать химическое соединение с частицами поверхности.
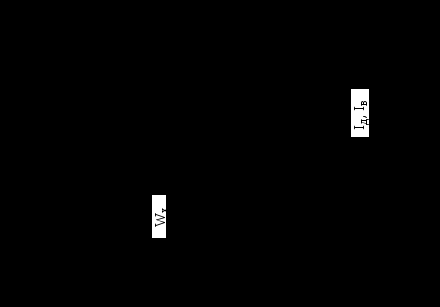
Рис. 2.1. Потенциальные кривые абсорбции: 1 – кривая физической адсорбции; 2 – кривая химической адсорбции; Wф и Wх – глубина потенциальной ямы или энергия связи для физической и химической адсорбции соответственно;
Wa – энергия активации; Iд и Iв – энергия (потенциал) диссоциации и возбуждения соответственно.
Рассмотрим особенности адсорбции НЧ, используя кривые рис. 2.1.
а). Физическая адсорбция.
В зависимости от Е0 падающей НЧ возможны следующие случаи:
-
Е0 > Wф. В этом случае произойдет упругое отражение без передачи кинетической энергии. НЧ совершит одно колебание в потенциальной яме и покинет поверхность. Период колебания t0 порядка 10-12 с. Если Е0 близкок Wф, то НЧ совершит от 2 до 103 колебаний с уменьшающейся амплитудой и произойдет ее упругое отражение с передачей кинетической энергии.
-
E0 >> Wф и Wa. В этом случае произойдет внедрение НЧ в поверхность, которое может с малой вероятностью сопровождаться процессом физического распыления или эмиссии электрона.
-
Е0 равна или немного превышает величину (Wф + Wа). В этом случае частица достигнет точку М, где возможна ее диссоциация и переход полученных радикалов на кривую 2.
-
Е0 < Wф. В этом случае произойдет физическая адсорбция. НЧ будет колебаться в потенциальной яме с конечной установившейся амплитудой rф1 – rф2. НЧ увеличит или уменьшит свою кинетическую энергию в зависимости от температуры поверхности.
Адсорбция характеризуется понижением свободной энергии поверхности и убылью энтропии из-за потери некоторых степеней свободы НЧ. В результате адсорбция является экзотермическим процессом и сопровождается выделением тепла. Теплота физической адсорбции Qа зависит от сорта НЧ и материала поверхности и не превышает 108 Дж/кмоль. Например, при адсорбции на углерод паров воды Qa = 0,9.108 и азота –
0,1.108 Дж/кмоль.
Частица, попавшая в потенциальную яму, будет находиться в ней промежуток времени, называемый временем абсорбции ta.
ta = t0exp(Qa/RT)
Например, для НЧ воздуха при Т = 293 К ta порядка 10–10 с, а при
Т = 77 К (температура жидкого азота ta порядка секунды. Для паров воды ta порядка 102 с при комнатной температуре.
По истечении времени t > ta происходит самостоятельная десорбция НЧ с поверхности. Если частица покинула поверхность за время t0 < t < ta, то этот процесс называют вынужденной десорбцией. Вынужденная десорбция может произойти только при передаче адсорбированной НЧ кинетической энергии путем столкновения с ней другой частицы. Такими частицами могут быть налетающие на поверхность ионы, атомы, молекулы, радикалы, фотоны, электроны. Следует отметить, что при столкновении адсорбированной НЧ с электроном или фотоном наиболее вероятны процессы возбуждения и диссоциации и в итоге переход НЧ на кривую 2.
Глубина потенциальной ямы неоднородна вдоль поверхности. Особенно это проявляется для физически и механически неоднородных поверхностей. Даже для идеальных поверхностей глубина потенциальной ямы больше в местах, соответствующих центрам поверхностных частиц. По этой причине физически адсорбированная НЧ может перемещаться (мигрировать) по поверхности, периодически перескакивая из одной более глубокой ямы в другую. Такой процесс называют миграцией адсорбированных частиц. Время нахождения НЧ в одной яме (время между скачками) называют временем миграции tm. Его величину можно оценить по формуле
tm = t0exp(Qm /RT),
где Qm – теплота миграции. Qm < Qa и зависит от типа решетки и степени неидеальности поверхности, возрастая с ростом последней. Например, для идеальной кубической решетки Qm = 0,5Qa и число скачков n за время адсорбции n = ta/tm = 107. Путь, пройденный частицей за время адсорбции,
L = nD = 0,5 см при D = 5 Å, где D – постоянная решетки. Для неидеальных поверхностей с высокой плотностью поверхностных дефектов и механической неоднородностью минимумы Wф могут быть аномально большими. Это приводит к резкому росту ta и tm.
Миграция – один из ключевых моментов механизма образования пленочных покрытий на поверхности.
б). Химическая адсорбция.
В зависимости от Е0 падающей НЧ возможны следующие случаи:
-
E0 > Wx + Iд (Iв). НЧ упруго или неупруго отразится от поверхности с передачей или нет кинетической энергии.
-
E0 >> Wx + Iд (Iв). Произойдет внедрение НЧ в приповерхностный слой.
-
E0 < Wx + Iд (Iв). Произойдет химическая адсорбция НЧ с установившейся конечной амплитудой колебаний rХ1 – rХ2.
Теплота химической адсорбции в 2 –5 раза больше чем физической. Время адсорбции и миграции на несколько порядков выше. Вероятность самопроизвольной десорбции очень мала. Для вынужденной десорбции необходима энергия Wx + Wa или Wx + Iд, что значительно больше нежели в случае физической адсорбции.
Пересечение кривых 1 и 2 (т. М рис. 2.1) позволяет для нерадикальных НЧ ступенчато переходить от физической к химической адсорбции, преодолев активационный барьер (Wa плюс потенциальная энергия частицы в яме) за счет получения энергии от внешних частиц, включая и частицы твердого тела. В последнем случае это возможно при нагреве поверхности. Конечно, процесс перехода из физической ямы в химическую сопровождается диссоциацией НЧ.
Внедрение НЧ (Атомная имплантация).
Процесс наблюдается при Е0 больше единиц эВ. Глубина внедрения ограничивается в основном потерями энергии в процессах упругого рассеяния НЧ при их движении и составляет 5 – 100 Å при Е0 = 10 – 50 эВ. Концентрация внедренных НЧ по направлению, перпендикулярному к поверхности, плавно спадает от максимального значения на поверхности.
Диффузия адсорбированных НЧ и растворение газов.
При взаимодействии стационарного потока НЧ с поверхностью на ней устанавливается некоторая поверхностная плотность Ns адсорбированных частиц. Величина Ns зависит от материала поверхности, степени идеальности и температуры, сорта и плотности потока НЧ. При достаточно интенсивных потоках НЧ адсорбированные частицы могут образовывать сплошной моноатомный слой (порядка 1015 см-2). Дальнейший рост плотности потока НЧ может привести к многослойной адсорбции. Указанное создает необходимые условия для диффузии адсорбированных частиц в глубь материала поверхности.
Процесс диффузии хорошо описывается законами Фико:
I = – D(dN/dx),
N/t = D(2N/x2),
где I – плотность диффузионного потока, D – коэффициент диффузии, N – объемная плотность частиц в поверxностном слое, х – координата вглубь твердого тела.
Граничным условием для решения системы уравнений является то, что N(0,t) = Ns = const и при бесконечно большом времени N не может превысить величину N*, где N* – предельная растворимость данного сорта НЧ и данном материале поверхности.
Решение уравнений Фико в рассматриваемом случае имеет вид:
N(x,t) = Ns.erfc[(x/2) (Dt)–0,5]
Графически вид решения представлен на рис. 2.2.

Рис. 2.2. Распределение плотности диффундированных в поверхность НЧ для различных моментов времени. Здесь τ2 > τ1.
Химическое травление (распыление).
Это процесс удаления с поверхности частиц, принадлежащих материалу поверхности, в результате химических реакций между адсорбированными НЧ и частицами поверхности.
Необходимым условием процесса является возможность образования «летучих» и стабильных при температуре поверхности Тп химических соединений. Термин «летучее» соединение означает, что при Тп продукт реакции испаряется с поверхности, т.е. химическое травление возможно при Тп больше или равной температуре кипения соединения.
Большинство металлов, полупроводников, а также их оксиды и нитриды образуют «летучие» соединения с относительно низкой температурой кипения с продуктами диссоциации фтор- и хлорсодержащих газов (CCl4, CF4, SF6, BCl4 и т.д.). Летучими соединениями являютcя: AlCl3, SiF4, TiF4, MoF6, AuCl3 и т.д. Температура кипения этих соединений лежит в интервале от 180 К (AlCl3) до 557 К (TiF4).
Реакции с образованием летучих соединений могут идти как с участием радикалов, падающих на поверхность, так и с участием молекул, физически адсорбированных на поверхности. В последнем случае должен происходить переход от физической к химической адсорбции путем стимуляции диссоциации потоками электронов, фотонов, ионов.
Нагрев поверхности.
Ряд из выше перечисленных процессов взаимодействия НЧ с поверхностью сопровождается выделением тепла. А именно, процесс неупругого отражения, физического распыления, атомной имплантации, адсорбции, химического распыления. Поскольку эти процессы происходят или на поверхности или на очень малых глубинах, меньших 0,01 мкм, то энерговыделение можно считать поверхностным. В уравнении теплопроводности необходимо решать одномерную задачу. Решение уравнения теплопроводности всегда приводит к тому, что максимальная температура достигается на поверхности.
В некоторых случаях химического распыления, а также для процессов поверхностной ионизации и эмиссии электронов происходит снижение температуры поверхности. В этих случаях количество выделенной падающими НЧ энергии меньше энергии затраченной на образование летучих продуктов или ионизацию.
Лекция 3
Процесс зародышеобразования
Адсорбированные атомы могут мигрировать по поверхности, сталкиваясь с другими атомами могут объединяться в малые частицы (кластеры) или иначе называемые зародышами. Они, по сравнению с отдельными атомами, должны быть более устойчивы к повторному испарению. В большинстве теорий постулируется, что как только зародыш достигнет определенной критической величины, в среднем, он уже не распадается на отдельные атомы, а растет.
Существуют две основные теории зародышеобразования в тонких пленках, основанные на капиллярной и атомной моделях, которые отличаются в подходе к вычислению энергии образования зародышей. Существует и третья заслуживающая внимания модель, в которой подчеркивается возможность испарения кластеров с подложки. Капиллярная модель предсказывает, что изменение свободной энергии при образовании зародыша имеет максимум, т.е. зародыш по мере роста и прохождения через критический размер имеет минимум устойчивости по отношении к диссоциации в паровую фазу. Максимум свободной энергии получается в результате конкуренции двух параметров: очень большого отношения поверхности к объему в малых зародышах, из-за которого их устойчивость уменьшается и наличия энергии конденсации (энергии связей между атомами), увеличивающей устойчивость зародышей с увеличением их размера (рис. 2.3). Таким образом, зародыши, превысившие критический размер, быстро повышают свою устойчивость с каждым присоединенным атомом, и процесс их разрушения и испарения становиться маловероятным.
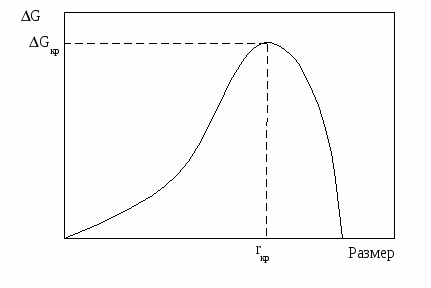
Рис. 2.3. Зависимость свободной энергии образования
зародыша от его размера.
По-видимому, наилучшей методикой изучения зародышеобразования является проведение процесса осаждения внутри электронного микроскопа, т.к. это дает возможность непосредственно наблюдать за образованием кластеров и измерять их размеры.
Размер критического зародыша и следовательно зернистость пленки сильно зависят от природы металла, для тугоплавких металлов (с высокой температурой кипения), таких как W, Mo, Ta, Pt и Ni, даже очень маленькие зародыши являются устойчивыми. У металлов с низкой температурой кипения, таких как Cd, Mg, и Zn, зародыши должны стать достаточно большими, прежде чем они станут устойчивыми, их устойчивость с увеличением размера растет очень медленно, диссоциация или повторное испарение при этом остаются вероятными. Критические зародыши должны иметь бóльшие размеры, если поверхностная энергия конденсируемого материала велика, а материала подложки мала.
Чем сильнее связь между адатомами и подложкой, тем меньше критический зародыш и тем больше частота зародышеобразования.
Увеличение температуры подложки приведет к увеличению размера критического зародыша. Кроме того, островковая структура будет сохраняться до бóльших средних толщин, чем те, которые соответствуют низким температурам.
Увеличение скорости осаждения приводит к увеличению скорости зародышеобразования и к образованию более мелких островков. Непрерывная пленка образуется при меньших толщинах. Зависимость слабая и эффект заметен только при изменении скорости на несколько порядков.
Лекция 4
Коалесценция островков
На рис. 2.6 показана коалесценция двух круглых островков.
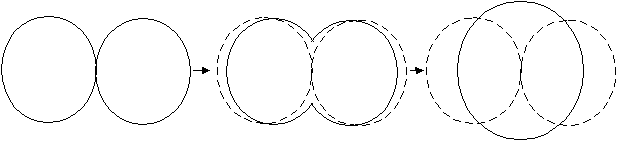
Рис. 2.6. Схема изменения формы островков в процессе их коалесценции.
Коалесценция длиться менее 0,1 с для малых зародышей и характеризуется уменьшением полной площади проекции зародышей на подложку и увеличением их по высоте. Зародыши с четко выраженными кристаллографическими формами в процессе срастания округляются. Получившийся островок снова принимает кристаллографическую форму, если он достаточно долгое время не взаимодействует с соседними островками. На стадии зародышеобразования кристаллики, в основном, имеют форму треугольника, после коалесценции приобретают форму шестиугольника, но часто с дефектами.
Процесс коалесценции приводит к увеличению свободной поверхности подложки, и к образованию вторичных зародышей между островками. Этот эффект становиться заметным, когда первичные островки вырастают до размеров 1000 Å, и продолжается до тех пор пока не образуется пленка без дырок.
Основным механизмом переноса массы при коалесценции является поверхностная диффузия, второстепенным – объемная. Образование шеек при коалесценции происходит за короткое время около 0,06 с.
Движущей силой коалесценции является уменьшение поверхностной энергии. После того, как при коалесценции произошло основное уменьшение поверхностной энергии, дополнительное ее уменьшение происходит за счет образования граничных плоскостей с предпочтительной кристаллографической ориентацией. Островок, образующийся в ходе слияния, продолжает менять свою форму в течение довольно длительного времени (рис.2.7).
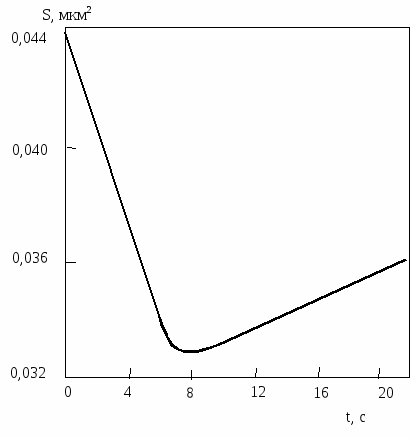
Рис.2.7. Изменение площади составного островка Au во время
коалесценции и после нее на подложке MoS2 при 400 С.
Лекция 5
Критические температуры
На процесс повторного испарения очевидно определяющим образом влияет температура подложки, если нет других энергетических воздействий на поверхность. В эксперименте соответствующую температуру при которой начинает наблюдаться конденсат называют критической Т0. При Т Т0 среднее время жизни адсорбированного атома настолько велико, что все атомы попадающие на подложку, захватываются устойчивыми зародышами и конденсация с самого начала является полной, т.е. коэффициент прилипания s = 1 даже при времени наблюдения близком к нулю. Поэтому, зависимость массы конденсата от времени с момента начала процесса нанесения пленки будет линейной (рис. 2.4). В эксперименте выявление этой линейности разумеется в сильной степени зависит от чувствительности приборов, используемых для измерения сконденсированного вещества. При Т Т0 в начальный период времени конденсация является неполной, т.е. s 1 и по мере накопления на поверхности зародышей с размером больше критического, усиливается захват атомов и присоединение их к растущим зародышам и конденсация становится полной и рассматриваемые зависимости выходят на линейный участок (рис. 2.4).
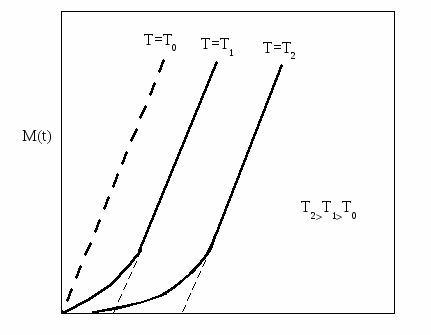
t
Рис. 2.4. Зависимость массы сконденсировавшегося вещества
от времени при разных температурах подложки.
При увеличении температуры подложки степень пересыщения понижается, среднее время жизни адсорбированного атома уменьшается, а коэффициент поверхностной диффузии адатомов увеличивается. Рассмотрение этих эффектов в теориях позволяет определить следующие критические температуры:
- «критическая температура конденсации», выше которой невозможно наблюдать появление осадка, т.к. s 1, ta мало и площадь поверхности, покрытая зародышами и связанными с ними зонами захвата мала; при температуре выше критической конденсацию наблюдать невозможно, при температуре ниже критической она происходит быстро; с критической температурой конденсации связана температура Т0, выше которой конденсация в начальный период времени неполная, а ниже – полная с самого начала;
- температуры «переходов», соответствующие изменению размера критического зародыша, температуры «переходов» можно наблюдать только размер критического зародыша мал и добавление еще одного атома существенно меняет размер зародыша и следовательно его устойчивость;
- температура «эпитаксии», выше которой наблюдается эпитаксиальный рост осадка на монокристаллической подложке; температура «эпитаксии» в сильной степени зависит от скорости осаждения и состояния поверхности подложки.
Лекция 6
Этапы формирования пленки
страница 1 страница 2 ... страница 4 | страница 5
|