страница 1 страница 2 страница 3
Иммунологические проявления воспалительного процесса при ОРЛ разнообразны и отражают форму, вариант течения и степень активности процесса. В то же время среди них можно выделить общие черты:
-
наличие клинических проявлений кардита со снижением сократительной функции миокарда при выявлении высокого титра антител к стрептолизинам и ряду протеиназ;
-
у 30–60 % больных ОРЛ выявляется высокий уровень ЦИК, которые могут фиксироваться в сосудах сердца и его интерстиции и ведут к развитию иммунокомплексного кардиального васкулита. ЦИК состоят из стрептококковых антигенов (чаще стрептолизин-О) и антител к нему. При этом установлена взаимосвязь уровня ЦИК с наличием ЭКГ-изменений (атриовентрикулярные диссоциации и блокады);
-
наличие циркулирующего сердечного антигена и антикардиальных антител;
-
повышение уровня IgG, IgA и IgM на высоте активности процесса;
-
увеличение концентрации IL-1α и IL-1β, растворимого рецептора TNF и неоптерина, отражающих активацию моноцитов/макрофагов;
-
повышение уровня растворимого рецептора IL-2, характеризующего активацию Т-лимфоцитов;
-
уровень комплемента обычно в пределах нормы;
-
абсолютное и относительное увеличение В-лимфоцитов;
-
уменьшение общего количества и снижение функциональной активности Т-лимфоцитов, главным образом клона CD8+12+;
-
от степени антигенной активности стрептококка, а также от глубины «дефектов» наследственно обусловленных признаков стрептоаллергического диатеза зависит клинико-морфологический полиморфизм ревматизма: это может быть ОРЛ, имеющая обратное развитие процесса в сердце, либо формируются пороки сердца уже после первой атаки;
-
в реакции на БГСГА организм приобретает продолжительный иммунитет, специфичный виду вызвавшего заболевание БГСГА (в зависимости от типа М-протеина), при этом не возникает перекрестного иммунитета с другими видами БГСГА.
ПАТОМОРФОЛОГИЯ
Различают 4 стадии развития патологического процесса в соединительной ткани при ОРЛ:
-
Мукоидное набухание: накопление гидрофильных гликозаминогликанов (главным образом, гиалуроновой кислоты), гидратация и набухание основного вещества соединительной ткани и коллагеновых волокон.
-
Фибриноидное набухание: острая фаза иммунного асептического воспаления, проявляется диффузным отеком коллагеновых волокон соединительной ткани эндокарда, миокарда и перикарда, синовиальной оболочки суставов, реже — легких, плевры, брюшины, почек, нервной системы с экссудацией богатой фибрином плазмы и клеточных элементов воспаления, главным образом, лимфоцитов, и последующим развитием фибриноидного некроза. В зависимости от локализации патологического процесса проявляется определенная клиническая картина заболевания.
-
Пролиферативные реакции (гранулематозное воспаление). Через 2–3 недели фазу экссудации сменяет фаза пролиферации, сопровождающаяся выраженной клеточной реакцией и образованием специфических гранулем Ашоффа-Талалаева (состоят из крупных базофильных клеток неправильной формы гистиоцитарного происхождения, гигантских многоядерных клеток миогенного происхождения с эозинофильной цитоплазмой, лимфоидных и плазматических клеток, макрофагов, тучных клеток, фиксированных иммунных комплексов). Гранулемы имеют нозологическую специфику — возникают только в сердце, чаще располагаются в периваскулярной соединительной ткани или в интерстиции миокарда вокруг мелких венечных артерий (преимущественно левого желудочка), реже — на сосочковых мышцах, в эндокарде, в наружной оболочке сосудов, на сухожильных хордах, на створках клапанов и в местах их соприкосновения.
Цикл развития гранулемы составляет в среднем 6–12 месяцев, что соответствует времени формирования РПС и миокардиосклероза. Наличие гранулем свидетельствует об активности ревматического процесса, они более отчетливо выявляются в детском возрасте, что указывает на большую, по сравнению со взрослыми, остроту процесса, выраженность кардита и других проявлений ОРЛ у этой категории больных.
Гранулемы могут годами сохраняться в миокарде и не сопровождаться изменением клинико-лабораторных показателей, подтверждающими активность процесса.
-
Склероз. Постепенное замещение гранулемы фиброзной тканью с формированием рубца. Происходит утолщение, деформация и сращение створок клапанов, что приводит к развитию недостаточности и (или) стенозу клапанного отверстия. Ревматический эндокардит вызывает бородавчатые изменения клапанов.
Важно выявить заболевание на самых ранних стадиях: при своевременном лечении стадия мукоидного набухания, как правило, обратима. Гранулематозная и склеротическая стадии представляют необратимую фазу дезорганизации соединительной ткани.
Важным морфологическим субстратом поражения сердца при ревмокардите является неспецифическая воспалительная реакция. Она складывается из отека межмышечной соединительной ткани, выпотевания фибрина, инфильтрации клеточными элементами (преимущественно полиморфно-ядерными лейкоцитами и лимфоцитами).
Неспецифический экссудативно-пролиферативный компонент воспаления определяет клинические проявления заболевания и прямо пропорционально коррелирует с активностью патологического процесса и выраженностью кардита.
Излюбленная локализация ревматического процесса — митральный клапан, реже — аортальный и трехстворчатый. Исходом вышеописанных процессов является кардиосклероз. Иногда отмечается формирование серозно-фибринозного выпотного перикардита с возможной кальцификацией перикардиальной сумки, однако констриктивный перикардит для ревматического процесса нехарактерен.
К числу неспецифических, но важных для патогенеза и морфогенеза ревматического процесса относят изменения сосудов микроциркуляторного русла во всех органах и тканях — васкулит.
Вовлечение в патологический процесс серозных оболочек обусловливает картину серозного, серозно-фиброзного воспаления.
В суставных тканях при клинически выраженном ревматическом полиартрите наблюдаются проявления дезорганизации соединительной ткани, экссудативное воспаление, васкулит. Особенностью ревматического поражения суставов является обратимость процесса не только в фазе мукоидного набухания, но и в начальных стадиях фибриноидных изменений.
В основе поражения нервной системы лежит вовлечение в ревматический процесс сосудов мозга. Патологический субстрат малой хореи — изменение клеток полосатого тела, субталамических ядер коры большого мозга и мозжечка.
Поражение кожи и подкожной клетчатки проявляется признаками васкулита, эндотелиоза и очаговой воспалительной инфильтрации.
Таким образом, основу ревматического процесса составляет сложный по своей структуре процесс, при котором на фоне нарушенной реактивности организма развиваются различные по интенсивности воспалительные и пролиферативные изменения, обусловливающие многообразие клинических проявлений болезни.
КЛАССИФИКАЦИЯ
Термин «ревматизм», который ранее традиционно относился к отрасли медицины «ревматология», в настоящее время вышел из употребления. Термин «острая ревматическая лихорадка» наиболее оправдан, поскольку привлекает внимание врача к выяснению роли БГСА-инфекции, а также указывает на необходимость назначения антибиотиков для эрадикации возбудителя в остром периоде (первичная профилактика) и предотвращения повторных атак (вторичная профилактика).
Согласно международной классификации болезней десятого пересмотра (ВОЗ, Женева, 1995), ОРЛ и ХРБС относятся к IX классу —«болезни системы кровообращения», представлены в рубриках I00–I02 и I05–I09 как самостоятельные группы болезней и выделены в качестве самостоятельных нозологических форм. Это представляется оправданным с точки зрения тактики лечения больных ОРЛ и ХРБС и для обоснования проведения первичной и вторичной профилактики.
В 2003 году в Беларуси принята новая классификация ОРЛ (таблица 2).
Таблица 2 –– Рабочая классификация ОРЛ, 2003 год
Клини-ческие
формы
|
Клинические проявления
|
Исход
|
Недостаточность
кровообращения
|
основные
|
дополнительные
|
cтадия*
|
ФК
NYHA
|
ОРЛ
ПРЛ
| -
кардит;
-
артрит;
-
хорея;
-
подкожные ревматические узелки;
-
кольцевидная эритема
| -
лихорадка;
-
артралгия;
-
серозиты;
-
абдоминальный синдром
|
— без порока сердца**;
— с пороком сердца***.
|
0
I
IIA
IIB
III
|
0
1
2
3
4
|
Примечание: ПРЛ –– повторная ревматическая лихорадка; * по классификации Н. Д. Стражеско и В. Х. Василенко; ** возможно наличие поствоспалительного краевого фиброза створок клапанов без регургитации или с минимальной регургитацией (данные ЭХО-КГ); *** при наличии впервые выявленного порока исключить другие причины его формирования: инфекционный эндокардит, первичный АФЛС, кальциноз (данные ЭХО-КГ) и др., уточнить поражение оболочек сердца (эндо-, мио-, перикарда).
В представленной классификации выделяется 2 варианта исходов заболевания.
При выздоровлении речь идет о полном обратном развитии клинической симптоматики ОРЛ с нормализацией лабораторных показателей и отсутствием каких-либо остаточных изменений.
Хроническая сердечная недостаточность (ХСН) оценивается в соответствии с классификациями Стражеско-Василенко (стадия) и Нью-Йоркской ассоциации кардиологов (NYHA) (функциональный класс — ФК) (таблица 3).
Таблица 3 –– Классификация ХСН, принята съездом ВНОК от 11.10.2002
Стадии ХСН по Стражеско-
Василенко (могут ухудшаться,
несмотря на лечение)
|
ФК ХСН по NYHA (могут изменяться
на фоне лечения как в одну,
так и другую сторону)
|
I
|
Начальная стадия заболевания (поражения) сердца. Гемодинамика не нарушена. Скрытая сердечная недостаточность. Бессимптомная дисфункция ЛЖ
|
1 ФК
|
Ограничения физической активности отсутствуют: привычная физическая активность не сопровождается быстрой утомляемостью, появлением одышки или сердцебиения. Повышенную нагрузку больной переносит, но она может сопровождаться одышкой и (или) замедленным восстановлением сил
|
II А
|
Клинически выраженная стадия заболевания (поражения) сердца. Нарушения гемодинамики в одном из кругов кровообращения, выраженные умеренно. Адаптивное ремоделирование сердца и сосудов
|
2 ФК
|
Незначительное ограничение физической активности: в покое симптомы отсутствуют, привычная физическая активность сопровождается утомляемостью, одышкой или сердцебиением
|
II Б
|
Тяжелая стадия заболевания (поражения) сердца. Выраженные изменения гемодинамики в обоих кругах кровообращения. Дезадаптивное ремоделирование сердца и сосудов
|
3 ФК
|
Заметное ограничение физической активности: в покое симптомы отсутствуют, физическая активность меньшей интенсивности по сравнению с привычными нагрузками сопровождается появлением симптомов
|
III
|
Конечная стадия поражения сердца. Выраженные изменения гемодинамики и тяжелые (необратимые) структурные изменения органов-мишеней (сердца, легких, сосудов, головного мозга, почек). Финальная стадия ремоделирования органов
|
4 ФК
|
Невозможность выполнить какую-либо физическую нагрузку без появления дискомфорта; симптомы сердечной недостаточности присутствуют в покое и усиливаются при минимальной физической нагрузке
|
Клинические проявления зависят от активности ревматического процесса. Степень активности воспалительного процесса позволяет прогнозировать длительность течения активной фазы болезни и оценивать продолжительность и эффективность лечения.
I (минимальная) степень активности: клинические симптомы ревматического процесса выражены слабо; нередко полностью отсутствуют признаки экссудативного компонента воспаления в органах и тканях; характерен преимущественно моносиндромный характер воспалительных поражений.
Клинические проявления соответствуют вариантам течения:
-
без вовлечения в процесс сердца, но с проявлениями малой хореи;
-
изолированный миокардит;
-
затяжной непрерывно рецидивирующий латентный ревмокардит.
Рентгенологические и ультразвуковые проявления разнообразны и зависят от клинико-анатомической характеристики процесса.
ЭКГ признаки поражения миокарда (при наличии миокардита) мало информативны: снижение вольтажа зубцов ЭКГ, увеличение электрической активности миокарда левого желудочка, возможны атриовентрикулярная блокада I степени и экстрасистолия.
Показатели крови на верхней границе нормы, важна их динамика: СОЭ до 20–30 мм/ч, лейкоцитоз с нейтрофильным сдвигом формулы крови, γ-глобулины > 20 %, С-реактивный белок 1–2 плюса, серомукоиды выше 0,21 ед.
Серологические тесты на верхней границе нормы: АСЛ-О > 200 ЕД.
II (умеренная) степень активности: умеренные клинические проявления болезни с умеренной лихорадкой или без нее; отсутствует выраженный экссудативный компонент воспаления в пораженных органах с тенденцией к множественному их вовлечению в воспалительный процесс; признаки кардита выражены умеренно или слабо.
Клинические проявления:
-
поражение миокарда и эндокарда (эндомиокардит) — подострый ревмокардит в сочетании с недостаточностью кровообращения I–II А ст.;
-
подострый или непрерывно-рецидивирующий ревмокардит в сочетании с подострым полиартритом, фиброзным плевритом, нефропатией, ревматический хореей, подкожными ревматическими узелками, «аннулярной эритемой».
Рентгенологические и ультразвуковые проявления: расширение тени сердца в поперечнике при ХСН, плевроперикардиальные спайки, снижение сократительной функции миокарда левого желудочка.
ЭКГ признаки миокардита: те же, что и при I степени активности. Может быть преходящее удлинение интервала QТ, нарушения ритма и проводимости, признаки коронарита.
Показатели крови: лейкоцитоз с нейтрофильным сдвигом формулы крови; СОЭ 20–40 мм/ч; С-реактивный белок 1–3 плюса; α2-глобулины 11–16 %; γ-глобулины 21–25 %; серомукоиды 0,3–0,6 ед.
Серологические тесты: АСЛ-О > 400 ЕД.
III (максимальная) степень активности: выраженный компонент экссудативного воспаления в пораженных органах и системах (острый полиартрит, диффузный миокардит, панкардит, серозиты и др.), яркая клиническая картина, выраженный лихорадочный синдром.
Клинические проявления:
-
острый и подострый диффузный эндомиокардит в сочетании с сердечной недостаточностью II Б ст.;
-
панкардит в сочетании с сердечной недостаточностью II А и II Б ст.;
-
ревматический процесс с поражением сердца (2-х или 3-х оболочек) и малой хореей;
-
подострый и хронический ревмокардит в сочетании с полиатритом, плевритом, пневмонией, нефритом, гепатитом, аннулярной эритемой.
Рентгенологические и ультразвуковые проявления: увеличение размеров сердца и снижение сократительной функции миокарда; возможны плевроперикардиальные изменения.
ЭКГ признаки: те же, что и при II степени активности. Могут присоединиться фибрилляция предсердий, политопные экстрасистолы.
Показатели крови: лейкоцитоз, часто с нейтрофильным сдвигом формулы; СОЭ более 40 мм/ч; С-реактивный белок 3–4 плюса; фибриноген 10 г/л и выше; уровень α2-глобулинов > 15 %, γ-глобулинов 23–25 % и выше; серомукоиды > 0,6 ед.
Серологические тесты: титры АСЛ-О, антистрептогиалуронидазы, антистрептокиназы выше допустимых цифр в 3–5 раз.
КЛИНИКА И ДИАГНОСТИКА ОРЛ
За последние 25–30 лет клиническая картина ОРЛ претерпела существенные изменения. Отмечаются редкость тяжелого течения ревматического кардита, уменьшение в несколько раз повторных атак болезни, тенденция к переходу заболевания в моносиндромные формы, учащение малосимптомных и латентных вариантов течения и т. д. В связи с этим в современных условиях значительно возрастает роль врача в правильном и своевременном распознавании ОРЛ.
В настоящее время в соответствии с рекомендациями ВОЗ для постановки диагноза ОРЛ применяются международные диагностические критерии А. А. Киселя (1940) и Т. Д. Джонса (1944), пересмотренные Американской кардиологической ассоциацией в 1992 году и модифицированные Ассоциацией ревматологов России в 2003 году (таблица 4). Ни один из представленных критериев не является строго специфичным для ОРЛ (за исключением кольцевидной эритемы и ревматических узелков, развивающихся крайне редко), что требует определенной врачебной квалификации для правильного распознавания и интерпретации выявляемой симптоматики.
Таблица 4 –– Международные критерии диагностики ОРЛ
Большие критерии
|
Малые критерии
|
Данные, подтверждающие
предшествовавшую БГСА-инфекцию
| -
кардит;
-
полиартрит;
-
хорея;
-
кольцевидная эритема;
-
подкожные
ревматические узелки.
|
Клинические:
Лабораторные:
повышение острофазовых реактантов: СОЭ, СРБ.
Инструментальные:
-
удлинение интервала Р-Q (P-R) на ЭКГ;
-
признаки митральной и (или) аортальной регургитации на Эхо-КГ.
| -
позитивная культура БГСА, выделенная из зева, или положительный тест быстрого определения БГСА-антигена;
-
повышенные или повышающиеся титры противострептококковых антител (АСЛ-О > 250).
|
Наличие 2 больших критериев или 1 большого и 2 малых в сочетании с данными, документировано подтверждающими предшествующую БГСА-инфекцию, свидетельствует о высокой вероятности ОРЛ.
|
Выделяют особые случаи ОРЛ, когда диагноз ОРЛ можно поставить без строгого следования критериям Джонса:
-
Изолированная «чистая» хорея, развивающаяся спустя много месяцев после перенесенного стрептококкового фарингита (серологических признаков предшествующей инфекции уже нет) при отсутствии других причин, в том числе синдром PANDAS.
-
«Поздний» вялотекущий кардит –– растянутое во времени (> 2 мес.) развитие клинических и инструментальных признаков вальвулита (при исключении других причин).
-
ПРЛ на фоне ХРБС (или без нее).
Примеры формулировки клинического диагноза, в соответствии с рубрикацией МКБ-10:
-
ОРЛ: кардит (митральный вальвулит), мигрирующий полиартрит, III степень активности, НК I (ФК I) –– I01.1;
-
ОРЛ: хорея, I степень активности, НК 0 (ФК 0) –– I02.9;
-
ПРЛ: кардит, II степень активности. Сочетанный митральный порок сердца с преобладанием стеноза. НК IIА (ФК II) –– I01.9;
-
ХРБС: поствоспалительный краевой фиброз створок митрального клапана. НК 0 (ФК 0) –– I05.9;
-
ХРБС: комбинированный митрально-аортальный порок сердца (митральный порок с преобладанием недостаточности, аортальная недостаточность). НК II Б (ФК III) –– I08.0.
Важным моментом при постановке диагноза ОРЛ является наличие стрептоаллергического диатеза в анамнезе. Л. М. Беляевой и соавторами разработаны диагностические критерии:
1) возраст старше 5 лет;
2) наличие хронического тонзиллита или других очагов хронической инфекции;
3) выделение из зева β-гемолитического стрептококка группы А;
4) повышение титра АСЛ-О (выше 125 ЕД);
5) наличие других очагов стрептококковой инфекции (стрептодермия, рожистое воспаление, фурункулез и др.);
6) длительный субфебрилитет;
7) отягощение наследственности по хроническому тонзиллиту и ревматизму;
8) наличие HLA-антигенов В7, В35, Сw4.
О стрептоаллергическом диатезе можно говорить при наличии трех и более диагностических критериев. Детей со стрептоаллергическим диатезом относят к группе риска по развитию ОРЛ. Своевременное и адекватное лечение СД может предотвратить развитие ревматического процесса.
Варианты дебюта ОРЛ
ОРЛ в большинстве случаев развивается через 1,5–3 недели после перенесенной БГСА-инфекции ротоглотки. Начало характеризуется появлением тех или иных общих неспецифических жалоб (потливость, лихорадка, слабость и др.). Острота дебюта ОРЛ зависит от возраста больных.
-
Дети дошкольного и младшего школьного возраста: более чем в 50 % случаев после перенесенной БГСА носоглоточной инфекции через 2–3 недели внезапно повышается температура тела до фебрильной, появляются симметричные мигрирующие боли в крупных суставах (чаще коленных) и признаки кардита, обычно преобладает умеренная и минимальная степень активности воспалительного процесса. У ¼ заболевших наблюдается моносиндромное течение с преобладанием признаков артрита или кардита, реже — хореи.
-
У детей среднего школьного возраста, а также у солдатов-новобранцев ОРЛ развивается так же остро.
-
Подростки и молодые люди: после стихания клинических симптомов ангины характерно более постепенное начало ОРЛ (субфебрильная температура, боли в крупных суставах или только умеренные признаки кардита).
Ревмокардит — наиболее частый синдром ОРЛ (90–95%), определяет тяжесть течения и исход заболевания. Клиническая симптоматика кардита определяется преимущественным поражением той или иной структуры сердца — эндокарда, миокарда или перикарда. Из-за сложности разграничения на практике этих патологических состояний используют обобщенный термин «ревмокардит».
Основополагающий компонент ревмокардита — клапанный эндокардит или краевой вальвулит (основной критерий ревмокардита!) преимущественно митрального (рисунок 1), реже аортального клапана (МК, АоК), проявляющийся органическим шумом клапанной недостаточности, в сочетании с миокардитом и (или) перикардитом. В отсутствии вальвулита ревматическая природа миокардита и перикардита сомнительна.
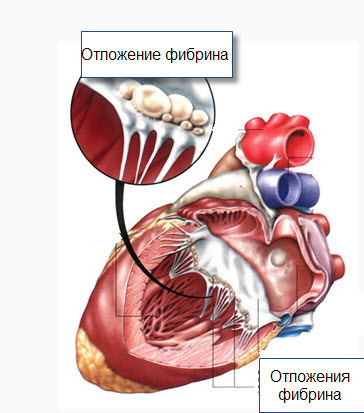 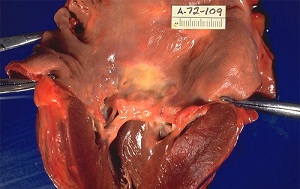
Рисунок 1 –– Ревмокардит митрального клапана
(Робин А. Кук «Цветной атлас патологической анатомии», 2005)
Клинические симптомы ревматического вальвулита:
-
Связанный с I тоном голосистолический шум митральной регургитации («дующий», с хордальным «писком»), оптимально выслушивается над верхушкой сердца, проводится в левую подмышечную область, не меняется при перемене положения тела и фазы дыхания. Данный шум необходимо дифференцировать от мезосистолического щелчка и (или) позднего систолического шума (при пролапсе митрального клапана (ПМК)), который усиливается во время выполнения пробы Вальсальвы и ослабевает при сидении на корточках. Функциональные систолические шумы отличатся от органических отсутствием связи с I тоном, меньшей длительностью и более мягким тембром; непостоянны и меняются по характеру в зависимости от положения тела и фазы дыхания.
-
Непостоянный низкоамплитудный, следующий за III тоном (или заглушающий его) мезодиастолический шум Кумбса, лучше выслушивается над верхушкой сердца в положении лежа на левом боку при задержке дыхания на выдохе (дифференцировать от низкочастотного нарастающего громкого пресистолического шума на верхушке с последующим усиленным I тоном, свидетельствующими об уже сформировавшемся митральном стенозе, а не об остром кардите).
-
Высокочастотный мягкий, убывающий «льющийся» протодиастолический шум аортальной регургитации, выслушивается сразу после II тона по левому краю грудины в V точке Боткина после глубокого выдоха при наклоне больного вперед (дифференцировать с шумом при врожденном пороке двухстворчатого аортального клапана). Аортальный порок, как правило, формируется после повторных ревматических атак на фоне сформированного митрального порока, отсутствие которого ставит под вопрос ревматический генез поражения АоК.
Поражение МК и АоК обнаруживается аускультативно только у 2/3 пациентов, что повышает диагностическую значимость ЭхоКГ-исследования с использованием доплеровской методики, позволяющего оценить анатомическую структуру сердца и состояние внутрисердечной гемодинамики. Благодаря высокой чувствительности данного метода возможно распознавание афоничной, т. е. без аускультативных симптомов, клапанной регургитации.
Разработаны диагностические допплерэхокардиографические (ДЭхоКГ) критерии ревматического эндокардита, позволяющие на ранних этапах достоверно диагностировать ревматический вальвулит, развивающийся при первичном ревмокардите.
ДЭхоКГ-признаки ревматического вальвулита МК:
-
краевое утолщение, рыхлость («лохматость») створок и хорд МК;
-
ограничение подвижности утолщенной задней створки МК;
-
уменьшение систолической экскурсии сомкнутых митральных створок, иногда небольшой концевой пролапс (2–4 мм) передней или задней створки МК в конце систолы;
-
митральная регургитация (степень зависит от тяжести поражения);
-
куполообразный изгиб передней митральной створки.
ДЭхоКГ-признаки признаки ревматического вальвулита АоК:
-
краевое утолщение, рыхлость аортальных створок, что хорошо видно в диастолу из парастернальной позиции в поперечном сечении;
-
чаще выражено утолщение правой коронарной створки;
-
преходящий пролапс створок АоК;
-
аортальная регургитация (направление струи к передней митральной створке);
-
высокочастотное трепетание (флаттер) передней митральной створки вследствие аортальной регургитации.
ДЭхоКГ-феномены клапанной регургитации должны быть подтверждены при повторном исследовании через 10–14 дней!
При дифференциальном диагнозе минимальных клапанных регургитаций у лиц со структурно нормальным сердцем необходимо использовать не гемодинамические характеристики регургитации, а тщательно оцениваемые данные состояния створок МК с использованием количественных показателей — индекса толщины и протяженности утолщения передней митральной створки.
Миокардит и перикардит на фоне вальвулита встречаются с различной частотой и степенью выраженности. Миокардит характеризуется одышкой, тахикардией, глухостью сердечных тонов, систолическим шумом в области верхушки сердца, появлением III тона (ритм галопа), возможно развитие застойных явлений в легких (сердечная астма и отек легких) и большом круге кровообращения (увеличение печени, асцит и отеки на ногах); на ЭКГ определяются нарушения ритма и проводимости (удлинение PQ), нарушения процессов реполяризации (депрессия сегмента SТ, снижение амплитуды зубца Т, особенно в грудных отведениях); при УЗИ сердца может определяться увеличение полости левого желудочка и умеренное снижение его сократительной способности. Симптомы перикардита: нестойкий шум трения перикарда, увеличение границ сердца, нарастание тяжести состояния с формированием недостаточности кровообращения (НК), развитие плеврита и абдоминального синдрома; на ЭКГ определяется снижение вольтажа зубцов комплекса QRS, подъем сегмента SТ, деформация зубца Т, нарушения ритма и проводимости.
Важная особенность ревмокардита при первой атаке ОРЛ — четкая положительная динамика под влиянием активной противоревматической терапии: в преобладающем большинстве случаев происходит нормализация частоты сердечных сокращений, восстановление звучности тонов, уменьшение интенсивности сердечных шумов, сокращение границ сердца, исчезновение симптомов НК. Непосредственная угроза жизни больного возникает крайне редко и почти исключительно в детском возрасте в связи с диффузным поражением миокарда и развитием тяжелой НК.
Длительность ОРЛ у больных с кардитом колеблется в зависимости от тяжести заболевания от 8 до 27 недель, что больше, чем у больных без кардита (9–16 недель). При этом нормализация температуры тела и лабораторных признаков активности ОРЛ может наступить в условиях сохраняющегося воспалительного процесса в миокарде.
Осложнением ревмокардита является формирование РПС, что ухудшает качество жизни, приводит к инвалидности, сокращает продолжительность жизни и определяет социальную значимость проблемы.
Частота формирования РПС после первой атаки составляет: у детей –– 20–25 %, у подростков –– 30 %, у взрослых –– 39–45 %, причем максимальная частота возникновения РПС (> 75 %) наблюдается в течение первых 3-х лет от начала заболевания. Преобладают изолированные пороки, чаще — митральная недостаточность, реже — недостаточность АоК, митральный стеноз, комбинированный митрально-аортальный порок. Повторные атаки ревматической лихорадки усугубляют выраженность порока сердца. Важная роль в формировании клапанных пороков отводится травмирующему действию тока крови на измененные вальвулитом клапаны и повреждающему действию антифосфолипидных антител (к кардиолипину и β2-гликопротеину).
Л. М. Беляевой предложены критерии выделения группы повышенного риска формирования РПС:
1) наличие ОРЛ у родственников первой степени родства;
2) наличие синдрома дисплазии соединительной ткани сердца или малых аномалий развития сердца, выявляемых при помощи ЭхоКГ: первичный ПМК I–II степени с миксоматозными изменениями створок, открытое овальное окно, аневризмы внутрисердечных перегородок, дисфункции клапанов сердца с регургитацией I–II степени, дополнительные аномально расположенные хорды в желудочках. Часто при этом выявляются дополнительные проводящие пути, определяемые по ЭКГ (синдромы укороченного интервала РQ, WPW, преждевременного парциального возбуждения желудочков и др.);
3) наличие стрептоаллергического диатеза в анамнезе;
4) женский пол;
5) возраст больного до 10 лет;
6) развитие клапанного эндокардита (вальвулита митрального и/или аортального клапанов) на высоте атаки ОРЛ;
7) наличие определенных генетических маркеров HLA-системы (В7 и А2 — недостаточность МК; В35 — недостаточность АоК).
Пациента относят к группе риска при наличии трех и более критериев. Если ребенок отнесен к группе риска по формированию РПС, ему необходимо проводить специфическую терапию, а затем профилактику по индивидуальному плану.
Ревматический артрит является ранним, одним из ведущих клинических синдромов первой ревматической атаки. Частота его колеблется от 60 до 90 % при ОРЛ и от 50 до 67 % при ее повторных атаках.
Характерные особенности ревматического артрита:
-
острое начало;
-
нередко в начале заболеваниия протекает с выраженным болевым синдромом, припухлостью, покраснением, локальной гипертермией, нарушением функции суставов (выраженный экссудативный компонент — синовит);
-
классический мигрирующий полиартрит с преимущественным поражением крупных и средних суставов (коленных, голеностопных, плечевых, локтевых, лучезапястных) в настоящее время встречается редко. Преобладающая форма поражения в современных условиях — преходящий олигоартрит, реже — моноартрит;
-
быстрый регресс воспалительных изменений в суставах (в течение 2–3 недель), а при проведении своевременной противовоспалительной терапии — в течение нескольких часов или дней;
-
как правило, сочетается с ревмокардитом и редко (10–15 % случаев) протекает изолированно;
-
ОРЛ не вызывает стойкой деформации суставов, за исключением крайне редко формирующейся артропатии Жакку (необратимый фиброз капсул суставов) после многочисленных ПРЛ
При артроскопии выявляются серозный выпот и утолщенная эритематозная синовиальная мембрана, покрытая фибрином. Гистологически обнаруживается диффузная инфильтрация синовиальной оболочки полиморфно-ядерными клетками и лимфоцитами. На поздних стадиях в синовиальной ткани могут развиваться очаговые фибриноидные некрозы и гистиоцитарные гранулемы.
Изолированная артралгия (мигрирующая боль в крупных суставах различной интенсивности) наблюдается только в 10–15 %, в отличие от артрита не сопровождается болезненностью при пальпации и другими симптомами воспаления (это более специфично для ИЭ). По сравнению с мигрирующим полиартритом она имеет меньшую специфичность для ОРЛ и поэтому относится к малым диагностическим критериям заболевания.
Ревматическая хорея (малая хорея или хорея Сиденгама) — обусловлена вовлечением в патологический процесс различных структур мозга (полосатое тело, субталамические ядра, мозжечок). Встречается у 6–30 % детей с ОРЛ, чаще страдают девочки от 6 до 15 лет. В большинстве случаев сочетается с другими клиническими синдромами ОРЛ, но у 5–7 % больных может быть единственным признаком заболевания. Диагноз ревматической хореи правомочен после исключения других причин поражения нервной системы (хорея Геттингтона, системная красная волчанка, болезнь Вильсона, лекарственные реакции и т. д.).
Основные клинические проявления ревматической хореи наблюдаются в различных сочетаниях и с вариабельной степенью выраженности.
-
Хореические размашистые гиперкинезы — беспорядочные, насильственные движения, наиболее выраженные в мышцах дистальных отделов конечностей и мимической мускулатуре лица, что сопровождается гримасничаньем, вычурными движениями, нарушением почерка, невнятностью речи. Ребенку трудно есть, пить (он роняет кружку, не может донести ложку ко рту, не расплескав суп). Гиперкинезы чаще двусторонние, усиливаются при волнениях, исчезают во время сна. Гиперкинезы в области кисти легко выявляются, если врач держит кисть ребенка в своей руке.
-
Мышечная гипотония вплоть до дряблости мышц (при ослаблении гиперкинезов). Резкая мышечная гипотония может привести даже к ликвидации гиперкинезов и развитию «паралитической» или «мягкой» формы хореи. Характерен симптом «дряблых плеч» — при поднимании больного за подмышки голова глубоко погружается в плечи.
-
Расстройства статики и координации (пошатывание при ходьбе, неустойчивость в позе Ромберга).
-
Сосудистая дистония.
-
Психоэмоциональные нарушения.
Начало хореи, как правило, постепенное, ребенок становится плаксивым, вялым, раздражительным. Затем развивается характерная клиническая пентада признаков: начальными проявлениями могут быть быстрота и порывистость движений, затем появляются подергивания мышц лица, рук. Ребенок гримасничает, становится неловким, роняет предметы, у него нарушаются внимание, память, походка, почерк. При этом характерно полное исчезновение симптоматики во сне.
В настоящее время часто встречается атипичное течение хореи: нерезко выраженные симптомы с преобладанием вегето-сосудистой дистонии и астенизации.
При правильном режиме и лечении обратное развитие симптомов малой хореи обычно наступает через несколько недель или месяцев (в среднем через 1,5–3 месяца). Примерно у ½ больных малая хорея протекает с рецидивами, которые чаще возникают через 1–2 года, у отдельных больных наблюдаются многократные рецидивы через небольшой промежуток времени (непрерывно рецидивирующее течение).
При наличии хореи пороки сердца формируются очень редко.
Описан (Swedo et al. 1998, M. L. Murphy, 2002) новый специфический синдром PANDAS: pediatric autoimmune neuropsychiatric disorders associated with streptococcal infections — аутоиммунное нервно-психическое нарушение, acсоциированное с А-стрептококковой инфекцией. Близость этого синдрома с хореей подтверждается наличием аналогичной сопряженности с БГСГА, схожей частотой выявления аллоантигенов лимфоцитов D 8/17, эффективностью в терапии PANDAS всех подходов к профилактике и лечению ОРЛ. Патогенетически при хорее и PANDAS предполагается роль антинейрональных антител.
Клиническая характеристика синдрома PANDAS:
-
дебют в препубертатном возрасте (до 12 лет);
-
острое начало и приступообразное течение;
-
положительная ассоциативная связь с БГСГА-инфекцией носоглотки, подтвержденная микробиологически и серологически;
-
обсессивно-компульсивные расстройства (навязчивые мысли и навязчивые действия), возможно сочетание с тиками;
-
неврологические (гипермоторные и хорееформные гиперкинезы) и психоэмоциональные (импульсивность, рассеянность, лабильность эмоций, нарушения внимания, трудности засыпания, иногда — анорексия) нарушения;
-
быстрый регресс психоневрологической симптоматики при своевременной адекватной антибактериальной терапии.
В 2001 году были описаны серии случаев острого диссеминированного энцефалита (ADEM) в ассоциации со стрептококковыми инфекциями. При этом у всех пациентов были обнаружены антитела к антигенам базальных ганглиев.
Для постановки диагноза малой хореи или PANDAS диагностическое значение имеют долго сохраняющиеся антитела против ДНК-азы.
Кольцевидная эритема (Erythema marginatum) — характерный, но редкий признак ОРЛ. Встречается у 4–17 % детей на высоте атаки ОРЛ. Представляет собой бледно-розовые неяркие кольцевидные высыпания в виде тонкого кольцевидного ободка 5–10 см в диаметре (рисунок 2), с преимущественной локализацией над пораженными суставами или на туловище и проксимальных отделах конечностей, но никогда — на лице!
Высыпания имеют преходящий мигрирующий характер, не сопровождаются зудом и индурацией, не возвышаются над поверхностью кожи, бледнеют при надавливании, быстро исчезают под влиянием лечения и не оставляют после себя пигментацию, шелушение, атрофические изменения.
Рисунок 2 –– Кольцевидная эритема
(С. С. Арифов «Дерматовенерология», 2008)
Подкожные ревматические узелки в последние годы наблюдаются очень редко у детей (1–3 %) и фактически отсутствует у подростков и взрослых. Представляют собой мелкие плотные округлые (1–2 см в диаметре), малоподвижные, безболезненные образования, расположенные в периартикулярных тканях у мест прикрепления сухожилий, над костными выступами в области коленных и локтевых суставов, затылочной кости, остистых отростков позвонков в виде безболезненных «горошин».
Как правило, подкожные ревматические узелки сочетаются с тяжелым поражением сердца и являются относительно поздним признаком ОРЛ, сохраняются от нескольких дней до 1–2 месяцев.
Кожа над ревматическими узелками не изменена (рисунок 3).
Рисунок 3 –– Подкожные ревматические узелки в области локтевого сустава
(С. С. Арифов «Дерматовенерология», 2008)
Ревматический полисерозит — поражение серозных оболочек в настоящее время наблюдается при тяжелом течении первой и (или) повторной ревматической лихорадки и манифестирует явлениями перикардита, плеврита и перитонита с быстрым обратным развитием на фоне противовоспалительной терапии.
Ревматический перикардит (см. выше) может быть экссудативным и сухим. Возникает на фоне поражения других оболочек сердца (панкардит). Ревматический перикардит имеет благоприятное течение и на фоне противоревматической терапии экссудат быстро рассасывается. Исходом ревматического перикардита могут быть небольшие спайки между листками перикарда, однако полного их сращения, развития слипчивого перикардита, «панцирного сердца» не возникает, что отличает ревматический перикардит от бактериального (коккового) и туберкулезного.
При отсутствии вальвулита ревматическую природу перикардита следует трактовать с большой осторожностью.
Ревматический плеврит чаще бывает двусторонним и характеризуется быстрым обратным развитием на фоне противоревматической терапии. Он является одним из наиболее частых проявлений ревматического полисерозита и обычно сочетается с другими проявлениями ОРЛ.
Ревматический перитонит (абдоминальный синдром) встречается редко, обычно в детском возрасте, при остром течении ревматизма. Отличительная черта — разлитой характер болей в животе, которые носят мигрирующий характер. Как правило, абдоминальный синдром сочетается с другими признаками ОРЛ.
Поражение легких проявляется в виде ревматической пневмонии или легочного васкулита. Развивается главным образом у детей на фоне панкардита при остром течении заболевания. Отличительными признаками ревматических поражений легких являются их резистентность к антибактериальной терапии и хороший эффект от противоревматических средств.
Поражение почек встречается достаточно часто, однако крайне редко является клинически ведущим синдромом заболевания. Обычно развивается преходящий нефрит, проявляющийся незначительной протеинурией и гематурией. Развитие хронического гломерулонефрита или нефротического синдрома у больных ОРЛ встречается крайне редко.
Для постановки диагноза ОРЛ обязательно подтверждение предшествующей носоглоточной БГСА-инфекции путем выделения возбудителя, определения БГСА-антигена, выявления противострептококковых антител.
Положительные результаты микробиологического исследования удается получить в ранние сроки заболевания лишь в 25 % случаев. Однако отрицательные результаты не позволяют исключить активную стрептококковую инфекцию, так как могут быть обусловлены применением антибактериальной терапии, несоблюдением правил техники забора исследуемого образца. В то же время положительные результаты микробиологических исследований не позволяют отличить активную инфекцию от бактерионосительства. Использование экспресс-тестов для определения БГСА-антигена, несмотря на высокую специфичность (95–100 %), характеризуются сравнительно низкой чувствительностью (60–80 %).
В диагностике ОРЛ более информативны серологические исследования, позволяющие выявить повышенные или повышающиеся в динамике титры специфических антител. Обычно титры антител к БГСА при ОРЛ начинают повышаться к концу 2 недели после перенесенного тонзиллита (фарингита), достигают максимума к 4–5 неделе (период начальных проявлений ОРЛ) и сохраняются на этом уровне в течение 2–3 месяцев с последующим снижением до исходных значений. Чаще определяют титры АСЛ-О, реже — антиДНКазы-В, антистрептогиалуронидазы, антистрептокиназы. Согласно рекомендациям ВОЗ верхняя граница нормы для противострептококковых антител не должна превышать 20 % над популяционными данными, полученными от здоровых лиц определенной возрастной группы, проживающих в конкретном регионе с учетом времени года. Повышение титра АСЛ-О наблюдается в 80 % случаев ОРЛ. При одновременном определении нескольких типов специфических антител чувствительность выявления имевшей место стрептококковой инфекции достигает 95–97 %.
При отсутствии серологического ответа в сочетании с негативными микробиологическими результатами диагноз ОРЛ маловероятен. Однако необходимо учитывать, что уровень противострептококковых антител может быть ниже диагностически значимых цифр если к моменту исследования прошло более 2 месяцев от начала ОРЛ. Часто это наблюдается у больных с изолированной ревматической хореей и у пациентов с вялотекущим ревмокардитом в качестве единственного «большого» критерия. Стрептококковые антитела не строго группоспецифичны, они могут также индуцироваться и другими группами стрептококков. Так, повышение уровня противострептококковых антител может наблюдаться после глоточных инфекций, вызванных стрептококками групп С или G, не имеющими отношения к ОРЛ.
страница 1 страница 2 страница 3
|