страница 1 страница 2 страница 3
Заболевания щитовидной железы – привилегия современного человечества или они встречались и ранее?
Ответ на этот вопрос короткий. Сколько существует человек, столько он болеет заболеваниями щитовидной железы. Знаменитые мыслители, ученые, врачи Древнего Китая, Египта, Индии, Греции и Рима , жившие до нашей эры описывали опухоли шеи, знали о последствиях этих болезней и пробовали их лечить. Известен древний рисунок на котором изображен больной с громадным зобом, держащий в руках признак слабоумия- погремушку. Еще в Древнем Китае использовали морские водоросли, золу морских губок, растворенную в вине, щитовидную железу животных для лечения подобных хворей.
Интересно, что эти проблемы волновали не только медиков. Так Наполеон, выбирая солдат для своей армии, осматривал у претендентов шею, особенно у тех, кто вырос в горных местностях, где часто встречаются зобные больные. [1]
Сам йод как элемент был открыт в 1811 году фармацевтом Куртуа, который и назвал его <йодом>, от греческого слова <фиолетовый>. А в 1854 году француз Шатен обнаружил прямую зависимость между заболеваниями щитовидной железы и количеством йода в воздухе, пище и воде. Сама же щитовидная железа описана в 18 веке швейцарским врачом Галлером как орган не имеющий протока и секретирующий в кровь специальную жидкость. В 1896 году Бауман обнаружил поразительно большое количество йода в ткани щитовидной железы и установил, что этот специфический микроэлемент концентрируется в этом органе. [26]
Первые сведения об эндемическом зобе (то есть заболевании связанном с нехваткой йода в конкретной местности) в России получил Н. Ф. Лежнев в 1904 году. Он указал на большую значимость для значительных контингентов населения России этой проблемы. А в 1921 году впервые было научно обосновано применение йода для профилактики эндемического зоба.
В двадцатые годы 20 века была доказана связь между дефицитом йода и задержкой умственного развития в ходе эксперимента, проведенного в одной из школ Мичигана (США). Было установлено, что успеваемость детей, получавших небольшую дозу йода резко улучшалась. В конечном итоге это вызвало компанию широкомасштабного йодирования населения в США, Швейцарии и других странах, что ликвидировало в них йоддефицитные заболевания. [27]
Далее было установлено, что недостаток йода в рационе беременной женщины в первые 3 месяца беременности приводит к нарушению развития мозга у плода со снижением его функций и уменьшением количества нейронов с их укорочением, что в конечном итоге приводит к слабоумию. Коэффициент умственного развития таких детей на 10-15% ниже нормы в зависимости от степени дефицита йода. У ребенка так же страдают слух, зрительная память, речь.
В 1927 году была расшифрована химическая структура гормона <тироксин> и осуществлен его синтез (Харрингтон и Бергер). В конечном итоге все выше указанные достижения позволили решить сложнейшие проблемы профилактики и лечения больных с заболеваниями щитовидной железы. [4]
-
Йодная профилактика
Осложнение возможно только при сочетании 2 факторов: колоссального избытка йода (при поступлении его не в микро-, а в миллиграммах, т.е. в тысячи раз больше нормы) + очень длительное проживание до этого в условиях йодной недостаточности (то есть чаще всего – у пожилых людей). Для детей, получающих йод в профилактических дозах, никакой опасности нет – это подтверждает длительный (почти вековой) и успешный опыт эффективной йодной профилактики на всей нашей планете. Это подтверждается и огромным опытом работы российских врачей с препаратом ЙОДОМАРИН (100/200 микрограммов в таблетке). [6]
В домашнем хозяйстве важно перейти на закупку только йодированной соли. В периоды, когда потребность в йоде возрастает (у детей при поступлении в школу и, особенно, в старших классах) плюс к этому важно применять хорошо проверенные и известные йодсодержащие препараты. Дошкольникам и учащимся младших классов вполне достаточно утром принимать по 1 таблетке ЙОДОМАРИН 100 в день, школьникам средних классов (с 12 лет) и старшеклассникам – ЙОДОМАРИН 200. Лучше, если этот процесс в каждой семье станет осознанным для ребёнка (например, приём таблетки в завтрак в игровой форме: «Поел сам – накорми свою “щитовидку”!»).
Очень важно понять, что такая мощная оздоровительная мера, как приём йодированной таблетки, не отразится на семейном бюджете, поскольку её стоимость – не выше, чем у подушечки или пластинки жевательной резинки. Продолжим игру: «Малыш, неплохо иметь свежее дыхание, но не за счёт таблетки йода». (На удивление, так много говорят и пишут сегодня о дефиците йода, но пока ни одному производителю жвачки не пришло в голову выпускать йодированный товар. Спрос был бы небывалым!..).
Препарат «Бальзам Возрождение»
Он стимулирует иммунитет, обладает антимикробным, противовирусным действием, применяется при заболеваниях печени, гормональных нарушениях (таких как сахарный диабет, заболевания щитовидной железы), мощный антиоксидант. Впечатляющие результаты дает применение “бальзама Возрождение” для профилактики таких серьезных заболеваний как туберкулез, онкологические поражения, болезни суставов, инфарктах и инсультах.
В профилактических целях рекомендуется развести 1 столовую ложку суспензии в 100 мл воды, комнатной температуры и принять весь раствор 1 раз в день за полчаса до еды. Курс – от 1 до 6 месяцев. Эта схема применяется для предупреждения дефицита йода, онкологических, гинекологических, сердечно-сосудистых, бронхо-легочных заболеваний (в том числе туберкулеза, пневмоний, обструктивных бронхитов и т.д.), повышения общей активности, сопротивляемости простудным заболеваниям и вирусным инфекциям. Применение бальзама способствует устранению последствий приема антибиотиков, химио- и лучевой терапии; снимает алкогольную и лекарственную интоксикацию, предупреждает возникновение инфекций мочеполовой системы, ЖКТ, аллергических реакций и кожных заболеваний (см. инструкцию к препарату). «Бальзам Возрождение», нормализует как усиленное, так и ослабленное иммунные состояния.
В столовой ложке суспензии – почти 50 мг йода! В основу создания были положены выдающиеся открытия в области иммунологии. Это – возможность молекул передавать информацию, или способность включать программу «Самоуничтожение» всему чужеродному в организме человека.
1.10. Спектр йоддефицитных заболеваний:
Проблема зоба волнует умы людей на протяжении всей истории человечества. Зоб был впервые описан еще до нашей эры. Связь же между дефицитом йода и зобом была впервые установлена только в позапрошлом столетии, когда французским ученым Куртуазье был получен йод из золы морских водорослей, а ученый Бауман определил наличие йода в щитовидной железе. Йод - необходим для нормального роста и развития животных и человека. Запасы йода в организме невелики. В организме 5человека он присутствует совсем в небольшом количестве – 15-20 мг. Суточная потребность в йоде так же невелика - всего 100 –150 мкг. Важное биологическое значение йода заключается в том, что он является составной частью молекул гормонов щитовидной железы - тироксина и триодтиронина. Дефицит йода являются серьезной проблемой здравоохранения во многих регионах мира. По данным ВОЗ (1990 г.) 1570 млн. человек (30% населения мира) имеют риск развития йоддефицитных заболеваний, в том числе более 500 млн. людей проживает в регионах с тяжелым дефицитом йода и высокой распространенностью эндемического зоба. [15]
-
Аборты, мертворождения.
-
Врожденные аномалии
-
Повышенная перинатальная смертность
-
Эндемический неврологический кретинизм
-
Эндемический микседематозный кретинизм: гипотиреоз, карликовость
-
Неонатальный, раннее детство, неонатальный зоб
-
Явный или субклинический гипотиреоз
-
Нарушения умственного и физического развития
-
Детский и подростковый эндемический зоб
-
Гипотиреоз
-
Зоб и его осложнения
-
Репродуктивные нарушения
-
Риск рождения ребенка с эндемическим кретинизмом
-
Все возраста повышение поглощения радиоактивного йода при ядерных катастрофах
-
Нарушения когнитивной функции
Из продемонстрированной таблицы видно, что спектр йоддефицитных заболеваний весьма широк, тем не менее, наиболее тяжелые из них напрямую связаны с нарушениями репродуктивной функции или развиваются перинатально: врожденные аномалии, эндемический кретинизм, неонатальный зоб, гипотиреоз, снижение фертильности. Таким образом, эндемический зоб и другие заболевания, вызванные дефицитом йода, представляют собой важную медико-социальную проблему. Проведение мероприятий по профилактике дефицита йода и эндемического зоба способно без больших материально-технических затрат в короткие сроки значительно оздоровить население больших регионов России и практически ликвидировать йоддефицитные заболевания. Для преодоления недостаточности йода в питании применяются методы индивидуальной, групповой и массовой йодной профилактики. Массовая йодная профилактика является наиболее эффективным и экономически доступным методом восполнения дефицита йода и достигается путем внесения солей йода (йодида или йодата калия) в наиболее распространенные продукты питания: поваренную соль. Групповая йодная профилактика осуществляется путем организованного приема препаратов, содержащих йод (Йодомарин), группами населения с наибольшим риском развития йоддефицитных заболеваний (дети, подростки, беременные и кормящие женщины). Индивидуальная йодная профилактика проводится у отдельных лиц путем длительного приема препаратов, содержащих физиологические дозы йода (Йодомарин). Рекомендуемые дозы потребления йода дети 0-5 лет – 90 мкг; дети 6-12 лет – 120 мкг; подростки (>12 лет) и взрослые – 150 мкг; беременные и кормящие – 200 мкг. Особое внимание должно отводится профилактике йодного дефицита детям первого года жизни. Если мама кормит ребенка грудью, то достаточно самой принимать препараты йода в количестве 200 мкг ежедневно, этого хватит и ребенку и маме. С 7 месячного возраста, при введении прикорма, необходимо решить вопрос дачи дополнительной дозы йода в виде фармакологических препаратов йодида калия (Йодомарин). Если ребенок находится на искусственном вскармливании или смешанном, то необходимо выбирать смеси для вскармливания с содержанием йода не менее 90 мкг на 1 литр или проводить коррекцию йодного дефицита путем добавления в пищу йода в виде фармакологических препаратов йодида калия. Проведение мероприятий по профилактике дефицита йода способно без больших материально-технических затрат в короткие сроки значительно оздоровить население больших регионов России и практически ликвидировать йоддефицитные заболевания. Для достижения этой цели необходимо приложить дополнительные усилия. Они включают воздействие и образование на всех уровнях, выполнение законодательных актов, регламентирующих йодирование соли и реализацию через торговую сеть, систематический мониторинг уровня потребления йода, защиту от йодного дефицита беременных женщин и детей, а также на предотвращение неконтролируемого йодирования пищевых продуктов различными йодсодержащими пищевыми добавками.
-
Исследовательская часть
2.1. Методы определения йода
2.1.1. Вольтамперометрическое определение йода в сухом молоке, куриных яйцах, продуктах питания и иных средах.
Сотрудники лаборатории проводят сравнительные исследования методов йодирования продуктов питания, в том числе ведут научную работу в области планирования и прогнозирования процесса йодирования яиц кур.

|

|
Лаборатория
|
Взвешивание яйца
|
Метод инверсионной вольтамперометрии (прибор АВА-3) ЙОДА в молоке, куриных яйцах, продуктах питания, кормах для животных и иных средах.
Исследования проводятся по аттестованным методикам выполнения измерений, контроль качества реализуется с помощью международных стандартов качества и подтверждается сравнительными межлабораторными испытаниями.

|
|
Прибор АВА-3
|
|
В последнее время широкое распространение получили йодированные продукты, напитки и биологически активные добавки (БАД), а также традиционно применяемый йодированный пищевой хлорид натрия. Контроль содержания элемента в обычных и обогащенных соединениями йода продуктах представляет собой важную аналитическую задачу. Для определения содержания йода в продуктах питания и напитках предложены различные методы: титриметрия, тест-методы, потенциометрия, вольтамперометрия, электрофорез, спектрофотометрия, хроматография, атомная абсорбция, масс-спектрометрия, нейтронно-активационный анализ. Результаты межлабораторного эксперимента показали высокую сходимость и небольшую погрешность предложенного нами метода инверсионной вольтамперометрии с применением графитовых электродов. На основании данных межлабораторного эксперимента приведенная методика была рекомендована к использованию и прошла аттестацию в органах Минздрава и зарегистрирована в качестве методических указаний (МУК 4.1 1481-03).
Йод и его соединения играют важную роль в процессах метаболизма человека и животных. Источниками йода в организме являются, главным образом, пищевые продукты. Установлена суточная норма потребления элемента – 100-200 мкг [1], что, как правило, не обеспечивается обычным питанием. В связи с этим в последнее время широкое распространение получили йодированные продукты, напитки и биологически активные добавки (БАД), а также традиционно применяемый йодированный пищевой хлорид натрия. С другой стороны, поступление избытка йода в организм может привести к токсическим эффектам. Поэтому контроль содержания элемента в обычных и обогащенных соединениями йода продуктах представляет собой важную аналитическую задачу. Для определения содержания йода в продуктах питания и напитках предложены различные методы: титриметрия [2], тест-методы [3], потенциометрия [4], вольтамперометрия [4-11], электрофорез [12], спектрофотометрия [13], хроматография [14], атомная абсорбция [15], масс-спектрометрия [16], нейтронно-активационный анализ [17]. Следует отметить, что не меньшее значение имеет контроль содержания йода в биологических жидкостях (в первую очередь, в моче и крови), поскольку позволяет оценить количество усвоенного организмом элемента. Для рутинного лабораторного анализа вполне применим метод инверсионной вольтамперометрии с применением графитовых электродов [5-7], позволяющий исключить работу с любыми формами ртути. Данный метод основан на способности йода (I2) образовывать малорастворимые осадки состава I2HalR, представляющие собой соли гидрофобного катиона R+ и смешанного тригалогенида I2Hal– (где Hal – хлорид или бромид) по следующей схеме [5-7]:
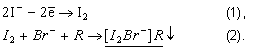
Иодид-ионы при достаточно положительном потенциале окисляются до элементного йода I2 (реакция 1), после чего в присутствии галогенид-иона Hal и молекулы органического катиона R образуется осадок (реакция 2). Далее при катодной поляризации индикаторного электрода происходит восстановление йода в составе ассоциата, при этом на вольтамперограмме регистрируется пик, высота которого пропорциональна концентрации иодид-ионов в растворе (рис. 1). Данный метод успешно применялся при анализе отдельных пищевых продуктов, природных и промышленных объектов [5-7]. Оптимизация ряда экспериментальных параметров проведена нами ранее в работе [7]. Исследовано влияние природы и структуры R, материала электрода, состава и концентрации фонового электролита, а также параметров регистрации вольтамперограмм на величину тока катодного растворения I2HalR.
Электрохимические параметры приведены в табл. 1. Определение концентрации йодид-ионов проводили методом добавок.
Метрологическую обработку данных межлабораторного эксперимента проводили в соответствии с ГОСТ Р ИСО 5725-2002 [18].
Поскольку невозможно заменить сомнительные результаты измерений на более корректные, они должны быть исключены как «подлинные» выбросы согласно ГОСТ Р ИСО 5725-2-2002.
Таблица 1.. Метрологические характеристики инверсионного вольтамперометрического метода определения йода.
Общее среднее
|
ñ
|
0,862
|
Дисперсия повторяемости
|
s21
|
0,0219
|
Межлабораторная дисперсия
|
S2L1
|
0,068
|
Дисперсия воспроизводимости
|
S2R1
|
0,090
|
Стандартное отклонение
|
S
|
0,251
|
Доверительная погрешность (Р=0,95)
|
Δx
|
0,138
|
Доверительная погрешность метода (Р=0,95)
|
é, %
|
16,03
|
Систематическая погрешность (Р=0,95)
|
σ, %
|
6,42
|
2.1.2. Титриметрический метод анализа определения йода в хлебе.
При проведении титриметрического анализа используют точно измеренные объемы растворов 2 реагирующих между собой веществ. В основе титриметрического метода анализа лежит реакция окисления-восстановления по схеме:
21-=12+2е~ (1).
Для увеличения растворимости 12 используют растворы йодида калия. При этом образуются йодидные комплексы 13~, что практически не сказывается на величине потенциала пары 12/ Г. В этой реакции свободный йод (или 13~) в растворе является окислителем, а йодид (1~) - восстановителем. Йод, выделяющийся в результате окисления йодид-иона, титруют обычно тиосульфатом натрия (в присутствии крахмала в качестве индикатора) в концентрации, определяемой по уравнению:
2S2032-+I2=S4062-+2I- (2).
Йодометрическое титрование лежит в основе количественного определения йодатов (Ю3~) и йодидов (Г). Основой йодометрического определения йодатов (Ю3~) является реакция:
KV + 5I~ + 6H+=3I2 + 3H2O (3).
В исследуемый раствор, содержащий йодат (Ю3"), добавляется избыточное количество йодида (I) с целью проведения окислительно-восстановительной реакции в кислой среде с высвобождением свободного йода. Дальнейшая процедура количественного определения образовавшегося из йодата свободного йода проводится титриметрически в соответствии с уравнением 2.
Количественное определение йодидов (Г) в растворе также осуществляется титриметрическим методом, при котором йодиды вначале окисляются бромом в кислой среде до йодатов по реакции:
I- + 3 Вг2 + ЗН2О = Ю3~ + 6 Вг- + 6Н+ (4).
Для устранения избыточного количества брома вводится сульфит натрия и(или) фенол или салициловая кислота, что предотвращает дальнейшее окисление йодида. Затем йодаты восстанавливаются с помощью йодидов в кислой среде до молекулярного йода по уравнению (3), а свободный молекулярный йод, растворенный в йодиде калия, оттитровывается тиосульфатом натрия в кислой среде (в соответствии с уравнением 2).
Титриметрический метод анализа - один из наиболее распространенных способов количественного определения йода в различных объектах окружающей среды. Этот метод рекомендован для определения йода в питьевой воде [16], хлебе и хлебобулочных изделиях [6]. Метод рекомендован МЗ РФ [14] для оценки степени йодирования пищевой поваренной соли йодатом калия и применяется в ряде стран (в Индии, Южной Африке и др.) [69, 79]. Международной ассоциацией официальных химиков аналитиков (АОАС) титриметрический метод рекомендован в качестве официального стандартного метода для определения свободного йода в стандартном растворе [35], йода в пищевых продуктах [34], при оценке уровня йодирования соли [32], анализе йода в лекарственных средствах, содержащих йод [33], а также при оценке абсорбированного йода в маслах и жирах [30] и связанного по двойным связям жиров и масел йода [39]. Оценивая титриметрический метод определения йода в объектах окружающей среды, следует отметить его доступность и простоту, а также высокую чувствительность при определении всех форм йода - молекулярного, йоди-дов и йодатов. Вместе с этим следует иметь в виду, что объекты исследования, в частности пищевые продукты и продовольственное сырье, могут содержать вещества (органического и неорганического происхождения), способные как окислять, так и восстанавливать различные формы йода, существенным образом влияя на результат анализа. В качестве индикатора в йодо-метрии используют свежеприготовленный 1% раствор крахмала. При взаимодействии йода с крахмалом протекают 2 процесса - комплексообразование и адсорбция, в результате которых образуются соединения синего цвета. Крахмал следует добавлять в титруемый раствор, лишь когда основное количество йода уже оттитровано, иначе крахмал образует очень прочное соединение с избытком йода; при этом наблюдается перерасход тиосульфата натрия, что ведет к искажению (завышению) результатов анализа. Йодометри-ческое титрование необходимо осуществлять на холоде, так как при повышенных температурах наблюдается потеря йода вследствие его улетучивания из раствора. Кроме того, с повышением температуры снижается чувствительность индикаторной йодкрахмальной реакции. Титрование нельзя проводить в щелочном растворе, поскольку в щелочной среде йод образует гипойодид и некоторые другие продукты реакции. В связи с этим рекомендуется осуществлять титрование в кислой среде (рН 3-5). При титровании в сильнокислых растворах возникает опасность окисления йо-дида (I) кислородом воздуха.
При проведении титриметрического определения йода, помимо указанных выше особенностей анализа, необходимо учитывать, что используемый для титрования тиосульфат натрия при стоянии может превращаться в сульфит под действием кислоты (даже такой слабой, как угольная), что приводит к возрастанию титра тиосульфата. Кроме того, при стоянии раствора наблюдается снижение титра тиосульфата за счет окисления последнего кислородом воздуха до сульфатов. Процесс окисления катализируется ничтожными количествами солей меди. Для стабилизации раствора рекомендуется вводить небольшое количество карбоната натрия. Другой причиной снижения титра тиосульфата является его разложение рядом микроорганизмов, которые всегда находятся в воздухе. Растворы крахмала также разрушаются при хранении в течение нескольких дней под воздействием бактерий. С целью предотвращения действия микроорганизмов к раство-
ру тиосульфата добавляют небольшое количество (до 0,5 мл) хлороформа и(или) карбоната натрия.
2.1.3. Метод высокоэффективной жидкостной хроматографии определения йода в хлебе.
высокоэффективной жидкостной хроматографии
Высокоэффективная жидкостная хроматография (ВЭЖХ) была применена для определения йодидов в жидком молоке и молочном порошке. Белки и нерастворимый материал жидкого и восстановленного молока удаляли с помощью мембранных фильтров. Йодид в фильтрате отделяли от других ионов с помощью обращеннофазовой ионпарной жидкостной хроматографии и анализировали путем селективного детектирования с применением электрохимического детектора. При концентрации 0,5-4,6 мкг йода в 1 г молочного порошка средняя величина определения йода составляет 91%, величина сходимости - 9,0%, степень воспроизводимости - 12,7%. При содержании 300 мкг йода в 1 л молока правильность метода равна 87%, величина сходимости - 8,2%, степень воспроизводимости - 8,3% [37]. Разработан новый метод ионной хроматографии с использованием прямого ультрафиолетового (УФ) детектирования при 210 нм неорганических анионов в солевых растворах (искусственная морская вода) с использованием окта-децилсиликоновой колонки, модифицированной цвитерионом (3-(N,N - диметилмиристиламмонио) пропансульфонатом. Предел обнаружения иодида -0,80 мкг/кг, относительное стандартное отклонение <1,2% [54].
Методы изотопного разбавления
Изотопное разбавление является методом количественного химического анализа с использованием радиоактивных или обогащенных стабильных нукли-
дов в качестве индикаторов. Метод основан на изменении изотопного состава определяемого элемента в результате разбавления при смешении с анализируемым образцом. Характерной особенностью метода является возможность проводить количественное определение при неполном выделении анализируемого вещества. В классическом варианте определение йода основано на изменении удельной радиоактивности при разбавлении в ходе анализа. К анализируемому раствору, содержащему йод, добавляют известное количество изотопа Ш1 (либо 1311). После перемешивания раствора и достижения равновесного распределения изотопов между введенным и анализируемым веществами из раствора выделяют часть анализируемого вещества, измеряют его массу и радиоактивность. При этом его удельная радиоактивность равна таковой вещества в растворе после смешения. Результаты анализа йода в пищевых продуктах методом изотопного разбавления хорошо совпадают с данными, полученными методами нейтронно-активацион-ного анализа и масс-спектрометрии с индуктивно-связанной плазмой [51,52]. При определении концентрации йода в соли, молоке и моче использован метод изотопного разбавления [67]. Подготовка проб способом «сухого сжигания» проводили только при анализе молока. В качестве индикаторного раствора использовали 1311. Электрофоретическое разделение смеси осуществляли в полиакриламидном геле при 300 °С в течение 2 ч. Чувствительность метода - 1 мкг/л; относительное стандартное отклонение - 14%.
2.1.4. Ионселективный метод
Заслуживают все большего внимания методы определения йода в природных объектах с применением йодидселективных электродов. Мембраны этих электродов состоят из малорастворимой соли йодида серебра в смеси с сульфидом серебра. Потенцио-метрический метод с применением йодидселективных электродов широко используется для определения йодидов в питьевой воде. Было установлено, что элементарный йод мешает определению йодида при соотношении больше чем 1:10. Влияние йодат-ионов в нейтральных и щелочных средах несущественно. В кислых средах йодат-ион восстанавливает йодид до йода элементного. Введение в систему восстановителя (арсенита натрия) позволяет проводить суммарное определение йода в сложной системе, содержащей, кроме йода, йодит и йодат.
Устранение влияния ацетата и цитрата достигается внесением 0,005 М соли лантана [11, 12, 38, 49, 61]. С помощью метода ионометрии исследованы концентрация йода в грудном молоке 37 американок и содержание этого микроэлемента в йодированной соли и пищевых продуктах [44].
2.1.5. Метод газожидкостной хроматографии
Метод газожидкостной хроматографии (ГЖХ) разработан для определения общего йода в пищевых продуктах. Органическую матрицу образца разрушали щелочным пиролизом; образующийся йодид растворяли в воде и окисляли до свободного йода добавлением бихромата в присутствии серной кислоты. Освобождающийся при этом йод взаимодействовал с 3-пентаноном, давая 2-йод-З-пентанон, который экстрагировали н-гексаном и анализировали методом ГЖХ с применением электронзахватного детектора (ЭЗД). Правильность метода - 91,4-99,6%, предел определения - 0,05 мкг/г [63]. Аналогично метод ГЖХ был применен для определения йода в молоке и биопробах. При этом вместо 3-пентанона использовали бутанон или ацетон. Стандартное отклонение -1,9%, правильность метода - 95,5% [41, 60]. Разработан простой и чувствительный метод ГЖХ - ЭЗД для определения следовых количеств йода в пищевых продуктах. Метод основан на получении производных йода с 2-(пента-фторфенокси)этил 2-(пиперидино)этансульфонатом в толуоле с использованием гексиламмония бромида в качестве катализатора. Продукт йодирования - пен-тафторфеноксиэтил-йодид детектируется ЭЗД в количестве 2,7 нМ/мкл [59].
2.1.6. Методы изотопного разбавления
Изотопное разбавление является методом количественного химического анализа с использованием радиоактивных или обогащенных стабильных нукли-
дов в качестве индикаторов. Метод основан на изменении изотопного состава определяемого элемента в результате разбавления при смешении с анализируемым образцом. Характерной особенностью метода является возможность проводить количественное определение при неполном выделении анализируемого вещества. В классическом варианте определение йода основано на изменении удельной радиоактивности при разбавлении в ходе анализа. К анализируемому раствору, содержащему йод, добавляют известное количество изотопа Ш1 (либо 1311). После перемешивания раствора и достижения равновесного распределения изотопов между введенным и анализируемым веществами из раствора выделяют часть анализируемого вещества, измеряют его массу и радиоактивность. При этом его удельная радиоактивность равна таковой вещества в растворе после смешения. Результаты анализа йода в пищевых продуктах методом изотопного разбавления хорошо совпадают с данными, полученными методами нейтронно-активацион-ного анализа и масс-спектрометрии с индуктивно-связанной плазмой [51,52]. При определении концентрации йода в соли, молоке и моче использован метод изотопного разбавления [67]. Подготовка проб способом «сухого сжигания» проводили только при анализе молока. В качестве индикаторного раствора использовали 1311. Электрофоретическое разделение смеси осуществляли в полиакриламидном геле при 300 °С в течение 2 ч. Чувствительность метода - 1 мкг/л; относительное стандартное отклонение - 14%.
2.1.7. Метод нейтронно-активационного анализа.
-активационный анализ (НАА) является методом качественного и количественного элементного анализа вещества, основанным на активации ядер атомов и исследовании образовавшихся радиоактивных изотопов (радионуклидов). Вещество облучают ядерными частицами, или у-квантами. Затем определяют порядковый номер и массовое число образовавшихся радионуклидов по их периодам полураспада и энергии излучения. Количественный ак-тивационный анализ состоит в том, что активность образовавшегося радионуклида пропорциональна числу ядер исходного изотопа, участвовавшего в ядерной реакции. Анализ обычно выполняют относительным методом, основанным на сравнении активности анализируемого образца и образцов сравнения с точно известным содержанием определяемых элементов. С помощью метода НАА исследовано содержание йода в стандартных образцах (Standard Reference Materials 1571 Orchard Leaves and 1577 Bovine Liver from the National Institute of Standards and Technology (NIST). При этом получено хорошее совпадение с данными NIST. Абсолютный предел обнаружения - 0,5-10 нг йода в пробе [72]. Метод НАА применен для определения низких концентраций йода в пищевых продуктах и биологическом материале [28,29,46]; абсолютный предел обнаружения - 5 нг йода в пробе. Стандартное отклонение - 5% при концентрации 10мкгв 100 г и 10%-при2мкгв 100 г [71]. С помощью метода НАЛ в Корее изучено содержание йода в грудном молоке женщин, употребляющих большое количество морепродуктов [64]. Метод широко и успешно используется также в Китае, США и других странах для определения среднесуточного потребления йода с рационом питания и содержания йода в продуктах детского питания [53, 57, 46, 28, 29]. Сравнивая НАЛ и церий-арсенитный метод, следует признать, что первый дает более устойчивые результаты [52, 75]. Основным его достоинством являются быстрота проведения, сравнительно небольшая трудоемкость, высокая информативность, возможность проводить анализ без разрушения образца. Широкое использование вычислительной техники для оптимизации условий анализа и обработки спектрометрической информации позволяет повысить точность и надежность метода и создать полностью автоматизированную систему НАА. Основным недостатком метода НАА является низкая доступность аппаратурного оснащения и сложности, связанные с ее эксплуатацией.
2.1.8. Масс-спектрометрический метод с индуктивно-связанной плазмой
Метод ИСП-МС с целью определения йода в пищевых продуктах предусматривает нахождение массы (чаще отношения массы к заряду - m/z) и относительного количества ионов, получаемых при ионизации исследуемого продукта или уже присутствующих в изучаемой смеси. Для элементного анализа йода применяются ионные источники с ионизацией образца в индуктивно-связанной плазме аргона при атмосферном давлении. Метод ИСП-МС был разработан для определения йода в стандартных образцах (SRMs) и морепродуктах. Предел определения - 15 мкг/кг (используя 0,2 г навеску и 50-кратное разбавление). Относительное стандартное отклонение - 3,2-12% при концентрации сухого продукта 4,7-0,17 мг/кг [56].
Указанный метод используется при оценке содержания йода в ряде йодированных продуктов питания и стандартных образцах. Отмечено высокое совпадение результатов анализа с декларируемым количеством йода в пищевом продукте. Относительное стандартное отклонение - 0,6-2,8% для концентраций - 0,1-5 мкг/г. Предел обнаружения - 8 нг/г при навеске 0,8 г [50,70]. ИСП-МС успешно применяется для определения йода в сухом молоке и плазме крови человека [78]. Этим методом в Дании, Филиппинах, Германии [73, 66,51, 55)] исследовано содержание йода в воде и различных пищевых продуктах (молоке, пиве, напитках). В последние годы разработана новая модификация метода ИСП-МС для определения йода в пищевых продуктах и биологических жидкостях. Эта модификация основана на обратно-фазовой жидкостной хроматографии разделения смеси, постколоночном окислении, переводе йода в летучее соединение и последующем ИСП-МС-детектировании. Изучены оптимальные условия этого окисления, температурный режим и рН буфера, условия разделения смеси. Предел определения в зависимости от образца составляет 0,08 и 1,5 мкг/л (в пересчете на йод) [62].
2.1.9. Фотометрические методы
Другую группу составляют фотометрические методы определения йода, среди которых широкое распространение получили кинетические методы. Одним из этих методов, широко применяемых в аналитической практике, является церий-арсенитный. Принцип метода основан на каталитическом действии йода на процесс восстановления четырехвалентного церия трехвалентным мышьяком в кислой среде (метод Кольт-гоффа-Сэнделла) [74]. Скорость уменьшения интенсивности окраски раствора церия зависит от содержания йода и измеряется фотометрическим методом при длине волны 405 нм [3,9]. Реакция должна проходить в строго контролируемых условиях в отношении времени, температуры и рН.
В настоящее время существуют различные варианты кинетического определения йодидов на основе це-рий-арсенитной реакции, которые различаются в основном способами подготовки проб к анализу [9, 25, 58, 80]. Церий-арсенитный метод используется при определении йода в картофеле и рационах питания [21], в ряде пищевых продуктов растительного и животного происхождения [22, 23, 42]. Отработан фотометрический метод определения йода в молоке [40]. Он основан на деструкции органического материала щелочным гидролизом, определении йода по реакции Кольтгоффа-Сэнделлаи последующем автоматическом спектрофотометрическом определении окрашенного производного. Метод позволяет определять концентрацию 0,2 мкг/кг, стандартное отклонение составляет 2,15-7,21%, правильность (возврат внесенной добавки стандарта) метода составляет 90±7%.
Описан автоматический церий-арсенитный метод определения йода в пищевых продуктах. При этом установлено, что «мокрое» озоление пробы позволяет определять йод с более высокой точностью, чем «сухое» щелочное разложение пробы [47]. Установлено, что в зависимости от вида продукта и времени подготовки пробы потери йода составляют от 36,6 до 84,2%, причем органически связанный йод более устойчив, чем неорганический [76]. Наилучшие результаты анализа получают при автоматизации церий-арсенитно-го метода. При анализе стандартного образца (бланковый образец - NBS Standard Reference Material 1549) показаны высокая чувствительность (предел обнаружения - 0,1 нг йода на 1 мл) и правильность метода (90,3-101,3%), широкий интервал линейной зависимости аналитического сигнала от концентрации йода (от 9 до 3360 нг/г), низкая величина относительного стандартного отклонения (3,1%) [48]. Оценивая церий-арсенитный метод, следует отметить его относительно высокую чувствительность, возможность анализа широкого спектра продуктов растительного и животного происхождения, а также биоматериалов. Однако следует иметь в виду токсичность используемых реагентов, необходимость высокой чистоты используемых реактивов и растворов, а также строгой стандартизации условий проведения анализа. Среди каталитических методов получил применение рода-нидно-нитритный метод. Он основан на реакции окисления роданид-иона смесью нитрат- и нитрит-ионов, катализируемой йодид-ионами. Предел обнаружения - 0,5-1,0 мкг в 100 г продукта [26, 27].
Среди различных методов определения йода в кормах и растениях (кинетический роданидно-нитрит-ный, кинетический церий-мышьяковистый, фотометрический с бриллиантовым зеленым, объемный йод-крахмальный) наибольшую чувствительность и воспроизводимость результатов дают кинетические рода-нидно-нитритный и церий-мышьяковистый методы. Первый из них рекомендован также для нужд агрохимической службы [8]. Наряду с этим описан [65] простой метод количественного определения общего йода в пищевых продуктах, основанный на каталитической деструкции тиоционата нитритом в присутствии йо-дида и последующем фотометрическом определении при длине волны 450 нм. Предел определения метода -1 мкг йода в 100 г продукта, правильность - 90%, стандартное отклонение - 10%. Колориметрический метод определения йодидов был оптимизирован для рутинного анализа йода в пищевых продуктах, подвергнутых кулинарной обработке и содержащих большое количество соли. Метод основан на деструкции ферро-тиоцианатного комплекса нитритом, катализируемым йодидом. Предел обнаружения - 2,5 мкг/л, интервал линейности аналитического сигнала - 2,5-12 мкг/л, возврат йодида и йодата -100±10%. По сравнению с МС-ИСП-методом установлено небольшое расхождение результатов (не более 5%) [43, 68].
Известен фотометрический метод определения йода, основанный на образовании комплексного соединения йода с азотистокислым натрием в кислой среде. Этот способ предложен для определения йодидов в воде и общего йода в водорослях и продуктах их переработки [7, 15, 31]. Указанный метод быстр и прост в исполнении, доступен для рутинного анализа, однако он малочувствителен и пригоден лишь для анализа продуктов с высоким содержанием йода (до 0,05%). Недостатком метода является также низкая воспроизводимость результатов анализа, что можно объяснить способностью нитритов окислять йодиды в кислой среде до свободного йода [15].
страница 1 страница 2 страница 3
|