страница 1 страница 2
Методическое пособие
Троян Василий Васильевич
Колесников Эдуард Михайлович
Гриневич Юрий Мечеславович
Козлов Олег Александрович
Игнатович Алексей Сергеевич
ТЕМА: ДИАФРАГМАЛЬНЫЕ ГРЫЖИ У ДЕТЕЙ.
ОБЩЕЕ ВРЕМЯ ЗАНЯТИЯ: 5 часов.
Мотивационная характеристика темы: знание современных представлений о патогенезе, клинике, диагностике и лечении диафрагмальных грыж у детей и использование детскими хирургами, педиатрами, неонатологами и реаниматологами этих данных в повседневной практике.
Цель занятия: повышение эффективности диагностики диафрагмальных грыж у детей врачами различных специальностей и улучшение результатов и качества лечения больных с данной патологией с использованием современных технологий на диагностическом, предоперационном, интраоперационном и послеоперационном этапах.
Задачи занятия:
-
познакомиться с современными представлениями о патогенезе легочной гипоплазии и легочных и сердечно-сосудистых нарушений при диафрагмальных грыжах;
-
рассмотреть современные классификации и диагностические особенности различных видов диафрагмальных грыж у детей и их значение для выбора оптимальной тактики лечения больных;
-
усвоить семиотику и дифференциальную диагностику различных видов диафрагмальных грыж и тактические особенности предоперационной подготовки, формирования предоперационного заключения;
-
провести сравнительную характеристику различных методов оперативного лечения и определить выполнимость лапароскопических и торакоскопических операций в коррекции диафрагмальных грыж у детей различного возраста.
Требования к исходному уровню знаний: полноценное усвоение материала практического занятия возможно при наличии у слушателей достаточных знаний о клинике, лучевой и ультразвуковой диагностике, а также о методах лечения различных видов диафрагмальных грыж у детей.
Диафрагмальной грыжей называется перемещение органов брюшной полости в грудную клетку через естественные или патологические отверстия в грудобрюшной перегородке (диафрагме). В отличие от грыж других локализаций диафрагмальные грыжи не всегда содержит весь комплекс таких обязательных компонентов, как грыжевой мешок и грыжевые ворота.
Частоту данной патологии установить трудно. Некоторые грыжи проявляют себя сразу после рождения ребенка, как, например, ложные грыжи, другие – спустя месяцы и годы, чаще это истинные грыжи диафрагмы, третьи – иногда в пожилом возрасте как, например, грыжи пищеводного отверстия или ретростернальные грыжи диафрагмы. Тем не менее, все эти виды грыж могут встречаться в любом возрасте, в том числе и у новорожденных.
По данным различных мировых неонатологических центров частота данной патологии у новорожденных составляет от 1:2500 до 1:5000 (R.J. Fitzgerald 1989; P. Puri e.a. 1994). Однако, если в статистику включить мертворожденных, то истинная частота заболевания может составить около 1 на 2000 рождений (M.R. Harrison e.a. 1989). В этом возрасте почти в 90 % наблюдений наблюдается перемещение органов из брюшной полости в грудную клетку через задний щелевидный дефект, который, как правило, расположен слева. Двухсторонние ложные грыжи наблюдаются в 3-3,5 % случаев (A.J. Bennett e.a. 2005) и, обычно, несовместимы с жизнью. Другие виды диафрагмальных грыж у новорожденных обнаруживаются редко, всего в 2-5 % наблюдений.
В старшем возрасте чаще встречаются грыжи пищеводного отверстия диафрагмы, затем грыжи купола диафрагмы, и реже - ретростернальные грыжи. Считается, что грыжами пищеводного отверстия диафрагмы страдает около 0,5 % всего взрослого населения.
Следует отметить, что в последние годы, при проведении рентгенологического исследования, по различным показаниям, у бессимптомных детей стало выявляться относительно много случаев ограниченного выпячивания диафрагмы или истинных грыж.
Лечение диафрагмальных грыж у детей, прежде всего оперативное, часто, как, например, при ложных грыжах у новорожденных, по экстренным показаниям. В других случаях возможно наблюдение и консервативное лечение, как это делается при грыжах пищеводного отверстия диафрагмы. Результаты хирургического лечения неоднозначны. Наибольшая летальность, несмотря на все достижения медицины, сохраняется у новорожденных, оперированных по поводу ложных грыж диафрагмы.
КРАТКИЙ ИСТОРИЧЕСКИЙ ОБЗОР
Французский хирург Амбруаз Паре в 1579 г. сообщил о двух случаях травматической диафрагмальной грыжи. Первое наблюдение врожденной диафрагмальной грыжи принадлежит Лазаре Ривьере (1650 г.), который обнаружил дефект диафрагмы у 24–летнего мужчины при посмертном исследовании. В 1769 г. Джовани Морганьи суммировал сообщения о различных видах диафрагмальных грыж и описал первый случай ретростернальной диафрагмальной грыжи.
В 1836 г. R. Bright впервые подробно описал обнаруженную им на секции грыжу пищеводного отверстия диафрагмы у ребенка, хотя сообщения об этой патологии имелись и раньше (P. Billard 1828).
В 1848 г. V.A. Bochdalek (1801-1883), профессор анатомии Пражского университета, сообщил о двух случаях врожденной диафрагмальной грыжи, которая, как он считал, была вызвана разрывом мембраны в люмбокостальном треугольнике. С тех пор врожденные ложные грыжи заднего отдела диафрагмы часто называют грыжами Богдалека.
В 1902г. I. Broman впервые опубликовал данные детального исследования эмбриогенеза диафрагмы. Он установил, что грыжи заднего отдела диафрагмы возникают вследствие недостаточного слияния поперечной перегородки и плевро-перитонеальных складок, а не слабости мембраны в люмбокостальном треугольнике, как считал Богдалек.
В 1888 г. M. Naumann из Швеции впервые сообщил об оперативном лечении врожденной диафрагмальной грыжи у взрослого человека, однако больной умер.
Первое успешное вмешательство было осуществлено O. Aue в 1901 г. у 9 летнего мальчика. Сначала ребенку была произведена резекция ребра и дренирование левой плевральной полости по поводу, как считалось, эмпиемы плевры. Через 4 месяца, на повторной операции было обнаружено выпадение в грудную клетку желудка, толстой кишки и части селезенки через 2,5 см. дефект в диафрагме. Дефект был закрыт дубликатурой из диафрагмы. Ребенок пережил операцию и Первую мировую войну, в которой принимал участие. Этот случай был подробно описан в 1920 г., как пример длительного наблюдения за больным после коррекции диафрагмальной грыжи (цит. по M.I. Rowe e.a. 1995).
В 1928 г. K. Bettmann и G. Hess оперировали 3,5-месячного ребенка, который выжил, а в 1940 г. W.E. Ladd и R.E. Gross из детского госпиталя г. Бостон (США) с успехом восстановили диафрагму у ребенка через 40 часов после рождения. В 1946 г. R.E. Gross опубликовал сведения о первой серии операций при диафрагмальных грыжах, в результате которых выжило 12 из 19 детей. В 1953 г. он сообщает уже о 63 оперированных грудных младенцах, шесть из которых были младше 24 часов. Летальность в этой группе составила 12 %.
В 1960 г. была опубликована на русском языке монография С.Я. Долецкого «Диафрагмальные грыжи у детей», где приводится 100 собственных наблюдений за детьми с различными видами грыж диафрагмы, из которых 60 больных были оперированы.
Последние десятилетия 20-го столетия характеризуются бурным развитием медицинских технологий и выраженным прогрессом в области детской хирургии, анестезиологии и интенсивной терапии. Были усовершенствованы старые и разработаны новые способы диагностики и лечения заболевания. Появились такие новые методы диагностики как фиброэзофагогастроскопия, пищеводная манометрия, сцинтиграфия, ультрасонография, эндоскопическая ультрасонография и некоторые другие. Была усовершенствована дыхательная и другая аппаратура для лечения новорожденных, разработана методика экстракорпоральной мембранной оксигенации (ЭКМО). Появились новые синтетические материалы для пластики диафрагмы. Улучшились условия транспортировки новорожденных в центры детской хирургии. Начали внедряться лапароскопические методы операций. Это позволило значительно улучшить результаты диагностики и лечения врожденных грыж диафрагмы у детей. Появилась возможность внутриутробной, еще до рождения ребенка диагностики порока. В этой связи начали предпринимать попытки оперировать таких детей даже в утробе матери.
M.R. Harrison e.a. 1990, были первыми, кто начал оперировать врожденные диафрагмальные грыжи внутриутробно. Однако, несмотря на тщательный отбор первых 8 больных, три плода погибли во время операции и еще один сразу после рождения. Только последующие 4 операции были успешными – дети родились жизнеспособными.
В то же время, несмотря на достигнутые успехи, многие вопросы лечения диафрагмальных грыж у детей остаются нерешенными. Об этом свидетельствуют высокие цифры летальности, более 50 %, у больных, оперированных вскоре после рождения.
АНАТОМИЯ, ЭМБРИОЛОГИЯ И ПАТФИЗИОЛОГИЯ ДИАФРАГМАЛЬНЫХ ГРЫЖ У ДЕТЕЙ
Анатомия диафрагмы: Диафрагма представляет собой куполообразную фиброзно-мышечную перегородку, которая разделяет грудную и брюшную полости и играет очень важную, принципиальную роль в акте дыхания.
Фиброзная часть диафрагмы (сухожильный центр) расположена больше кпереди, чем центрально, и занимает примерно 35 % всей ее поверхности. Мышечный отдел диафрагмы состоит из: 1) коротких мышечных волокон, начинающихся от мечевидного отростка, 2) мышц, идущих от 6 нижних ребер, 3) мышц, отходящих от медиальной и латеральной дугообразных связок, покрывающих m. psoas и m. guadratus lumborum, 4) позвоночной части – ножек, идущих от первых трех поясничных позвонков.
У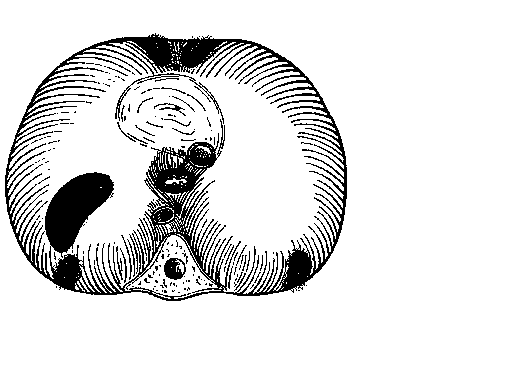
80% людей существует диастаз между мышцами, идущими от латеральной дугообразной связки и теми, что начинаются от реберной дуги. Эта щель, покрытая фиброзной мембраной, носит название вертебро-костального или люмбо-костального треугольника. Богдалек считал, что слабость этого отдела является причиной возникновения врожденных заднелатеральных диафрагмальных грыж. Другими участками, где могут образовываться диафрагмальные грыжи, являются купола, сухожильный центр, ретростернальное пространство и пищеводное отверстие диафрагмы (рис. 1).
1
2
3
4
5
Рис. 1. Общий вид диафрагмы сверху (по Киршнеру)
(цифрами указаны места, где могут встретиться грыжи диафрагмы: 1- щель Богдалека; 2- купол диафрагмы; 3- ретростернальная щель Ларрея; 4- сухожильный центр; 5- пищеводное отверстие диафрагмы)
В норме в диафрагме имеется три наиболее важных отверстия: 1) полая вена проходит через сухожильный центр справа от средней линии; 2) пищеводное отверстие расположено слева от средней линии и слегка кзади от полой вены; и 3) аорта лежит на телах позвонков, ограниченная правой и левой ножками диафрагмы, пересекающимися спереди от нее. В литературе нет описания случаев грыжевого выпячивания органов через отверстия для аорты или полой вены, в то время как в области пищеводного отверстия диафрагмы это наблюдается относительно часто, и частота эта увеличивается с возрастом больного.
Эмбриология диафрагмы: Диафрагма образуется из четырех закладок: 1) поперечная перегородка, 2) парные плевро-перитонеальные мембраны на каждой стороне грудной стенки и средостения, 3) мезенхима, примыкающая к пищеводу, 4) мышцы, врастающие в диафрагму из стенки туловища.
Поперечная перегородка впервые становится видимой на 3-ей неделе гестации (эмбрион 2 мм) и представляет собой мезенхимальное уплотнение, возникающее из перикарда. В это время сердце расположено снаружи и кпереди от эмбриона. Постепенно, с ростом вентральной полости оно занимает положение внутри грудной клетки. Поперечная перегородка по своему происхождению относится к уровню шейных сомитов, однако по мере удлинения дорсальных частей эмбриона возникает ее связь и с нижними грудными позвонками. Поперечная перегородка дает начало большинству мембран, которые отделяют брюшную и плевроперикардиальную полости, однако она не распространяется к дорсальной стенке туловища. Нарушения формирования поперечной перегородки являются причиной образования врожденных грыж переднего отдела диафрагмы.
Плевро-перитонеальные складки возникают из латеральной стенки туловища, которая содержит главные вены, сходящиеся вместе в венозный синус в заднем отделе поперечной перегородки. Эти складки впервые заметны у эмбриона 5 мм. С ростом эмбриона они становятся треугольными мембранами с основанием, располагающимися вдоль латеральной стенки туловища, и верхушкой – в венозном синусе. Основание плевро-перитонеальных мембран перемещается каудально, пока не достигает 11-12-го ребер сзади.
Полное отделение плевральной и перитонеальной полостей происходит в начале 8-ой недели гестации (эмбрион 19-20 мм). Поперечная перегородка; медиастинальная мезенхима и плевро-перитонеальные мембраны соединяются вместе. В последнюю очередь они сливаются в том участке, который носит название плевро-перитонеального канала.
Врожденная задняя диафрагмальная грыжа возникает в случае незаращения этого канала, что приводит к формированию дефекта в задне-латеральной части диафрагмы. Этот дефект в 5 раз чаще встречается слева, чем справа, поскольку правый плевро-перитонеальный канал, благодаря расположенной там печени, закрывается быстрее.
Мышцы диафрагмы развиваются из трех источников. Прежде всего, это миобласты, образующих стенку туловища. По мере развития грудной клетки миобласты этой стенки отделяются от внутреннего абдоминального слоя мышц и мигрируют, образуя диафрагму. Данным процессом можно объяснить, почему в грудной клетке существует только два межреберных мышечных слоя, в то время когда в брюшной стенке имеется три мышечных слоя.
Другие эмбриологи считают, что миобласты развиваются in situ внутри эмбриональных диафрагмальных мембран. Высказывается так же предположение о том, что миобласты диафрагмы происходят из шейной мезодермы, сопровождая диафрагмальный нерв в процессе его опускания. Этим можно объяснить, почему диафрагма иннервируется именно n. phrenicus, исходящим из Ш - V шейных сегментов спинного мозга (M.I. Rowe e.a. 1995).
Эмбриогенез диафрагмальных грыж. Врожденные диафрагмальные грыжи очень широко варьируют по локализации и размерам. Это лишний раз подтверждает мнение, что причиной возникновения данного порока могут быть самые разнообразные нарушения эмбриогенеза. Недавно экспериментально было обнаружено, что врожденные диафрагмальные грыжи часто образуются при контакте беременных крыс с гербицидами. При этом, в 50 % случаев формируются дефекты правого купола диафрагмы (M.I. Rowe e.a. 1995). Определенную роль могут играть генетические факторы, поскольку в литературе имеются сообщения о диафрагмальных грыжах у однояйцевых близнецов, братьев и сестер, двоюродных родственников. Заболевание почти в два раза чаще встречается у девочек.
Причинами аномалий диафрагмы могут быть: 1) нарушения при соединении ее зачатков между собой. 2) нарушения в процессе формирования диафрагмальных мышц. В первом случае формируются ложные грыжи, во втором – истинные.
Согласно современным представлениям, задние ложные диафрагмальные грыжи образуются следующим образом. В норме плевро-перитонеальное отверстие должно закрыться на 8-ой неделе гестации. Кишечник начинает быстро удлиняться уже на 5-ой неделе. В связи с небольшим объемом брюшной полости он выпячивается в пупочный канатик (эмбриональная грыжа). В то же время первичная кишечная петля быстро удлиняется, разделяется на тонкую и толстую кишку и поворачивается из сагитальной во фронтальную проекцию. К 10-ой неделе гестации, через 2 недели после закрытия плевро-перитонеального канала, брюшная полость увеличивается настолько, что удлиненные кишечные петли имеют возможность возвратиться в живот и продолжать там ротацию вокруг корня брыжейки против часовой стрелки. Если дефект в диафрагме к этому времени, по каким то причинам сохраняется, кишечник может сместиться в грудную клетку.
Если диафрагмальная грыжа возникает рано, в эмбриональном периоде, то у ребенка неизбежно имеет место мальротация или несостоявшийся поворот кишечника, для которого характерно отсутствие фиксации брыжейки средней кишки. При развитии выпячивания в поздние сроки гестации или даже после рождения ребенка, обычно отмечается нормальная фиксация брыжейки к задней брюшной стенке. Естественно, что при завершенном процессе ротации кишечника и фиксации брыжейки, в грудной клетке будет расположено меньшее количество кишечных петель.
Причиной образования врожденных грыж переднего отдела диафрагмы, как указывалось выше, являются нарушения эмбриогенеза поперечной перегородки диафрагмы. При этом ложные френоперикардиальные грыжи локализуются в месте слияния поперечной перегородки и плевро-перитонеальных мембран.
Истинные диафрагмальные грыжи, как считается, образуются при нарушении формирования мышц диафрагмы. Мышечный дефект может быть небольшим, но при диффузном поражении мышц купола диафрагмы развивается полная его релаксация. Примером грыж, возникающих вследствие мышечных дефектов, являются так же задние диафрагмальные грыжи с грыжевым мешком и ретростернальные грыжи Морганьи (M.I. Rowe e.a. 1995).
В редких случаях может иметь место полное отсутствие купола диафрагмы, в том числе ее ножек. Это означает, что у больного имеет место полная агенезия всех четырех компонентов, из которых формируется грудобрюшная перегородка. Такие дети, как правило, нежизнеспособны.
Эмбриогенез легочной гипоплазии. Очень важным, можно сказать ключевым фактором, определяющим выживаемость при ложных диафрагмальных грыжах, является степень развития легкого при рождении ребенка.
Развитие легкого начинается на 26–33-й день гестации (эмбрион 4 – 4,5 мм), когда из переднего отдела первичной кишки образуется дивертикул трахеи, который затем расщепляется на легочные зачатки. Последующее развитие дыхательных путей проходит через несколько фаз: железистую, каникуляционную и альвеолярную.
В железистой фазе, от 50-го дня до конца 16-ой недели, в результате дихотомического деления концевых зачатков формируются бронхолегочные сегменты. Они выстланы кубическим эпителием, благодаря чему гистологически напоминают железу.
Каникулярная фаза (17-26-ая недели гестации) характеризуется продолжающимся почкованием периферических воздушных пространств, в результате чего формируются бронхи и альвеолы. В это же время происходит интенсивное врастание капилляров внутрь воздушных пространств.
Альвеолярная фаза или терминальный мешотчатый период продолжается с 26-й недели до конца внутриутробного развития и даже после рождения. На этой стадии происходит быстрое удлинение и увеличение количества тонкостенных воздушных пространств, респираторных бронхиол и альвеолярных мешочков. Жизнеспособность плода, во многом, будет зависеть от величины поверхности альвеолярных мешочков (конечных альвеол).
При рождении имеется около 24 миллионов мешочков, из которых формируются отдельные альвеолы. В это время происходит быстрое увеличение количества альвеол, но не их размеров. Между 3-м и 8-м годами жизни альвеолы начинают увеличиваться не только в количестве, но и в размерах. К 8-ми годам и позже насчитывается уже 200–600 миллионов альвеол. При этом они продолжают увеличиваться в размерах по мере расширения объема грудной клетки, однако новые альвеолы в этом возрасте уже не образуются.
Артерии легких у плода имеют более толстую по отношению к диаметру сосуда мышечную стенку, чем у старших детей и взрослых. В норме, к 3-ему дню после рождения некоторые из артерий, в результате мышечной атрофии и расширения сосудов, становятся по толщине такими же, как у взрослых людей. Такое изменение толщины мышц артериальной стенки связано с самим фактом начала дыхания после рождения, а не сроком после зачатия ребенка.
Легочная гипоплазия возникает в том случае, когда развивающееся легкое плода сдавливается каким-либо образованием, занимающим предназначенное для него пространство, например кишечником, смещенным в грудную клетку. Это подтверждают экспериментальные исследования на плодах овец (M.R. Harrison e.a. 1980), у которых модель гипоплазии легкого создавали путем раздувания силиконового баллона в левой плевральной полости в последнем триместре беременности.
Для легочной гипоплазии, сочетающейся с врожденной диафрагмальной грыжей, характерно уменьшение количества бронхиальных ветвей и альвеол. Поражается также и сосудистая сеть легких. Поскольку число ветвей легочной артерии соответствует количеству бронхиол, то и этот показатель при легочной гипоплазии снижается. Кроме того, артерии сохраняют более толстую мышечную стенку и имеют меньший диаметр. Мышечный слой распространяется даже в небольшие артерии, расположенные дистальнее терминальных бронхиол, подобно тому, как это бывает у детей с меккониальной аспирацией, первичной легочной гипертензией или синдромом гипоплазии левых отделов сердца.
К моменту рождения легкие детей с врожденными диафрагмальными грыжами, по своему развитию могут соответствовать 10-14-й неделям гестационного возраста. Легкое не полностью расправлено, резко уменьшено в объеме, масса его может быть снижена до 30 % от нормы. Легочная ткань уплотнена и ригидна, сегменты ее плохо дифференцируются или не определяются. Количество генераций бронхов сокращено. Особенно выражен дефицит терминальных их отделов вплоть до полного отсутствия бронхиол. При гистологическом исследовании обнаруживают не расправленные альвеолярные пространства. Однако ткань ацинусов сформирована правильно, присутствуют все составные элементы альвеолярной стенки.
Патогенез легочных и сердечно-сосудистых нарушений при диафрагмальных грыжах. Экспериментальные модели диафрагмальной грыжи показывают, что внутриутробная компрессия легких задерживает их развитие. При этом важную роль играет механическое сдавление легкого и нарушение дыхательных движений плода.
Уменьшение дыхательной поверхности легких связано, прежде всего, с уменьшением общей альвеолярной массы вследствие редукции конечных респираторных путей. Подобные гипопластические изменения обычно более выражены на стороне поражения в левом легком и меньше – в правом, которое в определенной степени способно вентилироваться и осуществлять газообмен.
В сосудистом русле гипоплазированных легких отмечается уменьшение диаметра всех легочных сосудов и значительное сужение их просвета за счет резкого утолщения мышечной стенки. Гладкая мускулатура может быть выявлена даже в артериолах, на уровне альвеолярных ходов. Изменения в сосудах, как правило, соответствуют степени гипоплазии легкого.
Нарушения вентиляции легких лежат в основе развития гемодинамических сдвигов, которые в большинстве случаев определяют клиническую картину у детей с врожденной диафрагмальной грыжей.
В результате гипоплазии легких часто возникает легочная гипертензия причинами которой являются уменьшение количества легочных сосудов и объема капиллярного русла, повышение резистентности к кровотоку аномально толстой мышечной артериальной стенки и патологически обостренная реакция артериальной мускулатуры на гипоксию, ацидоз и некоторые медиаторы сосудистого тонуса.
Легочная гипертензия и сопротивление кровотоку в легких приводят к венозно-артериальному шунтированию крови. У больных остаются незакрытыми артериальный проток и овальное окно в межпредсердной перегородке, через которые происходит массивный сброс крови из правых отделов сердца в левые. Это еще более снижает перфузию легких. Легочная ангиография и радиоизотопное сканирование легких, проводимые в клинических условиях, иногда показывают практически полное прекращение перфузии легкого у этих детей.
Шунтирование больших объемов десатурированной крови усугубляет и так уже достаточно выраженные гипоксию и ацидоз. В свою очередь снижение насыщения крови кислородом до 50 мм рт. ст. и рН до 7,13 еще больше увеличивает сопротивление легочных сосудов, что еще больше затрудняет легочной кровоток.
Другой причиной гемодинамических нарушений может быть смещение органов средостения, прежде всего сердца, в здоровую сторону. Смещение приводит к нарушению притока крови к сердцу и венозному застою в системе полых вен. Данный механизм имеет место при любом значительном повышении внуриплеврального давления - напряженном пневмотораксе, пиотораксе или кисте легкого, лобарной эмфиземе и т. д. Клинические наблюдения показывают быстрое улучшение состояния после снятия внутриплеврального напряжения и устранения смещения средостения, даже на фоне не расправленного пораженного легкого.
В целом, цепь патологических сдвигов у детей с врожденной диафрагмальной грыжей можно представить следующим образом. Нарушение вентиляции гипоплазированных легких, легочная вазоконстрикция приводят к повышению сосудистого сопротивления и легочной гипертензии. Вследствие перегрузки малого круга кровообращения происходит право-левый сброс крови через продолжающие функционировать фетальные коммуникации - открытый артериальный проток и овальное окно. Шунтирование крови в определенной степени играет роль компенсаторного механизма и способствует разгрузке правых отделов сердца. Но с другой стороны это усиливает гипоксию и ацидоз и еще больше нарушает легочной кровоток.
Таким образом, замыкается постоянно действующий «порочный круг». Снижение перфузии и газообмена в легких ведет к повышению давления в системе легочной артерии и увеличению сброса крови из правых в левые отделы сердца. Это усиливает гипоксию и ацидоз и еще больше нарушает функцию легких. Усугубляют патологический процесс смещение средостения, нарушения венозного притока к сердцу и застойные явления в системе полых вен.
КЛАССИФИКАЦИЯ ДИАФРАГМАЛЬНЫХ ГРЫЖ У ДЕТЕЙ
В литературе имеется много классификаций диафрагмальных грыж. Например, в 1973 г. была принята классификация, согласно которой врожденные диафрагмальные грыжи делятся на три группы.
1. Эмбриональные, или ложные, грыжи, образующиеся в результате прекращения развития задней части диафрагмы в период до 2-3 месяцев внутриутробной жизни.
2. Грыжи плода, возникающие вследствие нарушения процессов формирования диафрагмы, при этом образуется истинная грыжа с грыжевым мешком, состоящим из серозных оболочек грудной и брюшной полостей.
3. Релаксация диафрагмы, появляющаяся в перинатальном периоде, как результат акушерского паралича диафрагмального нерва.
Наиболее полную классификацию диафрагмальных грыж у детей предложил С.Я. Долецкий (1960 г.).
Классификация врожденных диафрагмальных грыж у детей (по С.Я. Долецкому)
I. Врожденные диафрагмальные грыжи
-
Грыжи собственно диафрагмы
А. Выпячивание истонченной зоны диафрагмы (истинные грыжи)
а) выпячивание ограниченной части купола
б) выпячивание значительной части купола
в) полное выпячивание одного купола (релаксация)
Б. Дефекты диафрагмы (ложные грыжи)
а) щелевидный задний дефект
б) значительный дефект
в) отсутствие купола диафрагмы
-
Грыжи переднего отдела диафрагмы
а) передние грыжи (истинные грыжи)
б) френоперикардиальные грыжи (ложные грыжи)
в) ретроградные френоперикардиальные грыжи (ложные грыжи)
-
Грыжи пищеводного отверстия диафрагмы (истинные грыжи)
а) эзофагеальные
б) параэзофагеальные
II. Приобретенные диафрагмальные грыжи
-
Травматические грыжи
А. Разрывы диафрагмы (ложные грыжи)
а) острая травматическая грыжа
б) хроническая травматическая грыжа
Б. Травматические выпячивания диафрагмы (истинные грыжи)
-
Нетравматические диафрагмальные грыжи
На наш взгляд в клинической практике удобней всего пользоваться классификацией, где врожденные диафрагмальные грыжи делятся на следующие виды в зависимости от их локализации.
Анатомическая классификация врожденных диафрагмальных грыж у детей
-
Грыжи заднего отдела диафрагмы (ложные, переходные)
-
Грыжи купола диафрагмы (истинные, реже ложные)
-
Грыжи переднего отдела диафрагмы
а) ретростернальные (истинные)
б) френоперикардиальные (ложные)
-
Грыжи пищеводного отверстия диафрагмы (истинные)
а) эзофагеальные
б) параэзофагеальные
Сопутствующие заболевания
Анализ большого количества случаев врожденной диафрагмальной грыжи (P. Puri 1999, F.J. Bennett e.a. 2005) показывает, что почти у 50% больных обнаруживаются сочетанные пороки развития. Поражение центральной нервной системы (гидроцефалия менингомиелоцеле, энцефалоцеле и др.) наблюдаются в 25-30 % случаев. У 20 % больных имеют место пороки развития желудочно-кишечного тракта (незавершенный поворот кишечника, атрезии различных отделов пищеварительного канала, грыжи пупочного канатика). В 25 % случаев отмечаются пороки сердечно - сосудистой системы (дефекты межпредсердной и межжелудочковой перегородки, тетрада Фалло, коарктация аорты, дефекты перикарда, эктопия сердца). У 15 % больных встречаются пороки развития мочеполовой системы. Нередко имеет место трисомия по 13 и 18 паре хромосом. Более половины детей рождаются недоношенными. Особенно часто сопутствующие пороки и недоношенность отмечаются у мертворожденных или погибших вскоре после рождения детей с диафрагмальными грыжами.
Высокая частота сочетанных пороков объясняется гетерогенной этиологией диафрагмальных грыж, возникновение которых зависит от воздействия разнообразных тератогенных факторов. Особое значение имеет неблагоприятное воздействие на эмбрион на 8-й неделе гестации, то есть в раннем периоде формирования внутренних органов, в том числе и диафрагмы.
Следует отметить, что гипоплазия легких, открытый артериальный проток и не заращенное овальное окно, которые наблюдаются у большинства больных с врожденными ложными диафрагмальными грыжами, в группу сочетанных пороков не выделяют. Эти изменения сердца и легких считаются характерными для данной патологии.
ГРЫЖИ ЗАДНЕГО ОТДЕЛА ДИАФРАГМЫ
Грыжи заднего отдела диафрагмы могут быть ложными и, значительно реже, переходными. Входными воротами грыжи является щелевидный пристеночный дефект диафрагмы в пояснично-реберном отделе (щель Богдалека). В 80-90 % случаев он встречается слева. Дефект может иметь различные размеры, и чем меньше дефект, тем лучше бывает выражен мышечный валик из остатков диафрагмы по реберному его краю. Обычно валик хорошо выражен у заднего края реберной дуги и исчезает в боковой ее части. Грыжевой мешок чаще всего отсутствует, и органы брюшной полости непосредственно соприкасаются с гипоплазированным легким. В редких случаях (15-20 %) они могут быть отделены от легкого остатками париетальной плевры или брюшины (переходная форма грыжи). В этих случаях, после низведения органов в брюшную полость, мешок должен быть иссечен. В противном случае может сформироваться резидуальная киста, сдавливающая легкое.
Чаще всего в плевральную полость смещаются селезенка, большой сальник, тонкая и толстая кишка, левая почка. Реже, обычно при больших дефектах – желудок и часть левой доли печени. Выявление в грыжевом содержимом желудка или печени считается неблагоприятным прогностическим признаком. Практически у всех этих больных имеются нарушения поворота кишечника, что так же требует коррекции во время операции. Содержимым правосторонних задних грыж обычно является правая доля печени и кишечник.
Клиническая картина. Тяжесть сердечно-легочных нарушений при ложных диафрагмальных грыжах зависит не только от степени компрессии и смещения органов средостения, но и от глубины морфофункциональных изменений в легких и сердечно-сосудистой системе, которые произошли в неонатальном периоде в результате сдавления легкого. Примерно 30 % таких детей рождаются мертвыми и около 35 % умирают вскоре после рождения, еще до поступления в отделения хирургии новорожденных (P. Puri 1999). С другой стороны, около 5-15 % больных с грыжей Богдалека могут прожить месяцы и годы без выраженных проявлений заболевания (I. Berman e.a. 1998; P. Puri 1999, H. Yamamoto e.a. 2005).
Симптоматология ложных диафрагмальных грыжах, в основном обусловлена степенью сдавления органов грудной полости. Эти грыжи чаще, чем истинные, приводят к компрессионному синдрому.
У большинства детей с ложными диафрагмальными грыжами дыхательные и сердечно-сосудистые расстройства возникают сразу или в первые часы после рождения и носят выраженный характер. Наиболее часто имеют место цианоз и одышка, которые проявляются в виде приступов. Это состояние называют «асфиксическим ущемлением», подчеркивая, что на передний план выступают симптомы острой дыхательной и сердечно-сосудистой недостаточности, тогда как симптомы непроходимости кишечника не успевают развиться, так как ребенок подвергается операции или погибает раньше от легочно-сердечной недостаточности.
При осмотре, помимо цианоза, может обращать на себя внимание асимметрия грудной клетки с выбуханием на стороне поражения. Дыхательная экскурсия этой половины груди резко уменьшена. Дыхание частое, поверхностное. Живот, за счет переместившихся в грудную полость органов, обычно запавший, ладьевидный. Перкуторно над соответствующей половиной груди определяется тимпанит, при аускультации – резкое ослабление дыхания.
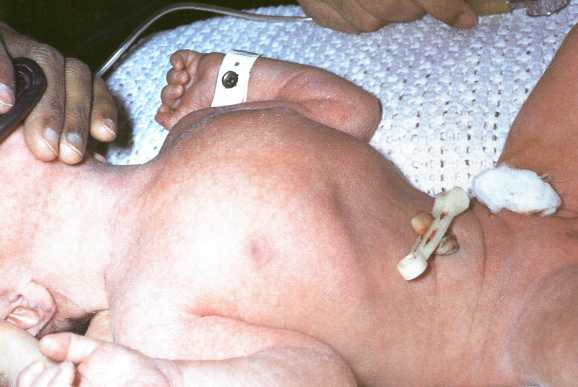

Рис. 2. Внешний вид больного с врожденной ложной диафрагмальной грыжей
Сердечные тоны при левосторонней грыже определяются справа, что указывает на смещение сердца в здоровую сторону (декстрапозиция). Это может иногда дать повод к ошибочному диагнозу истиной декстракардии. В грудной клетке иногда удается выслушать шум плеска или перистальтические шумы.
Приступы цианоза усиливаются при крике, беспокойстве, кормлении или изменении положения ребенка. Даже перекладывание с левого бока на правый может привести к усилению смещения средостения и легких и тем самым к ухудшению состояния. Ухудшение состояния ребенка при кормлении происходит вследствие переполнения желудка и петель кишечника, находящихся в грудной полости, заворота желудка, нарастающего метеоризма, явлений частичной или полной непроходимости желудочно-кишечного тракта.
Нередко, сразу после рождения у ребенка отмечается выраженный цианоз, кожные покровы и слизистые темно-синего или чугунного цвета, дыхание частое поверхностное или редкое, крик слабый. Острая дыхательная недостаточность прогрессирует очень быстро. Этих детей обычно доставляют в хирургическую клинику из родильного дома в крайней степени асфиксии или даже в агональном состоянии. При несвоевременном оказании помощи и искусственной вентиляции легких, они быстро погибают от гипоксии. Летальность в этой группе больных может достигать 70 %.
Шансы на выживание ребенка значительно возрастают и могут достигнуть 100 %, если признаки дыхательной недостаточности проявляются не ранее 24 часов после рождения. У таких детей симптомы нарушения дыхания, одышка появляются и нарастают при плаче, крике, изменении положения. Иногда отмечается упорный кашель, периодически, особенно после кормления, возникает рвота. Однако, в ряде случаев и у этих больных дыхательная недостаточность может протекать тяжело, в виде респираторного дистресса.
Дети старше 3 лет обычно предъявляют жалобы на одышку, утомление при физической нагрузке, слабость, плохой аппетит, головокружение. В физическом развитии они значительно отстают от своих сверстников. Перкуторные и аускультативные изменения обычно те же, что описаны выше, но лучше удается прослушать шум перистальтических волн смещенных в грудную клетку петель кишечника.
У небольшого числа больных брюшные органы не всегда находятся в плевральной полости, а смещаются туда периодически. При этом возникает приступ болей на соответствующей стороне, иногда развиваются одышка, явления частичной кишечной непроходимости.
Диагностика. В настоящее время диагноз диафрагмальной грыжи может быть установлен пренатально при ультразвуковом обследовании беременных женщин. Признаками патологии являются многоводие, расположение желудка или кишечных петель в плевральной полости. Причиной многоводия, по всей вероятности, являются перегибы в области желудочно-пищеводного перехода и/или пилоруса при смещении желудка. Наличие многоводия и смещение желудка в плевральную полость являются плохими прогностическими признаками, которые говорят о большом дефекте диафрагмы. Летальность в этой группе детей может составить 70-90 % (D.K. Nakayama e.a. 1995). При обнаружении диафрагмальной грыжи плод должен быть тщательно обследован сонографически на наличие пороков позвоночника, головного мозга, сердца и почек. Для выявления хромосомных и обменных аномалий выполняют амниоцентез или хорион–биопсию. Если диафрагмальная грыжа является единственным пороком, может быть рассмотрен вопрос о внутриутробной ее коррекции.
После рождения ребенка главным методом диагностики является рентгенологическое исследование. Обследование включает в себя обзорную рентгенографию грудной клетки и, по показаниям, рентгеноконтрастные методы исследования, характер которых зависит от вида предполагаемой патологии.
На обзорной рентгенографии для ложных диафрагмально-плевральных грыжах характерно наличие кольцевидных или ячеистых просветлений по всей пораженной половине грудной клетки. У детей первых дней жизни, как правило, трудно выявить границу коллабированного легкого на стороне поражения. Кольцевидные тени часто имеют пятнистый рисунок без четкого контурирования каждой полости. Характерна изменчивость положения и форм участков просветления и затемнения вследствие перистальтики кишечника. Это признак удается установить путем сравнения двух рентгенограмм, сделанных через некоторый промежуток времени. Тень смещенных грудную клетку брюшных органов определяется не только в проекции плевральной полости, но и в области средостения. При ложных грыжах часто нельзя проследить контур купола диафрагмы на стороне поражения, а тень кишечных петель из грудной клетки плавно переходит на проекцию брюшной полости. Одновременно отмечается снижение пневматизации кишечника в проекции брюшной полости за счет его смещения кверху.
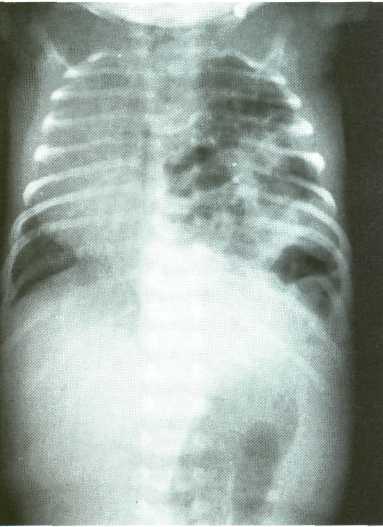
Рис. 3. Обзорная рентгенограмма у ребенка с врожденной левосторонней ложной диафрагмальной грыжей
Смещение органов средостения и сердца зависит от объема пролабировавших в грудную полость органов. У новорожденных и детей первых месяцев жизни смещение бывает столь значительным, что нередко создается впечатление врожденной декстракардии. Рисунок здорового легкого усилен, иногда напоминает частичный ателектаз. Нередко можно видеть медиастинальную грыжу.
В затруднительных случаях диагноз облегчается при наличии зонда в желудке, что позволяет подтвердить его расположение в грудной клетке. Для окончательного заключения, чаще у старших детей, приходится прибегать к контрастному исследованию желудочно-кишечного тракта. Для этой цели используют контрастирование желудка, пассаж контраста по желудочно-кишечному тракту и ирригографию.
Лечение. Все новорожденные с ложными диафрагмальными грыжами нуждаются в оперативном лечении. При этом важным фактором успеха являются сроки проведения операции. В прошлом считалось, что эти больные нуждаются в экстренной операции, которая позволяет освободить плевральную полость и дает возможность для расправления легкого на стороне поражения. Однако за последние 10 лет стало понятно, что немедленная коррекция порока не всегда оказывает благотворное влияние на функцию легких. Результаты операции во многом зависят от степени гипоплазии легких и от степени выраженности легочной гипертензии у больного. Поэтому правильная интенсивная предоперационная подготовка является важным фактором выживаемости этих больных.
Специальная предоперационная подготовка у новорожденных с диафрагмальными грыжами имеет ряд особенностей. Главной целью предоперационной подготовки является стабилизация состояния ребенка, позволяющая провести радикальную операцию. Во многом она определяется степенью имеющихся респираторных, сердечно-сосудистых и других функциональных нарушений.
Больным обязательно ставится желудочный зонд для декомпрессии, проводится коррекция нарушений кислотно-основного и газового состава крови. При выраженной гипоксии ребенка следует перевести на искусственную вентиляцию легких (ИВЛ) с использованием миорелаксантов. Нельзя проводить вентиляцию через маску, поскольку это ведет к газовому растяжению кишечника, что усиливает сдавление легких и усугубляет легочную недостаточность. Поскольку у ребенка имеется недоразвитие легкого не только на больной, но и на противоположенной стороне, ИВЛ следует проводить под давлением не более 20-40 мм. рт. ст. В противном случае может возникнуть пневмоторакс.
ИВЛ позволяет снизить гипоксию и ацидоз, а респираторный алкалоз способствует снижению вазоконстрикции ветвей легочной артерии. Миорелаксанты облегчают проведение искусственной вентиляции легких и, как считают, напрямую снижают давление в легочной артерии. Вазодилятации и уменьшению легочной вазоконстрикции способствует добавление к дыхательной смеси закиси азота. Закись азота быстро разрушается и поэтому системной гипотензии не вызывает. Для снижения легочной гипертензии показано применение вазодилататоров. Возможно использование препаратов допамина и добутамина, которые повышают системное артериальное давление и этим способствуют снижению сброса крови из правых отделов сердца в левые. Очень важен мониторинг газов крови, позволяющий контролировать степень шунтирования кровотока.
При проведении ИВЛ важно следить за состоянием легкого не только на больной, но и на здоровой стороне, где может произойти пневмоторакс при повышении вентиляционного давления.
Если стандартная ИВЛ и другие мероприятия не эффективны, следует применить высокочастотную ИВЛ, которая позволяет довольно успешно снизить гипоксемию и уменьшить вероятность баротравмы легкого. Частота дыхания должна составлять более 400 дых / мин. при низком вентиляционном давлении.
В последние годы, появился еще один резерв выведения новорожденных с диафрагмальными грыжами из тяжелого состояния. Это методика экстракорпоральной мембранной оксигенации (ЭКМО). Ее целью является обеспечение респираторной поддержки до того времени, пока транзиторная фетальная циркуляция крови больного новорожденного изменит свой характер. Показанием к использованию ЭКМО является тяжелый респираторный дистресс, который не удается ликвидировать другими методами. Ее назначают в тех случаях, когда после массивной терапии, включая высокочастотную вентиляцию, на фоне фракционного вдыхания кислорода в концентрации (Fio2) 100 %, у больного сохраняется Ро2 менее 50 мм рт. ст. и Рсо2 более 50 мм рт. ст.
В начале методика использовалась у детей только после коррекции диафрагмальной грыжи. В последнее время ее стали применять как на до операционном этапе, так и во время операции и в послеоперационном периоде. Для ее проведения требуется сложное и дорогое оборудование.
При проведении ЭКМО у больного выполняют забор крови, пропускают ее через мембранный оксигенатор, где происходит газообмен, и возвращают больному. Кровь может быть взята из правого предсердия и возвращена больному в бедренную вену (вено – венозное шунтирование) или артериальную систему (венозно – артериальное шунтирование). Наиболее часто используется венозно – артериальное шунтирование. Для этого ребенку канюлируют правое предсердие через внутреннюю яремную вену и дугу аорты через сонную артерию. Венозную кровь пропускают через резервуар с силиконовой мембраной, проницаемой для кислорода и углекислоты, где происходит обогащение кислородом, и возвращают в дугу аорты. Оптимальной считается поддержка газов в крови на уровне Ро2 = 100 мм рт. ст. и Рсо2 = 30 мм рт. ст. Одновременно проводится искусственная вентиляция легких со скоростью около 10 дых. / мин.
ЭКМО позволяет легким «отдохнуть» до того времени, когда они смогут более или менее нормально функционировать. ЭКМО может быть прекращено, когда на обходную циркуляцию требуется менее 15 % сердечного выброса, а легкие обеспечивают уровень PaO2 выше 60 и PaCO2 ниже 40 при частоте дыхания менее 30 в 1 мин. Продолжительность сеанса может составлять от 24 часов до 2-х и более недель. Поэтому в ряде случаев может возникнуть необходимость выполнения операции на фоне продолжающегося ЭКМО.
При проведении операции с ЭКМО, на фоне гепаринизации организма имеется большая опасность массивных внутрибрюшных и внутриплевральных кровотечений. Риск кровотечения снижается, если во время операции широко использовать электрокоагуляцию и фибриновый клей, а время образования сгустка крови снизить с 175-200 сек. до 120-140 сек., и количество тромбоцитов повысить до 125000 в куб. мм.
В целом, ЭКМО позволяет увеличить выживаемость у детей с самыми тяжелыми формами врожденных диафрагмальных грыж примерно на 15 %, по другим данным – на 50–60 % (J.B. Atkinson a. H. Kutagawa 1993).
Хирургическое лечение ложных диафрагмальных грыж у новорожденных следует проводить после стабилизации состояния.
Доступ может быть торакальным или абдоминальным. Торакальный доступ позволяет осмотреть гипоплазированное легкое и с меньшими техническими трудностями ушить или выполнить пластику диафрагмы. Его недостатком является невозможность выполнения симультантных операций по устранению несостоявшегося поворота кишечника или формирования, в случае необходимости, вентральной грыжи. При абдоминальном доступе легче низвести внедрившиеся органы, правильно расположить их в брюшной полости, устранить незавершенный поворот кишечника. Гипоплазированное легкое можно осмотреть через дефект в диафрагме. Возможно, так же, использование лапароскопической и торакоскопической техники.
В последние годы многие эндоскопические хирурги (F. Becmeur e.a. 2001, K. Schaarschmidt e.a. 2005) подчеркивают преимущества именно торакоскопической техники при лечении ложных диафрагмальных грыж у новорожденных. Троакары в грудную клетку вводят открыто, в плевральной полости создается давление около 2 мм рт. ст. (10-15 % от вентиляционного давления). Операцию проводят в положении с приподнятым головным концом операционного стола. Это позволяет грыжевому содержимому самопроизвольно вправиться в брюшную полость и создает отличные условия для пластики диафрагмы. При лапароскопическом доступе органы брюшной полости низводят в брюшную полость, что по мере ее заполнения затрудняет обзор и ушивание дефекта в диафрагме.
При открытой операции подавляющее большинство хирургов предпочитает использовать абдоминальный доступ. У старших детей операцию осуществляют через срединную лапаротомию. В грудном возрасте предпочтительней поперечный разрез с пересечением прямых мышц живота.
На первом этапе операции кишечник и другие органы низводят в брюшную полость. Важно убедиться, что в брюшную полость низведена селезенка, которая обычно последней «покидает» грудную клетку. После извлечения органов из грудной полости ее следует осмотреть на наличие грыжевого мешка, который присутствует примерно у 20 % больных. Мешок должен быть иссечен, поскольку он мешает расправлению легкого и способствует образованию резидуальной кисты, сдавливающей легкое.
Отверстие в диафрагме ушивают прочными не рассасывающимися матрасными швами. При отсутствии мышечного валика диафрагму подшивают к ребру. При большом дефекте отверстие следует закрыть лоскутом из синтетической ткани, лучше всего тефлоновой сеткой или заплатой из гортекса. При необходимости устраняют незавершенный поворот кишечника.
Рану брюшной полости послойно зашивают наглухо. Грудную полость дренируют тонкой силиконовой трубкой. Некоторые авторы (K.J. Welch e.a. 1986) рекомендуют дренировать и противоположную плевральную полость. Это позволяет избежать напряженного пневмоторакса при баротравме легкого и установить средостение по средней линии путем манипуляций с активной аспирацией с обеих сторон.
Нередко после низведения кишечника под диафрагму обнаруживается несоответствие между вместимостью брюшной полости и объемом кишечника. В этих случаях целесообразно растянуть брюшную стенку пальцами, что бы уместить кишечник в брюшную полость. При необходимости можно не ушивать апоневроз, а выполнить пластику с выкраиванием лоскута из обеих половин апоневроза или сшить только кожу. В редких случаях может потребоваться вшивание в лапаротомную рану временной заплаты из силастика, как это делают при омфалоцеле или гастрошизисе. Обязательно оставляется зонд в желудке для его декомпрессии.
В послеоперационном периоде следует продолжить ИВЛ. При этом концентрация Ро2 в артериальной крови должна составлять 80 - 100 мм рт. ст. Снижать концентрацию кислорода и частоту дыхания следует медленно, поскольку даже небольшое падение Fio2 может привести к выраженному спазму легочных сосудов, восстановлению упорного фетального кровообращения и легочной гипертензии.
Если у больного дренаж установлен в плевральной полости только с больной стороны, активную аспирацию применять не следует, что бы не вызвать смещения средостения. При двухстороннем дренировании достаточно создать разрежение 5-7 см Н2О на больной стороне и 8–10 см Н2О – на здоровой. Обычно этого достаточно, что бы удержать средостение на месте.
Внутриутробная коррекция порока. Основной причиной летальности при врожденных ложных диафрагмальных грыжах является гипоплазия легкого, развившаяся внутриутробно вследствие его сдавления грыжевым содержимым. Поэтому в последние годы стали предпринимать попытки внутриутробной коррекции порока, что позволяло легкому в дальнейшем развиваться нормально. Первоначально данная операция была отработана на плодах овец.
Операцию следует выполнять между 20 и 30-й неделями гестации. В более поздние сроки возрастает риск преждевременных родов, а легкие имеют меньше времени для нормального развития. Операция заключается в извлечении через разрез в матке левой ручки плода, выполнения торакотомии через небольшой разрез по средней подмышечной линии и ушивания дефекта в диафрагме (M.R. Harrison e.a. 1993, J.A. O’Neill e.a. 2004).
В последнее время появилось описание еще одной методики внутриутробной профилактики гипоплазии легких при диафрагмальной грыже. Это внутриутробная блокировка трахеи. Авторы считают, что подобная процедура позволяет легким лучше развиваться, однако метод был пока еще использован только в эксперименте. (M.H. Hedrick e.a. 1994, J.A. O’Neill e.a. 2004).
Трансплантация легкого. Недавно в литературе появились сообщения о возможности выполнения трансплантации легкого у новорожденных при ложных диафрагмальных грыжах и тяжелой гипоплазии обоих легких. Показанием является невозможность прекращения ЭКМО после пластики диафрагмы. Из литературы известно о двух случаях, когда новорожденным вместо пораженного левого легкого была пересажена нижняя доля легкого от взрослого реципиента с одним благоприятным исходом. В послеоперационном периоде этому ребенку продолжали проводить ЭКМО до тех пор, пока пересаженное легкое не начало функционировать. Предполагается, что трансплантант можно использовать временно, пока не созреет легкое на здоровой стороне, или он сможет функционировать постоянно. Считается, что при плохой функции гипоплазированного легкого некоторым больным трансплантация может потребоваться в будущем (M.I. Rowe e.a. 1995, J.A. O’Neill e.a. 2004).
ГРЫЖИ КУПОЛА ДИАФРАГМЫ
Грыжи купола диафрагмы в подавляющем большинстве случаев являются истинными. Грыжевой мешок в данном случае образует участок истонченного купола диафрагмы, который в различной степени выпячивается в плевральную полость. Эти грыжи чаще встречаются справа. Размеры их могут варьировать от небольшого выпячивания диафрагмы, до полной ее релаксации, когда наблюдается истончение и высокое стояние всего купола диафрагмы. Полная релаксация чаще встречается слева. Релаксация может быть врожденной, когда имеется дефект образования мышц купола диафрагмы, а грудо – брюшная перегородка состоит из двух серозных листков. Вторичная релаксация чаще возникает вследствие родового повреждения диафрагмального нерва. Обычно в этих случаях имеет место и сочетанный паралич плечевого сплетения Дюшена – Эрбаха. Повреждение диафрагмального нерва может произойти у ребенка во время операции на шее и средостении или в результате воспалительных процессов и опухолей этой области.
Реже встречаются полные дефекты в куполе диафрагмы с образованием ложных грыж. В этих случаях клиническая картина, течение заболевания и лечебная тактика мало отличаются от таковых при задних грыжах диафрагмы.
Диафрагмальные грыжи с полным отсутствием купола диафрагмы встречаются крайне редко и составляют примерно 1/7 часть от всех ложных грыж. Хирургу редко приходится встречаться с данным видом порока, так как такие дети обычно умирают в родильном доме сразу после рождения. Отсутствие обоих куполов диафрагмы – еще более редкий порок развития, который обычно описывается как казуистика.
Клиническая картина. Выраженность симптомов истинных диафрагмальных грыж зависит от величины грыжевого выпячивания и степени компрессии органов грудной полости. В отличие от ложных грыж, у детей значительно реже отмечается синдром острой дыхательной и сердечно-сосудистой недостаточности, а так же признаки непроходимости или ущемления петель кишечника.
При больших истинных грыжах, то есть значительном выпячивании диафрагмы, более чем в половине случаев симптомы начинают проявляться у детей в возрасте до 3 лет, а иногда, в 10 % случаев, даже в период новорожденности. Клинически чаще всего определяются цианоз и одышка. У детей раннего возраста проявления заболевания более яркие. Дети старшего возраста чаще отмечают боли и неприятные ощущения в области грудной клетки и живота, особенно после еды или физической нагрузки. У них нередко возникает рвота, особенно после приема пищи. С возрастом имеется тенденция к уменьшению выраженности таких респираторных нарушений, как одышка и цианоз, однако отставание в физическом развитии продолжает нарастать, появляется деформация грудной клетки, часто отмечаются повторные пневмонии.
При аускультации и перкуссии выявляются некоторое ослабление дыхания и тимпанит на стороне поражения. В ряде случаев при заполнении кишечных петель жидким содержимым перкуторный звук будет меняться. При левосторонних грыжах перкуторно и пальпаторно не удается определить селезенку. Иногда можно отметить асимметрию живота.
Более чем в 50 % наблюдений при истинных диафрагмально-плевральных грыжах, особенно при выпячивании ограниченной части купола диафрагмы, симптомы заболевания полностью отсутствуют. Это связано со стабильным положением органов внедрившихся в грыжевой мешок и отсутствием большого давления на грудные органы. Физикальные и аускультативные данные при небольших истинных грыжах не позволяют выявить каких-либо нарушений. Дети внешне могут не отличаться от здоровых, хорошо развиваться и не отставать в развитии от своих сверстников.
Диагностика. Рентгенологическая картина истинных диафрагмальных грыж отличается наличием округлой или овальной тени грыжевого мешка с ровным контуром, ограничивающим пролабированные органы брюшной полости. Этот контур, образованный грыжевым мешком, известен как пограничная линия.
Небольшие истинные грыжи почти в два раза чаще встречаются справа, чем слева. Они характеризуются выпячиванием ограниченного участка диафрагмы. Подвижность диафрагмы мало изменена или несколько ограничена. Смещение органов средостения и сердца отсутствует или выражено умеренно.
Большие грыжи почти всегда наблюдаются слева. Истинные грыжи значительных размеров могут захватывать от 30 до 80 % площади диафрагмы. Они могут располагаться в центральном переднем и заднем отделах диафрагмы. Грыжевой мешок проецируется на фоне легочного поля и образует пограничную линию овальной или полуокруглой формы. При этих грыжах коллапс легкого и смещение сердца на рентгенограммах всегда выражены. Угол между нормальным отделом диафрагмы и мешком в области грыжевых ворот прослеживается плохо, особенно на прямых рентгенограммах, в боковой проекции он виден лучше. Обычно угол грыжевых ворот при больших грыжах тупой, но в отличие от релаксации диафрагмы он всегда выражен и может быть определен при исследовании желудочно-кишечного тракта с бариевой взвесью.
При правостороннем расположении содержимым грыжевого мешка чаще всего бывает печень. Когда часть печени входит в грыжевой мешок, он принимает полусферическую форму, его тень становится плотной и интенсивной и сливается в нижних отделах с основной тенью печени. Реже между диафрагмой и печенью пролабирует толстая кишка. В этом случае тень печени будет отодвинута книзу.
Слева содержимым грыжевого мешка чаще всего оказывается дно желудка и/или тонкая и толстая кишка вместе с селезенкой. В этих случаях на фоне легочного поля ниже пограничной линии определяется крупно - и мелкопятнистые полости. Иногда желудок почти полностью заполняет грыжевое выпячивание и выглядит как большая одиночная полость с уровнем жидкости.
В зависимости от степени наполнения желудка и кишки рентгенологическая картина изменяется. Движения грыжевого мешка при дыхании резко ограничены, а иногда носят парадоксальный характер.
В ряде случаев помощь в диагностике может оказать ультразвуковое обследование. Некоторые авторы считают его очень полезным при проведении дифференциальной диагностики истинных и ложных грыж диафрагмы (M.I. Rowe e.a. 1995). Для дифференциальной диагностики диафрагмальной грыжи с опухолями, секвестрацией, врожденными кистами легкого или воспалительными процессами рекомендуют применять пневмоперитонеум, компьютерную томографию и изотопное сканирование печени.
Релаксация диафрагмы характеризуется высоким стоянием диафрагмы на всем протяжении. Она может быть врожденной или приобретенной вследствие повреждения диафрагмального нерва. У многих детей с врожденной релаксацией заболевание может протекать бессимптомно, в то время как при вторичном поражении симптомы дыхательной недостаточности часто бывают выраженными (M.I. Rowe e.a. 1995, J.A. O’Neill e.a. 2004).
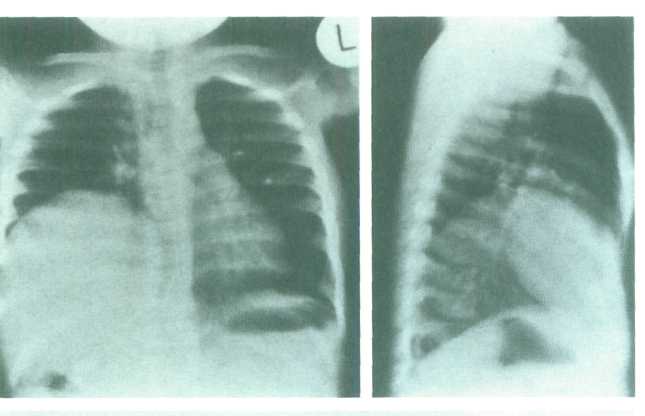
Рис. 4. Релаксация правого купола диафрагмы.
На рентгенологических снимках у этих детей грудобрюшная преграда выявляется в виде тонкой тени правильной дугообразной или полусферической формы. В прямой проекции эта линия распространяется от грудной стенки до средостения; в боковой – от передней до задней грудной стенки. Углов или искривлений этой линии отметить не удается. Уровень стояния диафрагмы различен, но наиболее часто она поднимается до II - III ребра. Характер движений релаксированной диафрагмы так же самый разнообразный. Обычно дыхательные экскурсии резко ограничены, но возможны и парадоксальные движения, когда пораженная часть диафрагмы опускается при выдохе и поднимается во время вдоха, в то время как здоровая половина проделывает обратные движения «симптом коромысла». Под истонченной диафрагмой обычно располагаются печень, газовый пузырь желудка, петли толстой кишки и селезенка, реже петли тонкой кишки. Для того чтобы с большей определенностью судить о взаимоотношении органов, пролабированных в грудную полость, можно провести исследование желудочно-кишечного тракта с бариевой взвесью.
Лечение истинных диафрагмальных грыжа зависит от выраженности симптомов заболевания. При отсутствии симптоматики ребенку показано наблюдение. При наличии жалоб и признаков дыхательной недостаточности ставятся показания к операции.
При истинных грыжах купола диафрагмы большинство хирургов предпочитает использовать боковую торакотомию в VI межреберьи. Перемещенные органы оттесняют в брюшную полость. Для пластики диафрагмы, как правило, используют местные ткани. Даже при значительной аплазии диафрагмы у новорожденных возможно простое ушивание истонченной зоны и пликирование диафрагмы без рассечения грыжевого мешка. В некоторых случаях мешок частично иссекают, а дефект ушивают в виде дубликатуры. Швы накладывают на края рассеченного грыжевого мешка и мышечного дефекта противоположной стороны. Если наружный мышечный валик не выражен, сформированную диафрагму можно подшить к ребру. При очень больших грыжевых воротах и мешке образованном только серозными листками без мышечной прослойки, прибегают к аллопластике. Дефект можно закрыть сеткой из синтетического материала (лавсан, гортекс), или консервированной твердой мозговой оболочкой, которые подшивают к его краям. Не следует во всех случаях стремиться к полному устранению грыжевого выпячивания, особенно при больших грыжах. Это может привести, особенно у новорожденных к несоответствию объема недоразвитого легкого и плевральной полости, разрыву легкого с образованием пневмоторакса. Кроме того, создается угроза повышения внутрибрюшного давления. Операцию заканчивают дренированием грудной полости.
ГРЫЖИ ПЕРЕДНЕГО ОТДЕЛА ДИАФРАГМЫ
Грыжи переднего отдела диафрагмы бывают ретростернальными и френоперикардиальными. Ретростернальные грыжи (истинные) разделяют на загрудинные и загрудинно-реберные. Грыжевое выпячивание из брюшной полости в переднее средостение происходит через дефект диафрагмы позади грудины (щель Ларрея) с образованием грыжи Морганьи (С.Я. Долецкий 1976). Грыжевой мешок образует париетальная брюшина. Некоторые авторы левостороннюю грыжу называет грыжей Ларрея, правостороннюю – грыжей Морганьи. Эти грыжи у детей встречаются в 20 раз реже, чем грыжи заднего отдела диафрагмы. Их содержимым обычно являются часть печени, тонкая и толстая кишка, реже селезенка.
Френоперикардиальные грыжи являются ложными, дефект располагается в сухожильной части диафрагмы и прилегающем к нему отделе перикарда. Через этот дефект брюшные органы могут непосредственно смещаться в полость перикарда и наоборот, сердце частично вывихиваться через дефект диафрагме в брюшную полость (ретроградная грыжа).
Ретростернальный дефект в перикарде и диафрагме может сочетаться с эпигастральным диастазом или эпигастральной грыжей пупочного канатика (пентрада Кантрелла). При этом дистальная часть грудины будет укорочена или расщеплена, часто отмечаются врожденные пороки сердца - дефекты перегородок и тетрада Фалло.
Ретростернальные грыжи
Клиника. Для ретростернальных (парастернальных) грыж более характерны симптомы расстройства функции желудочно - кишечного тракта. Сдавливание легкого или сердца при этой патологии обычно бывает небольшим. У ребенка периодически возникают боли и неприятные ощущения в эпигастральной области, иногда рвота. Одышка, кашель, цианоз встречаются редко. Почти в 50 % случаев данный порок клинически может не проявляться. При осмотре отмечается выбухание передненижнего отдела грудины. Методом перкуссии и аускультации можно определить тимпанит, ослабление сердечных тонов, отсутствие абсолютной сердечной тупости. Если грыжевой мешок заполнен сальником или частично отшнуровавшейся печенью то, наряду с ослаблением сердечных тонов будет отмечаться укорочение перкуторного звука.
При ретростернальных грыжах нередко встречаются сочетанные аномалии, особенно пороки сердца и трисомия 21.
Диагностика. При ретростернальных грыжах на обзорной рентгенограмме определяется тень полуовальной или, чаще грушевидной формы в области загрудинно – реберного пространства. В прямой проекции она проецируется на тень сердца или располагается парамедиастинально. В боковой проекции тень грыжи накладывается на переднее средостение и сливается с тенью сердца. При парастернальном расположении иногда удается проследить пограничную линию (мешок) в виде полуокружности в кардиодиафрагмальном углу. Если в грыжевом мешке находятся полые органы, в пределах пограничного мешка на фоне легкого или сердца, можно выявить крупноячеистые тени. В отдельных случаях можно видеть и типичную гаустрацию толстой кишки. Иногда пролабирует только сальник. Тень при этом может быть плотной, без ячеистых просветлений (рис.5).
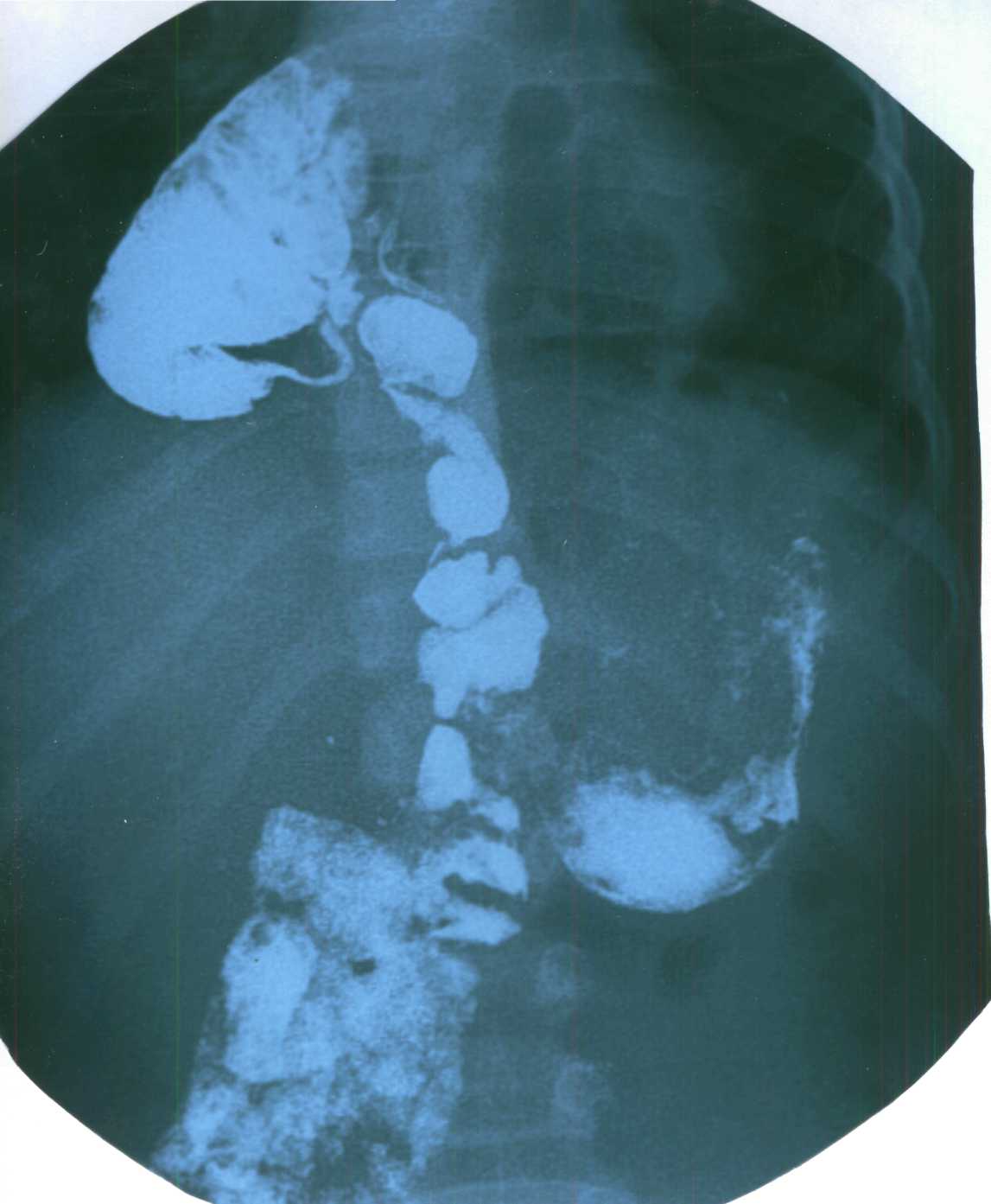
Рис. 5. Реторостернальная грыжа у ребенка 7 лет (прямая проекция
Как и при других видах диафрагмальных грыж, отмечается изменчивость рентгенологической картины.
Диагноз окончательно подтверждается при контрастном исследовании желудочно - кишечного тракта с бариевой взвесью.
При всех грыжах, содержимым которых являются плотные органы, с дифференциально - диагностической целью можно использовать наложение пневмоперитонеума. Воздух при этом окружает грыжевое содержимое, что четко указывает на его принадлежность к брюшным органам (рис. 6).
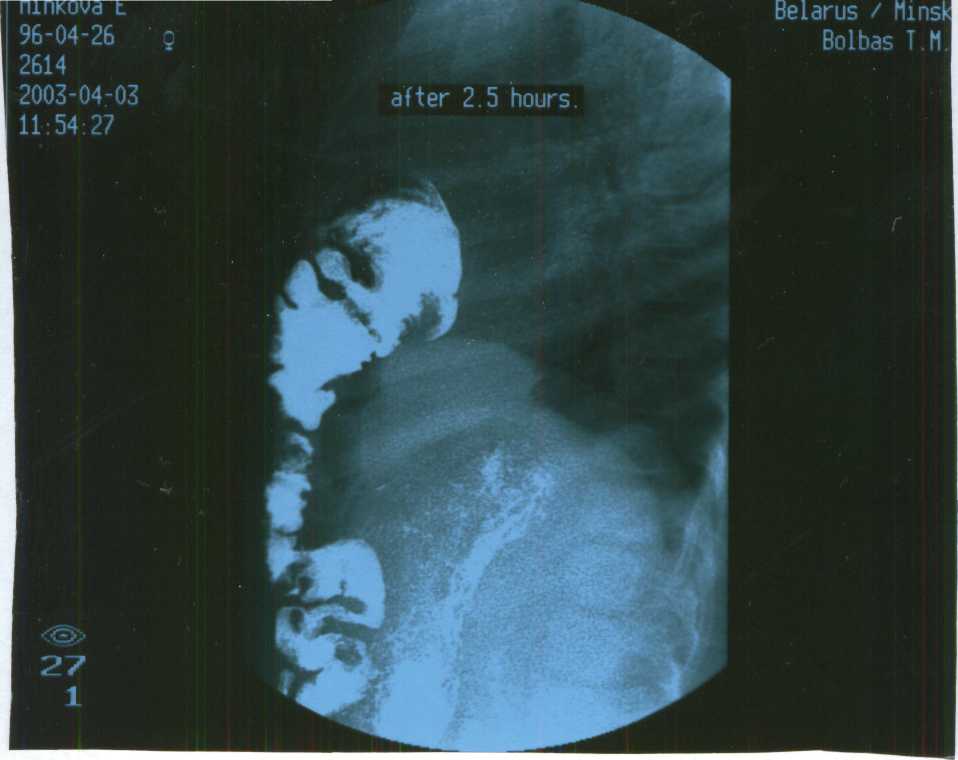
Рис. 6. Ретростернальная грыжа у ребенка 7 лет (боковая проекция.
Лечение. Оперативное лечение при ретростернальных грыжах осуществляют путем верхней срединной лапаротомии. После вскрытия брюшной полости осматривают передние отделы диафрагмы. В грыжевой мешок, расположенный в переднем отделе средостения, обычно входит петля поперечной ободочной кишки, которую низводят в брюшную полость. Грыжевой мешок можно не иссекать. Диафрагму в области пристеночного дефекта подшивают отдельными швами к мягким тканям передней грудной стенки. Не следует подшивать задний край грыжевых ворот к апоневрозу передней брюшной стенки. Такие швы, хотя и надежны, могут иногда привести к натяжению перикарда.
В последние годы в нашей клинике произведено несколько операций по поводу ретростернальных грыж с использованием лапароскопической техники. Операция малотравматична, а проведение ее значительно облегчается тем, что содержимое грыжевого мешка самопроизвольно вправляется в брюшную полость во время заполнения ее газом. Дефект в диафрагме мы ушивали отдельными швами, которые после проведения через переднюю брюшную стенку завязывали подкожно.
Френоперикардиальные грыжи
Клиника. Ведущими симптомами являются цианоз, одышка, беспокойство, реже рвота, возникающие в результате смещения в полость перикарда петель кишечника. Симптомы заболевания часто появляются еще в первые недели и месяцы жизни, с возрастом они не исчезают. Возможно ущемление выпавших в полость перикарда петель кишечника. При осмотре, особенно у детей после 1-2 лет жизни, выявляется выпячивание грудной клетки. Возможна асимметрия живота с втяжением в области левого подреберья. При перкуссии определяется исчезновение абсолютной сердечной тупости. Сердечные тоны приглушены.
При ретроградных френоперикардиальных грыжах, когда наблюдается пролабирование сердца через дефект, на первый план выступают сердечно-сосудистые расстройства. Этот вид диафрагмальной грыжи наиболее часто сопровождается множественными пороками развития (пороки сердца, транспозиция крупных сосудов, поликистоз почек).
Диагностика. При рентгенологическом обследовании у больного определяются ячеистые просветления на фоне сердечной тени. У детей первых часов жизни, когда кишечник еще не заполнился газом, диагностика чрезвычайна трудна. Помощь может оказать контрастное исследование желудочно-кишечного тракта, однако состояние ребенка не всегда позволяет провести дополнительные процедуры.
Лечение. Только хирургическое, путем верхнесрединной или поперечной лапаротомии. При френоперикардиальных грыжах грыжевой мешок полностью отсутствует, органы брюшной полости перемещены в полость перикарда через дефект в переднем отделе сухожильного центра диафрагмы. После низведения грыжевого содержимого в брюшную полость, дефект в диафрагме можно ушить отдельными швами. Однако большинство хирургов предпочитает выполнить пластику дефекта заплатой из инородного материала (гортекс или консервированная твердая мозговая оболочка). Для этого есть две причины. Первая, если дефект большой, простое его ушивание может привести к сдавлению сердца перикардом. Вторая, постоянные биения сердца в области швов часто приводят к их несостоятельности и рецидиву грыжи.
ГРЫЖИ ПИЩЕВОДНОГО ОТВЕРСТИЯ ДИАФРАГМЫ
Грыжи пищеводного отверстия диафрагмы относятся к истинным грыжам и делятся на две большие группы – эзофагеальные и параэзофагеальные. Наиболее часто, примерно в 80-90 % случаев, встречаются эзофагеальные грыжи. При эзофагеальных грыжах пищеводно-желудочный переход, вместе с желудком, смещается через пищеводное отверстие выше уровня диафрагмы. Пищевод обычно имеет нормальную длину, но из-за смещения кверху он может быть деформирован и изогнут. Для параэзофагеальных грыж характерно смещение части желудка и/или других брюшных органов (сальник и кишечник) вверх рядом с пищеводом. Пищеводно-желудочный переход, в этом случае, располагается на обычном месте.
Грыжи пищеводного отверстия не всегда являются фиксированными. Степень смещения кверху и форма желудка могут меняться в зависимости от положения больного, степени заполнения и состава содержимого желудка (плотная пища или жидкая, газ). Перемещение желудка при грыжах пищеводного отверстия может быть частичным или полным.
Эзофагеальные грыжи
Клиника. Клиническая картина эзофагеальной грыжи в основном обусловлена гастроэзофагеальным рефлюксом (ГЭР), возникающим в результате нарушения функции кардиального отдела пищевода. В тех случаях, когда у ребенка сохранена нормальная функция нижнего пищеводного сфинктера, заболевание может протекать бессимптомно.
Симптомы заболевания в большинстве случаев появляются рано, почти в половине случаев в грудном возрасте. Как и при гастроэзофагеальной рефлюксной болезни (ГЭРБ) без эзофагеальной грыжи у детей можно выделить три основных клинических синдрома: рвоты, эзофагита и респираторных осложнений, которые нередко встречаются у одного и того же больного. (В.В. Троян 2003). Следует отметить, что при эзофагеальных грыжах клинические признаки заболевания более выражены и хуже поддаются консервативному и медикаментозному лечению. Поэтому наличие симптомов ГЭР у детей с эзофагеальными грыжами обычно является показанием к коррегирующим и антирефлюксным операциям.
Беспокойство и рвота являются ведущими симптомами заболевания у детей младшего возраста. Рвота чаще связана с приемом пищи, носит самый разнообразный характер, может быть обильной или в виде срыгиваний. В рвотных массах чаще находят желудочное содержимое, иногда с примесью желчи. Вследствие постоянной и упорной рвоты дети плохо прибавляют массу тела. В некоторые периоды, особенно в первые месяцы жизни, даже теряют вес и истощаются. Дети старшего возраста нередко физически хуже развиты.
На признаки эзофагита, боли в животе и изжогу, жалуются в основном дети старшего возраста. Боли, как правило, возникают после еды, в положении лежа или при наклоне туловища, что связано с затеканием желудочного содержимого в пищевод и агрессивным воздействием на его слизистую оболочку.
Эрозивный и язвенный эзофагит могут вызвать скрытые или «оккультные» кровотечения в просвет желудочно-кишечного тракта примерно у 50 % детей. В результате возникает хроническая железодефицитная анемия, причины которой иногда трудно установить. Массивные пищеводные кровотечения в виде кровавой рвоты или мелены, для эзофагеальных грыж не характерны.
Тяжелым осложнением эзофагита являются пептические стриктуры пищевода, обычно вследствие рубцевания язв. Эти стриктуры чаще всего короткие и располагаются в нижнем отделе пищевода.
Нередко, примерно в 30-40 % случаев, особенно у детей раннего возраста, имеют место рецидивирующие аспирационные пневмонии. Часто встречается и другая респираторная патология – трахеобронхиты, ночной кашель, бронхиальная астма. Примерно у 15 % больных формируется оториноларингологическая патология – ларингиты, фарингиты, отиты, синуситы и т. д.
Диагностика. В настоящее время для диагностики эзофагеальных грыж используют рентгенологический метод, фиброэзофагогастродуоденоскопию (ФЭГДС), 24-часовую пищеводную рН-метрию, манометрию и сцинтиграфию пищевода. Поставить диагноз эзофагеальной грыжи позволяют рентгенологическое обследование, сцинтиграфия и ФЭГДС. Остальные из этих методов дают возможность оценить различные аспекты ГЭР.
Рентгеноконтрастное исследование пищевода и желудка в нашей клинике проводится по специально разработанной программе, с использованием функциональных проб - провокационной, нагрузочной и водно-сифонной (В.В. Троян 2003).
Главным рентгенологическим признаком эзофагеальной грыжи является смещение желудка вместе с кардиальным его отделом выше диафрагмы (рис. 7). В отличие от ампулы пищевода, которая имеет форму «цистоида» с гладкими контурами, для эзофагеальной грыжи характерна неровность контуров и, как правило, больший поперечный размер. Кроме того, эзофагеальная грыжа выявляется при любом положении тела, в то время как ампула пищевода формируется только в горизонтальном положении больного.
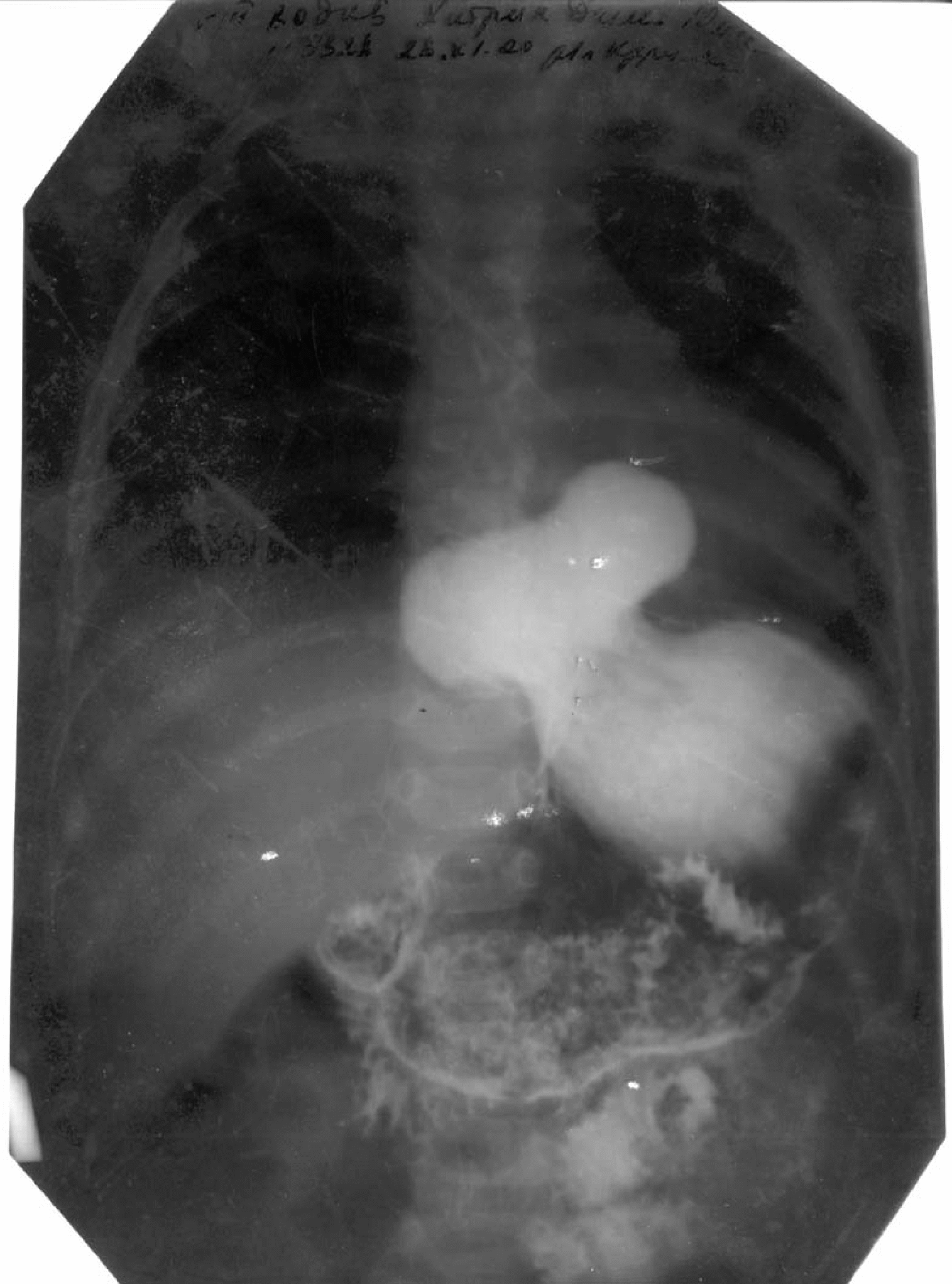
страница 1 страница 2
|